肠型胃癌细胞中酪蛋白激酶2相互作用蛋白1与转化生长因子β1表达的相关性
2019-02-23尹丹曹颖王礼鑫马亮褚明亮王剑文建力官志忠
尹丹 曹颖 王礼鑫 马亮,3 褚明亮 王剑 文建力 官志忠
1贵州医科大学病理教研室(贵阳550004);2贵州省人民医院病理科(贵阳550002);3贵州大学医学院(贵阳550025)
胃癌是消化系统常见恶性肿瘤之一。Lauren分型是常用的胃癌组织病理学分型方法,将胃癌分为肠型、弥漫型、混合型和不确定型。我国胃癌高发并以肠型胃癌为主,因此研究肠型胃癌的发病机制对胃癌防治有着重要意义。
目前认为胃癌的发生、发展过程中,涉及多种促癌、抑癌基因的表达失调,最终导致各种蛋白产物的表达失衡[1]。酪蛋白激酶2 相互作用蛋白1(casein kinase 2 interaction protein 1,CKIP-1)是新近发现的一种调控蛋白。本课题组前期研究发现,CKIP-1 可能作为一种抑癌基因参与了肠型胃癌的分化、浸润及转移[2],但确切分子机制并不清楚。近年来,转化生长因子β1(transforming growth factor-β1,TGF-β1)在胃癌的发生发展过程中的作用逐渐引起了学者的重视,胃癌细胞通过上调TGF-β1表达后促进了胃癌细胞浸润及转移[3-4]。近期有研究报道,CKIP-1 可能在TGF-β1通路中发挥负性调节作用,是TGF-β1的负性调节因子[5],但肠型胃癌中CKIP-1 是否通过负性调节TGF-β1表达参与了癌细胞的恶性分化及浸润转移,未见相关研究报道。本研究通过观察不同分化肠型胃癌细胞中CKIP-1 与TGF-β1表达及相关性,构建过表达及干扰表达CKIP-1的人肠型腺癌MKN28细胞后检测TGF-β1表达改变,初步探讨肠型胃癌细胞中CKIP-1与TGF-β1表达的相关性及其在肠型胃癌恶性转化中的可能作用。
1 材料与方法
1.1 细胞株 人肠型胃癌MKN28 细胞、SGC7901细胞、BGC823 细胞、MKN45 细胞、AGS 细胞及人肾细胞293T 分别购于湖南赢润生物技术有限公司及中国科学院上海细胞生物研究所细胞库。
1.2 主要试剂 兔抗CKIP-1 多克隆抗体、兔抗TGF-β1多克隆抗体及兔抗GAPDH 抗体购于Abcam公司;pLenti CMV Puro Empty 质粒、pLKO.1-Puro 质粒、pLenti CMV-no-target 质粒及pLko.1-non-target 质粒购于Addgene 公司;CKIP-1 质粒、PMD2G 质粒及PAPSX2 质粒购于上海吉凯基因化学技术有限公司。
1.3 过表达及干扰表达CKIP-1 的人肠型腺癌MKN28 细胞模型构建
1.3.1 过表达和干扰表达CKIP-1 的慢病毒载体构建 构建过表达CKIP-1 载体pLenti CMV-CKIP-1 和干扰表达CKIP-1 载体pLKO.1-CKIP-1,其中CKIP-1 过表达有效序列为5-ATGATGAAGAACAATTCCG-3(上游),5-TCACATCAGGCTCTTCCGGATC-3(下游);CKIP-1 干扰表达有效序列为:5-CCGGCCTGAGTGACTATGAGAAGCTCGAGCTTCT -CATAGTCACTAAGGTTTTTG-3(上游),5-AATTCA AAAACCTGAGTGACTATGAGAAGCTCGAGCTTCTCATAGTCATCAGG-3(下游)。构建成功后经基因测序与比对分析基因序列与NCBI 公布的序列完全一致。
1.3.2 慢病毒包装 将构建好的质粒、pLenti CMV-no-target 质粒、pLko.1-non-target 质粒、PMD2G 质粒、PAPSX2 质粒分别进行高纯度无内毒素抽提,测序成功后将目的质粒与辅助包装质粒(PMD2G、PAPSX2)共转染293T 细胞,6 h 后更换完全培养基,48 和72 h 分别收集细胞上清液置于-80 ℃冰箱保存。分别以pLenti CMV-no-target 空载组、pLko.1-non-target 空载组作为阴性对照组。
1.3.3 病毒感染细胞及稳转细胞株的筛选 取对数期人肠型胃癌MKN28 细胞接种于6 孔板中,铺板过夜后更换培养基,分别加入适量病毒液及Polybrene(终浓度为6 μg/mL),72 h 后更换含有10 μg/mL 的嘌呤霉素的完全培养基进行嘌呤霉素抗性筛选,待细胞融合度达到80%左右进行后续实验。
1.4 Real-time PCR 检测 提取总RNA,然后逆转录合成cDNA;按照RT-PCR 试剂盒说明书进行Real time PCR 扩增反应,反应体系均为20 μL。用于扩增CKIP-1 的引物序列5-AGGTTCAGGGACTGGGAGAT-3(上游),5-TCTGCAGGTCCATCTG TCTG-3(下游)。以β-actin 作为内参基因,β-actin的引物序列5-TGGCACCCAGCACAATGAA-3(上游),5-CTAAGTCATAGTCCGCCTAGAAGCA-3(下游)。
1.5 Western blotting 检测 收集细胞提取总蛋白并蛋白定量。经10%聚丙烯酰胺凝胶电泳分离蛋白,转膜装置将胶上的蛋白转到PVDF 膜上。分别将PVDF 膜与一抗CKIP-1(1∶1 000)、TGF-β1(1∶500)及GAPDH(1∶20 000)4 ℃过夜,TBST 洗膜,二抗室温孵育1 h,TBST 洗膜,ECL 化学发光法显色、定影。用Labworks 软件分析结果时以GAPDH蛋白条带作为内参照,计算CKIP-1、TGF-β1蛋白条带与GAPDH 蛋白条带像素灰度的百分比值作为CKIP-1、TGF-β1蛋白表达的相对水平。各组均设复孔3 个,重复实验3 次。
1.6 统计学方法 采用SPSS 20.0 统计软件进行统计分析,数据以表示。组间比较采用单因素方差分析,后续组间两两比较采用LSD-t检验,方差不齐时采用秩和检验。相关性分析采用Spearman 相关性分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 不同分化肠型胃癌细胞CKIP-1 与TGF-β1表达及相关性 与高分化胃癌MKN28 细胞相比,中分化SGC7901 细胞与低分化BGC823、MKN45及AGS 细胞CKIP-1 表达降低、TGF-β1表达升高(P<0.01);与中分化SGC7901 细胞相比,低分化BGC823、MKN45 及AGS 细 胞CKIP-1 表 达 降 低、TGF-β1表达升高(P<0.01)。Spearman 相关性分析显示,CKIP-1 与TGF-β1在不同分化肠型胃癌细胞中表达负相关(r=-0.689 2,P<0.01)。不同分化肠型胃癌细胞中CKIP-1 与TGF-β1表达及相关性见图1。
2.2 过表达及干扰表达CKIP-1 的胃癌MKN28细胞模型鉴定 与空白对照组相比,过表达CKIP-1组mRNA 及CKIP-1 蛋白表达水平分别增加了282.53% 及256.16%(P<0.01),干扰表达CKIP-1组CKIP-1 蛋白及mRNA 表达水平分别降低了64% 及72%(P<0.01),阴性对照组与空白对照组CKIP-1 mRNA 及蛋白表达水平差异无统计学意义,提示过表达及干扰表达CKIP-1 的胃癌MKN28细胞模型构建成功。过表达及干扰表达CKIP-1的胃癌MKN28 细胞CKIP-1 mRNA 及蛋白表达见图2。
2.3 过表达及干扰表达CKIP-1 的胃癌MKN28细胞TGF-β1的表达 与空白对照组相比,过表达CKIP-1 组MKN28 细胞TGF-β1表达水平下降(P<0.01),干扰表达CKIP-1 组MKN28 细胞TGF-β1表达水平升高(P<0.01),阴性对照组与空白对照组TGF-β1表达水平差异无统计学意义。过表达及干扰表达CKIP-1 的胃癌MKN28 细胞TGF-β1的表达见图3。
3 讨论
目前认为,肠型胃癌的发生可能是通过一系列胃黏膜前期病变,如慢性萎缩性胃炎、肠上皮化生、胃黏膜上皮异型增生所构成的Correa 氏级联反应发展而来[6]。CKIP-1 是酪蛋白激酶2(casein kinase 2,CK2)相互作用蛋白,其N-末端含有一个PH 结构域,C-末端含有一个亮氨酸拉链基序的结构域,这种特殊结构使许多蛋白均可与CKIP-1发生相互作用,参与调控多条信号通路,在骨骼、肿瘤发生发展、肌肉细胞分化和免疫等方面发挥着重要的作用[7-11]。当前对CKIP-1在骨骼中的研究最为深入,CKIP-1 在成年骨形成过程中至关重要,已成为骨质疏松症治疗最有希望的药物靶点之一[9-10]。近年来研究显示,CKIP-1 作为一种潜在的肿瘤抑制基因可能在大肠癌发生发展中起到重要作用[12-13]。由于胃黏膜肠化生上皮在组织学上与肠上皮非常相似,肠型胃癌常常发生于肠化生的基础上,胃黏膜肠化生上皮向肠型胃癌转变过程可能是否也存在类似的机制呢?为探讨该问题,本课题组前期检测了胃癌患者癌组织中CKIP-1 的表达[2],发现与正常胃黏膜相比,胃肠化细胞CKIP-1蛋白表达显著增高;而肠型胃癌细胞CKIP-1 表达又较胃肠化细胞CKIP-1 表达降低,并随癌细胞分化程度下降、临床分期越晚CKIP-1 表达则越低;干扰CKIP-1 表达后胃癌细胞的增殖、迁移和侵袭能力增加,反之过表达CKIP-1 蛋白后胃癌细胞增殖、迁移和侵袭能力降低。上述结果提示,CKIP-1 可能作为一种抑癌基因参与了肠型胃癌的发生发展,但CKIP-1 通过调控哪些下游蛋白或信号通路参与肠型胃癌的发生发展却并不清楚。
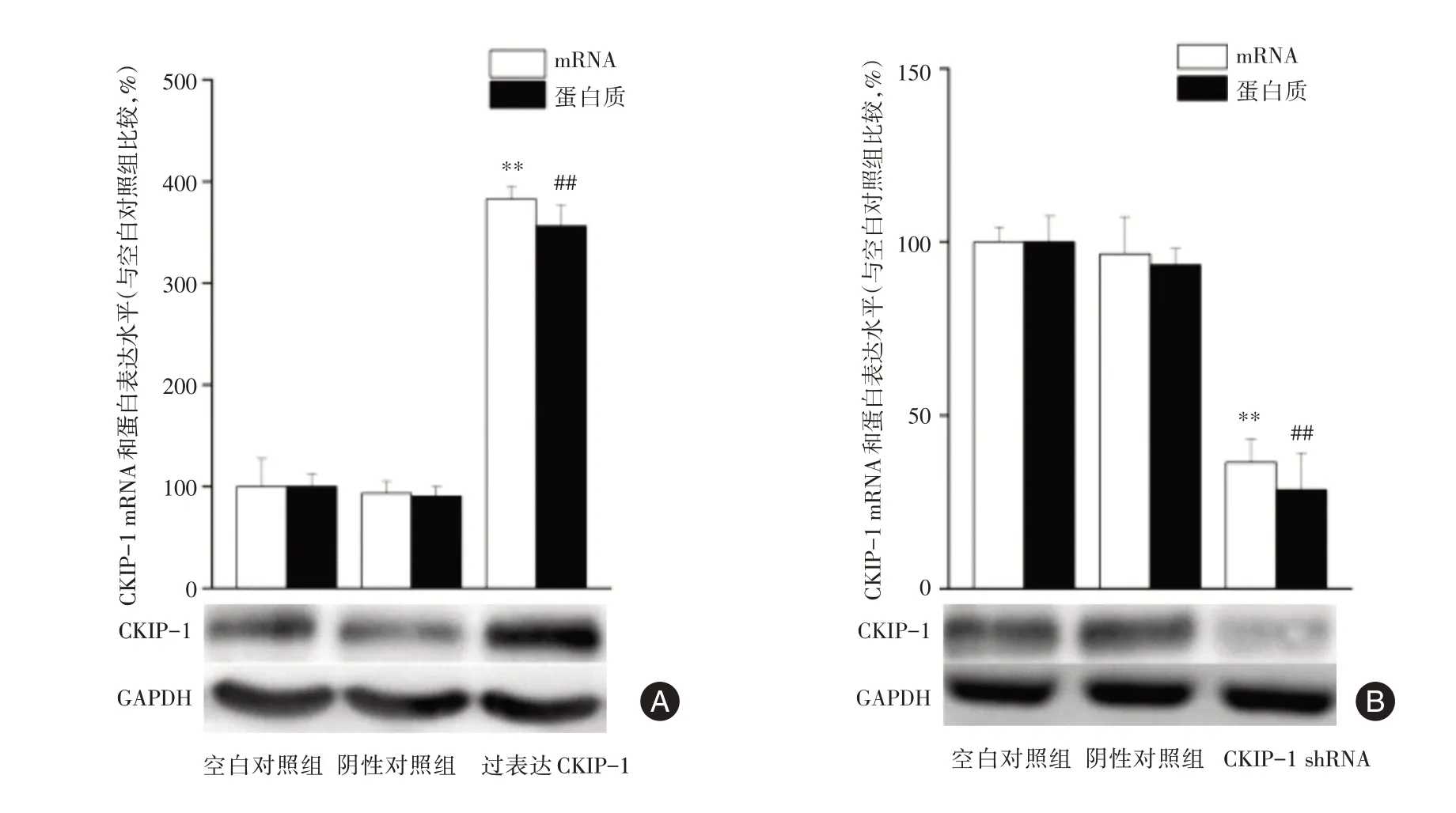
图2 过表达及干扰表达CKIP-1 的胃癌MKN28 细胞CKIP-1 mRNA 及蛋白表达Fig.2 The expression of CKIP-1 mRNA and protein in MKN28 cell of gastric cancer with overexpression CKIP-1 and CKIP-1 shRNA
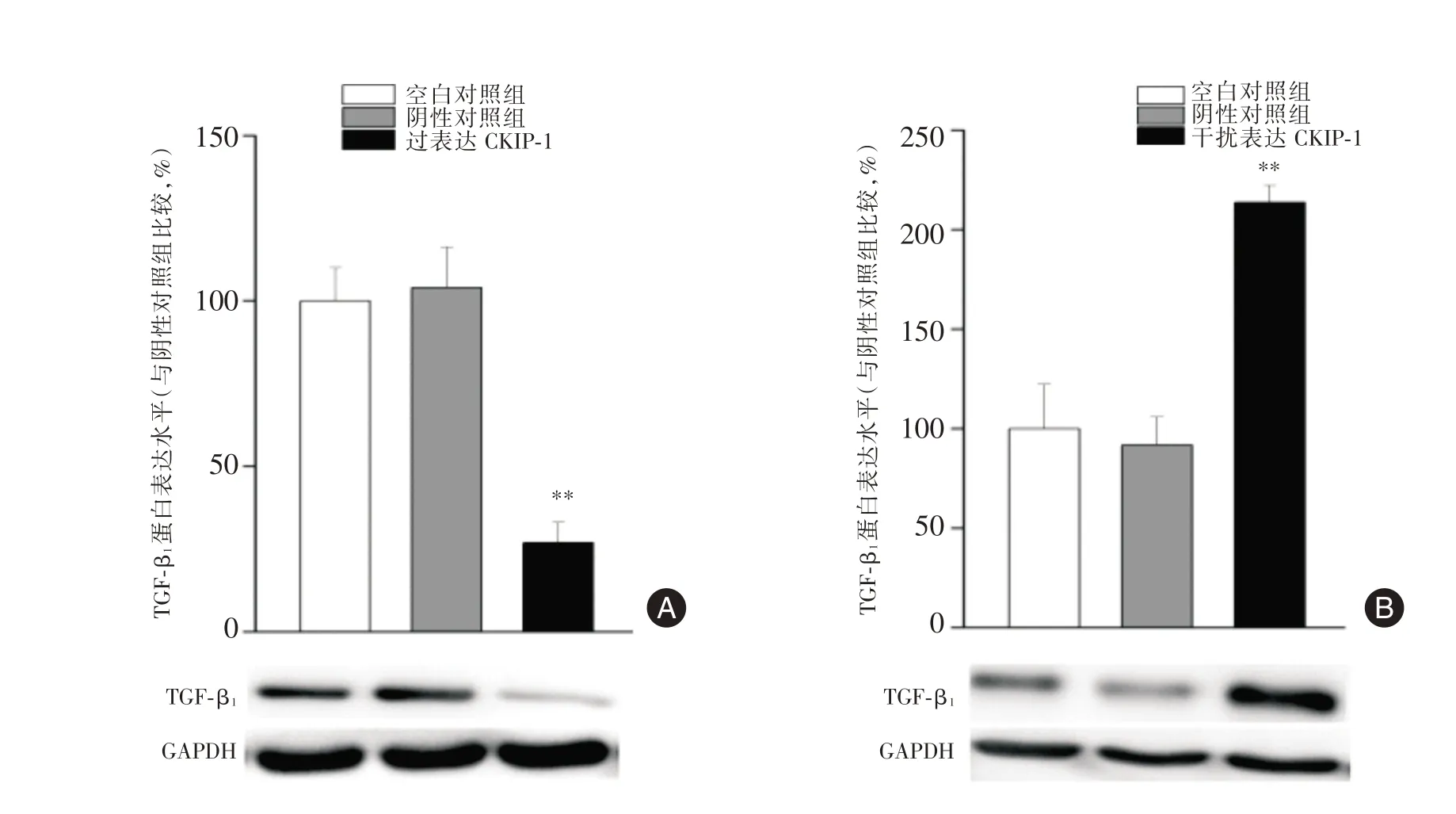
图3 过表达及干扰表达CKIP-1 的MKN28 细胞TGF-β1的表达Fig.3 The expression of TGF-β1 protein in MKN28 cell of gastric cancer with overexpression CKIP-1 and CKIP-1 shRNA
TGF-β1是一种具有多种生物学活性的多肽类细胞因子[14]。近年来,人们逐渐认识到TGF-β1可能在胃癌的发生发展及转移过程中起到重要作用。随胃癌组织分化程度变低、临床分期的进展以及淋巴结转移的出现,TGF-β1表达逐渐增强[4,11,15],通过刺激血管生成、细胞播散、免疫抑制及合成细胞外基质等提供适宜肿瘤生长、浸润及转移的微环境促进胃癌细胞的生长浸润及转移[3]。近期有研究提示CKIP-1 可能在TGF-β1通路中发挥负性调节作用。CKIP-1 可上调泛素连接酶(smad ubiquitination regulatory factor 1,Smurf1)活性[7,13]。Smurf1 是第一个被发现的可以降解TGF-β1底物Smads 的细胞因子,推测CKIP-1 可能通过上调Smurf1 活性后降解Smads 蛋白,从而抑制TGF-β1的表达,在TGF-β1通路中发挥负性调节作用。另有研究对不同年龄SD 大鼠软骨中CKIP-1 和TGF-β受体1 表达时发现,随年龄增加CKIP-1 表达水平升高,而TGF-β 受体1 表达下降,提示CKIP-1 在关节软骨增龄性变化中可能通过Smad7 的作用而降解了TGF-β受体1[5]。本课题组也发现过表达CKIP-1 的前列腺上皮BPH-1 细胞中TGF-β1表达下降(数据另文发表),也提示CKIP-1 可能在TGF-β1通路中发挥负性调节作用表达。
前期研究中笔者发现临床胃癌患者癌组织和肠型胃癌细胞中CKIP-1 表达与分化浸润转移负相关,推测肠型胃癌组织恶性分化过程中癌细胞可能通过抑癌基因CKIP-1 表达下调,引起Smurf1合成减少及活性抑制,Smads 蛋白降解减少导致TGF-β1表达增加,加速了癌细胞的分化、浸润转移。为探讨上述问题,本研究对不同分化的肠型胃癌细胞株CKIP-1 和TGF-β1的表达进行检测并做了相关性分析。结果显示,随着胃癌细胞分化的逐渐降低,CKIP-1 表达逐渐下降,与前期本课题组对人胃癌组织中CKIP-1 表达免疫组化染色结果一致[2]。与高分化胃癌细胞相比,低分化胃癌细胞TGF-β1表达增加,与文献报道一致[15]。相关性分析显示不同分化肠型胃癌细胞中CKIP-1 与TGF-β 1表达负相关,提示随着癌细胞分化降低,CKIP-1表达降低而TGF-β1表达增高。为进一步观察肠型胃癌中CKIP-1、TGF-β1表达的关系,本研究分别构建了过表达及干扰CKIP-1 表达的人肠型腺癌MKN28 细胞并检测各组细胞TGF-β1表达变化。结果显示,过表达CKIP-1 的MKN28 细胞TGF-β1表达降低,而干扰CKIP-1 表达的MKN28 细胞TGF-β1表达增加,上述结果提示CKIP-1 与TGF-β1蛋白表达负相关。
综上,笔者认为在肠型胃癌细胞恶性分化进程中,可能通过抑癌基因CKIP-1 表达下降后上调TGF-β1的表达,促进了胃癌的恶性转化及浸润转移,但具体信号通路尚需进一步深入研究,对CKIP-1 参与调控信号通路进一步深入研究将有助于了解肠型胃癌发病机制,并为CKIP-1 是否能作为胃癌可能分子治疗靶点提供有用的实验依据。
