长链非编码RNA XLOC_009038 促进食管鳞癌细胞增殖、迁移和侵袭
2019-02-23丁新郑勇李静郑雪童娟娟杨丹平陈卫刚
丁新 郑勇 李静 郑雪 童娟娟 杨丹平 陈卫刚
石河子大学医学院第一附属医院(新疆石河子832000)
食管癌是最常见的恶性肿瘤之一,据我国流行病学显示其5年生存率仅为18.4%[1]。由于食管癌的标准疗法仍局限于手术或内窥镜切除和化学放射治疗,因此需要更好地揭示食道癌的分子发病机理以开发新的生物标记物和靶向疗法[2]。随着研究的进展,越来越多的证据表明长链非编码RNA(long non-coding RNA,lncRNA)的表达失调存在于多种恶性肿瘤之中,并在恶性肿瘤的发生发展、特异性诊断、靶点治疗等方面起着重要的作用,但尚未鉴定出特异性lncRNA 用作食管癌早期诊断及预测预后的生物标志物。本课题组李光华等[3]通过基因芯片技术对食管鳞癌及其癌旁正常组织中差异表达的lncRNA 进行筛选发现XLOC_009038 表达明显上调,提示该基因可能与食管癌的发生发展具有密切联系。为进一步验证XLOC_009038 在食管癌中的作用,本研究通过干扰食管鳞癌细胞EC109、EC9706 中XLOC_009038 的表达,观察干扰前后细胞体外增殖、凋亡、迁移、侵袭等生物学特性的变化并探讨其作用机制,为食管鳞癌的发生及防治提供新的理论依据。
1 材料与方法
1.1 材料食管鳞状细胞癌EC109、EC9706 细胞株于石河子大学医学院重点实验室留存。质粒购于上海吉凯基因化学技术有限公司;实时定量PCR 引物由上海生工构建;LipofectaminTM2000 由美国Invitrogen 公司提供;胎牛血清、高糖DMEM 培养基及胰蛋白酶购自Gibco 公司;Trizol 试剂购于Invitrogen 公司;qRT-PCR 试剂购于康为公司;Transwell 小 室、Matrigel 胶 均 购 自 美 国Corning 公 司。Western blot 抗体购于Abcam 公司。
1.2 细胞培养细胞用含有10%胎牛血清及青链霉素的高糖DMEM 培养基。于37 ℃、5%CO2的培养箱培养。细胞汇合度在80%时进行传代或用冻存液冻存于液氮中保存。
1.3 细胞转染针对XLOC_009038 基因序列构建干扰质粒,质粒序列S1:5'-AACCAGCTATGCGG ACACATT-3';S2:5'-CAGGCTATTGGTTGCCTGGAA-3';S3:5'-TAGCCTACAGAGACCCATTCT-3'。常规培养细胞,调整细胞数以3 × 105个/孔均匀铺至六孔板中,待汇合度达80%时进行转染。转染时质粒与Lip2000 浓度为5 μg:8.5 μL,加无血清培养基至2 mL 每孔,转染后5 h 更换完全培养基。实验组(experience group)转染干扰质粒,对照组(control group)转染空载阴性质粒。
1.4 实时定量PCR 验证转染效果转染后培养48 h,Trizol 裂解细胞提取总RNA,反转录为cDNA,以cDNA 为模板进行实时荧光定量PCR 检测XLOC_009038 干扰效率,筛选出下调效果最佳的质粒,GAPDH 为内参。XLOC_009038 基因上游引物为5'-ACCAGCTATGCGGACACATTGATG-3',下游引物为5'-GAGGCAGGAGAATCGCTTGAACC-3',扩增产物长度194 bp;内参上游引物为5'-TAGTTGCGTTACACCCTTTCTTG-3',下游引物为5'-TCACCTTCACCGTTCCAGTTT-3',扩增产物长度151 bp。扩增条件为:95 ℃预变性10 min;95 ℃变性45 s、57 ℃退火45 s、72 ℃延伸50 s,循环40次;72 ℃延伸7 min,4 ℃保存。利用2-△△Ct法计算XLOC_009038相对表达量。
1.5 MTT 比色法检测细胞增殖能力将上述实验组和对照组细胞接种于96 孔板(3 000 个/孔),每组设置5 个复孔。培育0、24、48、72 h 时在每孔加入10 μL MTT溶液(5 mg/mL),培养箱孵育4 h,每孔加入150 μL 二甲基亚砜,摇床低速振荡10 min充分溶解结晶物。在酶联免疫检测仪490 nm 处测量各孔的吸光值。
1.6 平板克隆形成实验调整细胞浓度接种于六孔板(3 000个/孔)。培养箱培养12 d后PBS洗涤细胞集落,多聚甲醛固定20 min,结晶紫染色20 min。计数超过50 个细胞的集落。
1.7 Transwell 测定细胞迁移、侵袭实验用无血清培养基重悬细胞浓度至2×105个/mL,取150 μL细胞悬液接种至transwell 上层小室,下层小室放20%完全培养基800 μL。36 h 后取出上层小室,固定染色,计数迁移细胞数。侵袭实验在上层小室铺1∶8 稀释的Matrigel 胶70 μL 孵育4 h,余同迁移实验。
1.8 流式细胞技术测定细胞凋亡率取转染培养48 h 的细胞胰酶消化,离心后去上清,PBS 洗涤2 次,加入缓冲液100 μL,5 μL Annexin V-FITC 染色液和10 μL PI 染色液,常温孵育15 min。流式细胞仪检测凋亡率。
1.9 Western blot 检测procaspase3 表达用RIPA裂解液提取蛋白,100 ℃变性13 min。取20 μL 蛋白液电泳分离蛋白,转至硝酸纤维素膜。封闭2 h后,加入caspase3 一抗(1∶1 000)、β-actin 一抗(1∶10 000)孵育过夜。加入山羊抗兔二抗(1∶5 000),室温孵育2 h,发光试剂显色,曝光。用Photoshop CS5 软件测定条带的灰度值,计算XLOC_009038的相对表达量。
1.10 统计学方法采用SPSS 22.0 统计软件进行数据分析,两组间比较时数据符合正态分布采用独立样本检验,不符合正态分布时采用非参数检验,以P<0.05 表示差异有统计学意义。数据资料以表示。
2 结果
2.1 质粒转染后EC109、EC9706 细胞中XLOC_009038表达降低各组细胞转染后,EC109、EC9706两实验组中XLOC_009038 表达量均低于对照组,差异具有统计学意义[(t= 10.227,P<0.001);(t=6.97,P=0.001),图1]。
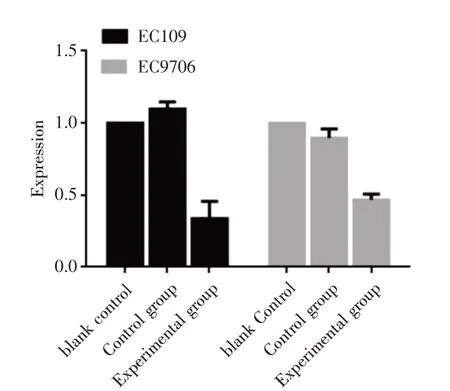
图1 各组细胞中XLOC_009038 基因的表达Fig.1 Expression of XLOC_009038 gene in each group of cells
2.2 低表达XLOC_009038可抑制食管鳞癌细胞增殖能力MTT 实验表明,细胞EC9706 转染24 h 后实验组OD值开始低于对照组(t=8.21,P<0.001)。细胞EC109 在转染后24 h 后实验组OD 值开始低于对照组但差异无统计学意义,于48 h 出现明显抑制(t=9.59,P<0.001,图2A);生长曲线显示两株细胞的实验组干扰XLOC_009038 后生长速度慢于对照组(图2B)。克隆形成试验结果显示,实验组EC109 细胞克隆形成率为(7.54 ± 2.14)%,显著低于对照组(13.04 ± 0.60)%(t= 4.26,P= 0.013);实验组EC9706 克隆形成率为(9.38 ± 0.84)%,对照组克隆形成率为(11.75 ± 0.35)%,差异具有统计学意义(t=4.50,P=0.011)(图3)。
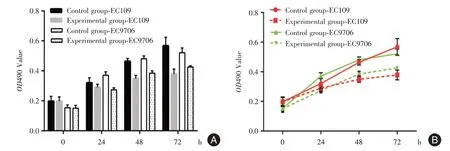
图2 MTT 检测各组细胞增殖能力结果Fig.2 The results of proliferation abilities in the various groups

图3 克隆形成实验结果Fig.3 The results of clone formation experiment in the various groups
2.3 低表达XLOC_009038 可抑制食管鳞癌细胞迁移、侵袭能力Transwell 实验显示,细胞EC109实验组与对照组穿膜细胞数量分别为(55.20 ±8.90)和(167.80 ± 9.91),差异具有统计学意义(t=18.90,P<0.001);实验组对照组相比穿过人工基底膜的细胞数明显减少[(44.80 ± 9.60)vs.(72.80± 7.26);t= 5.20,P= 0.002]。在细胞EC9706 实验组迁移细胞数(52.20 ± 9.04)明显少于对照组(108.80 ± 6.38),差异具有统计学意义(t= 11.44,P<0.001);对照组穿过人工基底膜的细胞数为(130.80±15.54)明显多于实验组(57.20±15.43),差异具有统计学意义(t=7.51,P<0.001)(图4、5)。
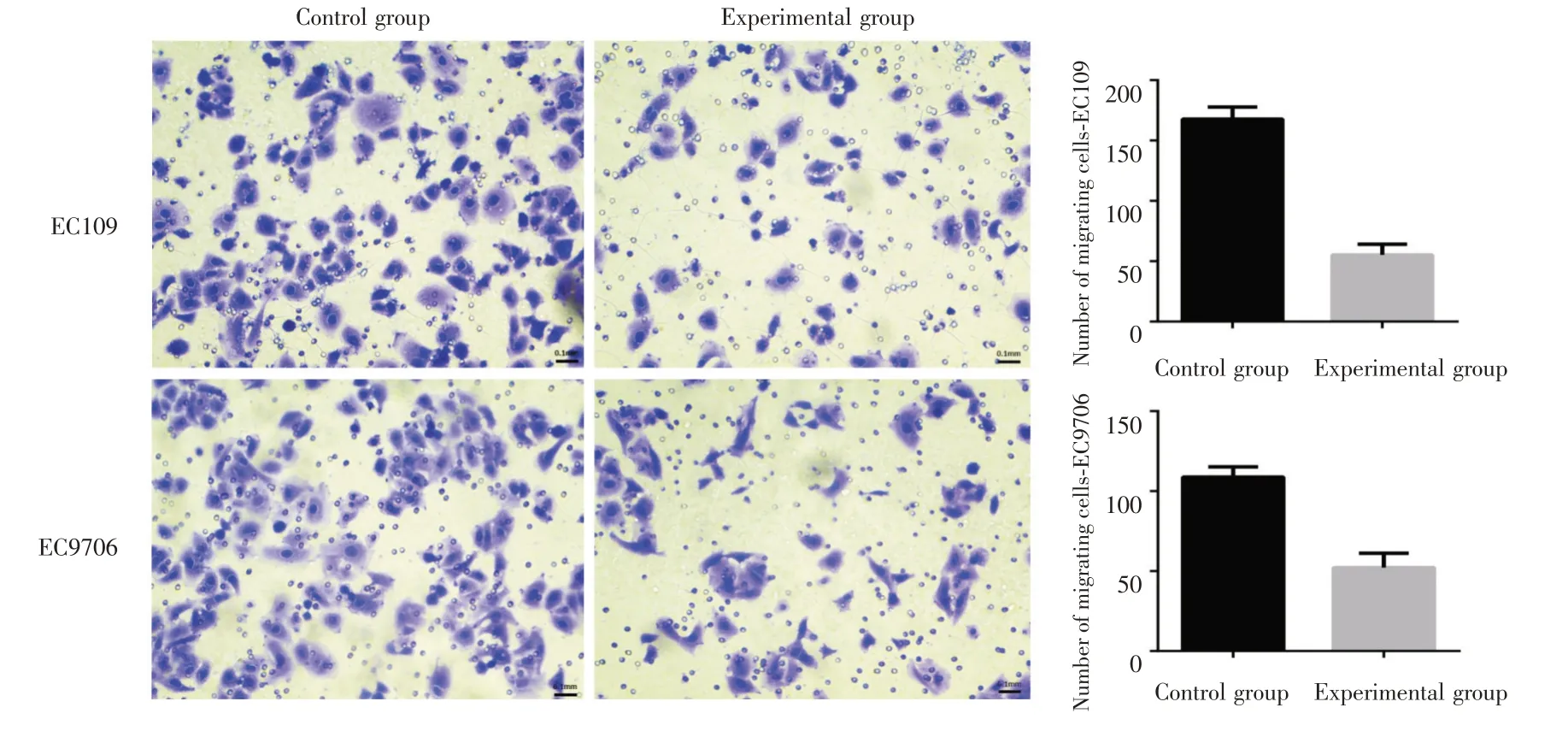
图4 各组细胞Transwell 迁移实验结果(×200)Fig.4 Results of migration experiments in the various groups(×200)
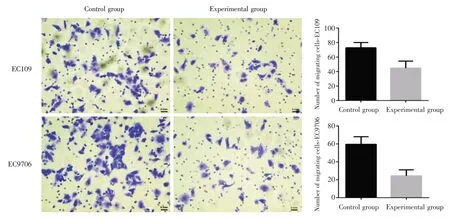
图5 各组细胞Transwell 侵袭实验结果(×200)Fig.5 Results of invasive experiments in the various groups(×200)
2.4 下调XLOC_009038 可促进食管鳞癌细胞的凋亡流式细胞技术检测转染后细胞凋亡情况,转染48 h 后EC109 实验组与对照组细胞相比凋亡率增加,差异具有统计学意义[(11.43 ± 1.06)vs.(19.53±0.85);t=10.32,P<0.001]。EC9706 实验组与对照组凋亡率分别为(6.6 ± 0.62)和(16.93 ±1.27),差异具有统计学意义(t=12.61,P<0.001)。通过对流式结果图的分析显示,干扰XLOC_009038后细胞凋亡变化主要发生在Q2 象限(图6)。
2.5 低表达XLOC_009038 可促进Procaspase3 蛋白表达Western blot 检测结果显示,48 h 时EC109对照组与实验组相对灰度值分别为(0.74 ± 0.13)和(1.09 ± 0.03),EC9706 对照组与实验组相对灰度值分别为(0.56 ± 0.03)和(1.06 ± 0.31),两种细胞的实验组相对灰度值与对照组相比均明显增高(t=0.013;P<0.001)差异具有统计学意义(图7)。
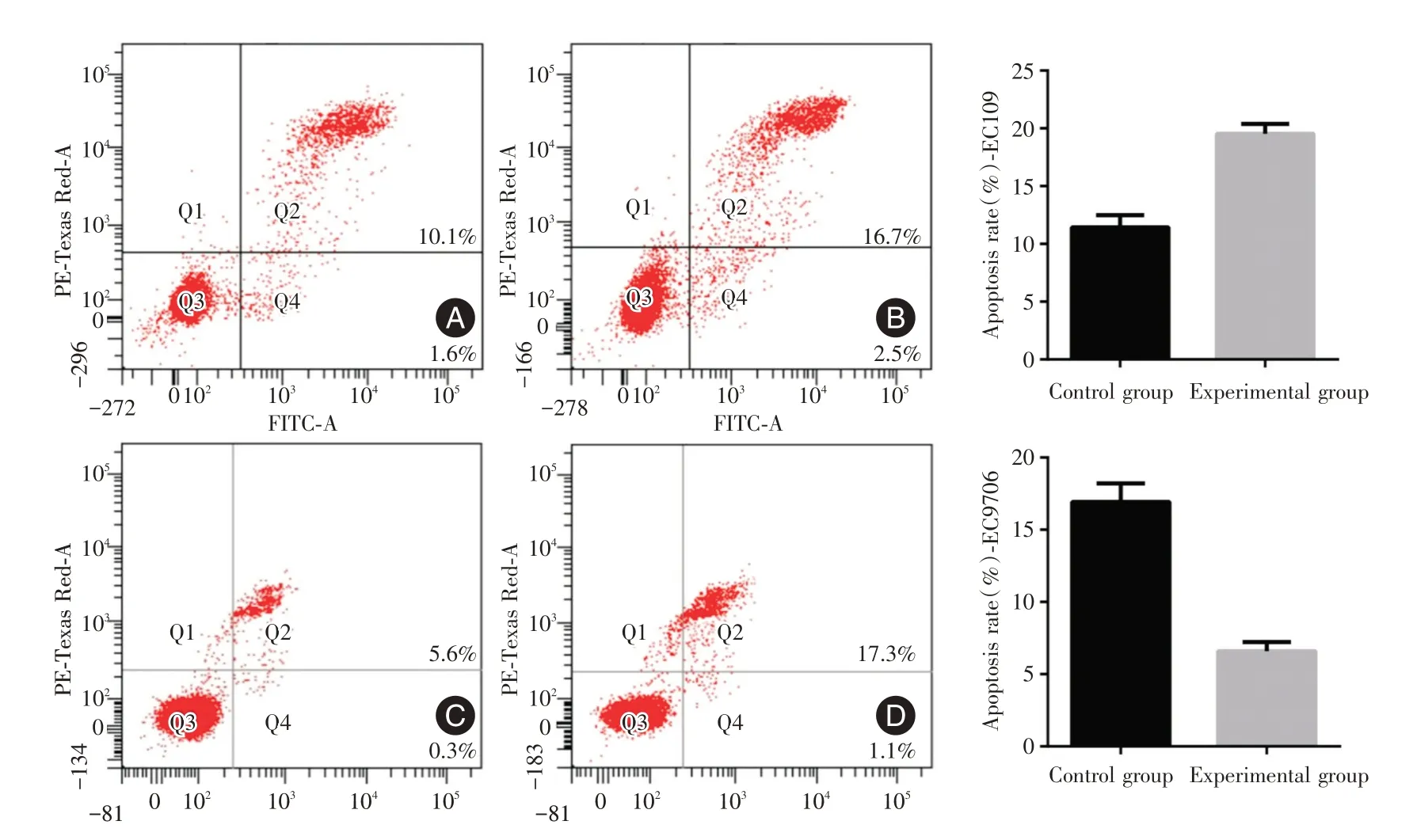
图6 流式细胞技术检测细胞凋亡实验结果Fig.6 Experimental results of apoptosis detected by flow cytometry
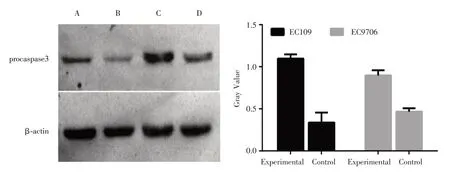
图7 各组食管鳞癌细胞中procaspase3 的蛋白质表达水平Fig.7 The different protein expression of procaspase3 in the various groups
3 讨论
我国是世界上食管癌新发病例最多的国家,发病率呈明显的地区差异[4]。尽管近年来内镜技术、影像技术在食管癌的早期诊断治及疗中起到了明显的效果,但其敏感性、特异性及经济支出等问题造成了一定的局限性,食管癌患者5年生存率依旧很低。因此为提高诊断和治疗水平,对新的诊断和预后标志物的需求更为迫切。
近年来随着对lncRNA 研究的深入,人们对它的认识也从转录“噪音”转变为在多种疾病中发挥不同作用的调控物质[5]。越来越多的证据表明,lncRNA 在免疫应答、增殖分化、蛋白修饰调节等多种生物学途径参与肿瘤的发生、发展及预后。同时一些lncRNA 可在肿瘤发生过程中可作为原癌基因或抑癌基因发挥其生物学特性[6],如HOTAIR已作为一种潜在的生物学标志进入了人们的视野,对肿瘤的早期诊断有重要价值[7]。LncRNA 功能复杂多样,但主要作用是调节邻近蛋白质编码基因表达的独特功能[8],ZHANG 等[9]研究发现lncRNA CCAT1 可与miR-7 相互作用调节HOXB13蛋白的表达促进食管癌细胞的生长和迁移。长链非编码RNA 以其复杂的生物学功能在代谢性疾病、肿瘤等多种疾病中起到重要的作用,对其深入研究将为疾病的特异性诊断、靶点治疗等发面提供新的契机。
恶性肿瘤的发生、发展是一个动态、连续的过程,在此过程中涉及肿瘤细胞的增殖、凋亡、迁移、侵袭及血管形成等。细胞凋亡调控异常造成细胞过度积累是癌症发生的机制之一,癌细胞向周围组织和脉管系统中迁移和侵袭是癌转移的一个重要初始步骤,为癌症相关死亡的主要原因[10]。本课题组利用基因芯片技术对食管鳞癌及其癌旁组织中lncRNA 进行全面分析,经筛选发现XLOC_009038(ID:TCONS_00019203)定位于chr19,长度为376 bp。其在癌组织中的高表达(FC = 5.08,P= 0.02)预示着在食管鳞癌癌的发生发展中起到一定的作用。在本研究中干扰XLOC_009038 使其表达下调后观察到两株细胞增殖、迁移、侵袭能力明显下降,表明该基因可能扮演者促癌基因的角色,促进食管癌细胞的侵袭和转移。在精准医疗的大背景下,靶向抑制该基因可为治疗食管癌提供新的思路。
本研究干扰XLOC_009038 后Procaspase3 在细胞中的表达量增加,预示着XLOC_009038 的高表可通过抑制caspase3 的表达在食管癌细胞的生长过程中发挥作用。Caspases 是一类半胱氨酸天冬氨酸蛋白酶,caspase3 在凋亡过程中是核心地位的效应因子。正常情况下的caspase3 以无活性的形式存在,一旦损伤因素导致凋亡发生,Procaspase3即被激活诱发下游的级联反应,降解与细胞结构、细胞信号通路、细胞周期调控、DNA 修复等功能相关的蛋白使细胞产生不可避免的死亡。同时,多项研究结果表明,高caspase-3 表达与恶心肿瘤患的者生存率相关[11]。本研究显示,通过干扰质粒抑制XLOC_009038 的表达后,细胞晚期凋亡率出现明显的增高,同时western blot 显示实验组Procaspase3 表达量增多,由此可推测XLOC_009038 过表达时可能抑制Procaspase3 影响细胞凋亡途径的正常进行,造成细胞过度积累而导致食管癌的发生发展。然而,XLOC_009038 是直接调控Procaspase3 的生成还是影响Procaspase3 活化为cleavedcaspase-3 的过程尚待进一步研究。
本研究在前期实验的基础上,首次证实了XLOC_009038 在食管癌的发生发展中扮演着一定的角色,在细胞分子生物学层面为揭示食管鳞癌的发生发展提供新的理论依据。但该研究尚存在一定的局限性,如本研究为体外细胞学实验,未进一步在病理样本、裸鼠等进行体内实验验证XLOC_009038 在食管癌中的作用。本课题组后期将扩大食管鳞癌样本数量来进一步验证XLOC_009038 在食管鳞癌中表达的变化,同时探究XLOC_009038 在血清或血浆标本中表达的变化,并通过随访判定其在食管鳞癌诊断和预后预测的应用价值,为XLOC_009038 作为诊断标志物提供更多的理论依据。继续寻找XLOC_009038 下游靶基因(蛋白),探讨XLOC_009038 在食管鳞癌组织中表达升高的原因,以期更加明确地阐明XLOC_009038 在食管鳞癌发生发展中的作用机制。
总之,本研究表明高表达的XLOC_009038 可能通过抑制Procaspase3 促进食管鳞癌癌细胞的增殖和侵袭能力,在食管癌的发生发展中扮演着类似于原癌基因的角色,对其深入研究有望成为食管癌新的生物标志物和食管癌预防治疗的新靶点。
