槐耳清膏联合顺铂对人肺癌A549细胞和A549/DDP细胞Bax、Bcl-2及Survivin基因表达的影响
2019-02-23沈云飞詹建伟
沈云飞 詹建伟
肺癌是一种发病率和死亡率排在首位的恶性肿瘤,已经连续多年成为人体健康的头号杀手[1]。目前临床上针对肺癌患者的治疗方法主要是以化疗为主的综合治疗手段[2-3],但是其临床疗效因肿瘤细胞的药物耐受性受到限制,特别是肺癌A549/DDP细胞多耐药性的产生已经成为肺癌药物治疗的主要障碍[4-5]。近年研究显示,多种中药提取物能够有效抑制人肺癌细胞A549细胞的增殖[6-7],临床研究显示,槐耳清膏可能是通过活化MAPK(mitogen-activated protein kinase,丝裂原活化蛋白激酶)信号通路影响A549细胞凋亡[8]。本研究探索槐耳清膏与顺铂联合刺激对于人肺癌细胞A549细胞以及耐药株A549/DDP细胞Bcl-2关联X蛋白(Bcl-2-associated X protein,Bax)、B 细胞淋巴瘤 2(B-cell lymphoma 2,Bcl-2)以及细胞凋亡重复杆状病毒抑制剂5(Survivin)基因表达的影响,报道如下。
1 材料与方法
1.1 试 剂 顺铂(规格:50mL:50mg,批号2015040108,齐鲁制药有限公司);槐耳清膏(规格:20g×6袋,批号J201605314,江苏启东盖天力药业有限公司);完全培养基(规格:500mL/KIT,批号2015032142,Zrbiorise);Epigentek 全蛋白抽提试剂盒(批号2016012403,武汉艾美捷科技有限公司);Bax检测试剂盒(批号2015032451,武汉默沙克生物科技有限公司);Bcl-2检测试剂盒(批号2015085312,R&D systems)。Survivin 检 测 试 剂 盒 ( 批 号2015012413,R&D systems);A549/DDP(DDP,cisdichlorodiamineplatinum,顺铂)细胞株(规格:1×106cells/T25培养瓶,批号2015010304,武汉普诺赛生命科技有限公司)。A549细胞株(规格:1×106cells/T25培养瓶,批号20150500213,中国科学院上海细胞学研究所);Rneasy MiNi Kit(50)(批号2016032412,Qiagen)。
1.2 细胞培养 将冷冻保存的细胞株复苏后在5%CO2浓度饱和湿度和37℃条件下采用完全培养基(10%胎牛血清、1%的链霉素和青霉素双抗的高糖DMEM培养基)进行培养和传代,其中A549/DDP细胞株培养基除上述成分外另加入6μmol/L的DDP,于实验前两天更换不含有DDP的培养基继续培养,A549/DDP细胞处于对数生长时期。
1.3 药物制备 将10g槐耳清膏溶解于100mL无血清PRMI-1640培养液中,分别制成0、1.0、3.0、5.0、7.0和9.0mg/mL的槐耳清膏溶液,同时以未加槐耳清膏的无血清PRMI-1640培养液作为空白对照。
1.4 Real-time PCR检测 引物设计:Bax上游引物:5’-CAAGAAGCTGAGCGAGTGTC-3’;Bax 下游引物:5’-ACTCGGAAAAAGACCTCTCGG-3’。Bcl-2上 游 引 物 :5’-ATCCAGGATAACGGAGGCTG-3’;Bax下游引物:5’-AGAAATCAAACAGAGGCCGCA-3’。Survivin 上游引物:5’-CCACCAGCCTTCCTATGG GC-3’;Bax下游引物:5’-AAGACAAAACAGGAGCA CAGTTG-3’。以GAPDH基因作为内参,GAPDH基因的上游引物为5’-AGGTCGGTGTGAACGGATTTG-3’;GAPDH 基因下游引物为 5’-TGTAGACCATGT AGTTGAGGTCA-3’。总RNA抽提及逆转录:将第13复孔中每种药物浓度刺激后的细胞抽提总RNA。将抽提的总RNA采用MMLV逆转录酶逆转录成cDNA,反应体系为:10μL 2×逆转录酶缓冲液;20μL DEPC 水;1.2μL引物(50mM);2μL总 RNA;0.2μL逆转录酶。反应程序为 42℃,30min;85℃,10min。Realtime PCR 反应体系:10μL 1×定量 PCR Master Mix,上 、 下 游 引 物各 0.08μL,2μL cDNA,0.4μL Taq DNA 聚合酶,8μL ddH2O。反应程序:95℃,3min;95℃,30s;55℃,20s;40cycles。
1.5 ELISA法检测各组细胞株Bax、Bcl-2以及Survivin蛋白表达情况 将处于对数生长期的A549细胞和A549/DDP细胞以细胞浓度为2×106/瓶分别接种于25cm2的细胞培养瓶,显微镜下观察细胞贴壁后分别加入含槐耳清膏浓度为 0、1.0、3.0、5.0、7.0和9.0mg/mL细胞培养基中,每个浓度3复孔,然后分别加入12μg/mL浓度的顺铂,继续培养48h后停止培养,使用Epigentek全蛋白抽提试剂盒抽提总蛋白,抽提完成后4℃,10 000r/min离心10min,取上清,采用ELISA检测试剂盒检测Bax、Bcl-2以及Survivin浓度。
1.6 统计学方法 应用SPSS20.0软件进行,计量资料以均数±标准差(±s),组间数据比较分析采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 不同药物作用浓度组合刺激A549细胞Bax、Bcl-2、Survivin mRNA表达的影响 槐耳清膏与顺铂联合使用的情况下,随着槐耳清膏浓度的升高,A549细胞Bax基因mRNA表达逐渐升高,Bcl-2、Survivin基因mRNA表达逐渐降低,差异均有统计学意义(P<0.01)。见表 1。
2.2 不同药物作用浓度组合刺激A549/DDP细胞Bax、Bcl-2、Survivin基因mRNA表达 槐耳清膏与顺铂联合使用的情况下,随着槐耳清膏浓度的升高,A549/DDP细胞Bax基因mRNA表达逐渐升高,Bcl-2、Survivin基因mRNA表达逐渐降低,差异均有统计学意义(P<0.01)。见表 2。
表1 不同药物组A549细胞Bax、Bcl-2、Survivin mRNA表达情况(RQ值,±s)
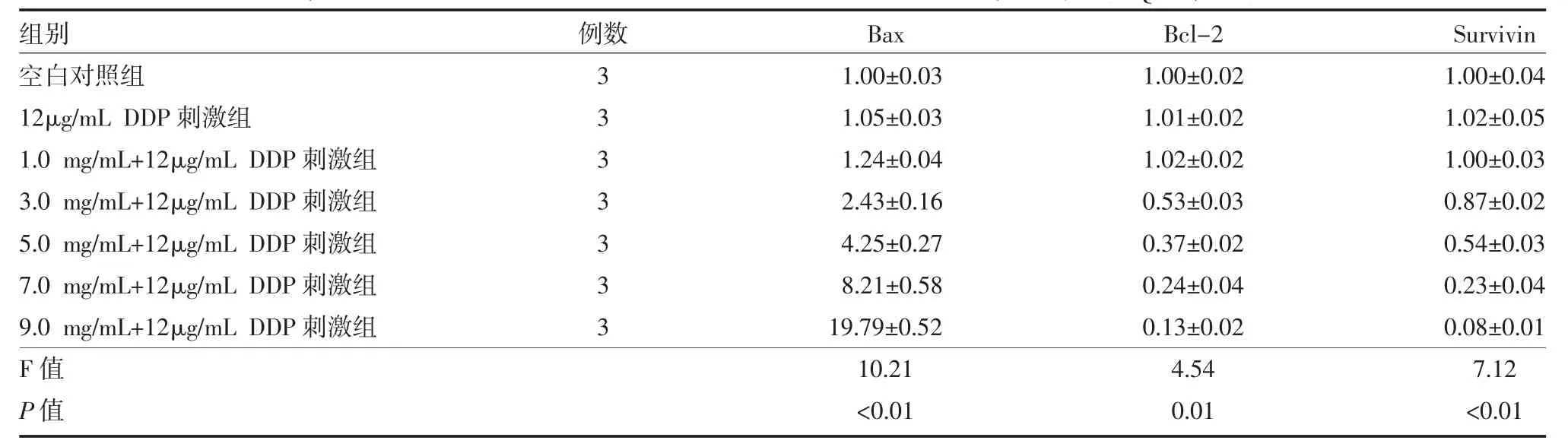
表1 不同药物组A549细胞Bax、Bcl-2、Survivin mRNA表达情况(RQ值,±s)
注:RQ:relative quantity,相对表达量;空白对照组:未加药物刺激;Bax:Bcl-2关联X蛋白;Bcl-2:B细胞淋巴瘤2;Survivin:凋亡抑制
组别空白对照组12μg/mL DDP刺激组1.0 mg/mL+12μg/mL DDP刺激组3.0 mg/mL+12μg/mL DDP刺激组5.0 mg/mL+12μg/mL DDP刺激组7.0 mg/mL+12μg/mL DDP刺激组9.0 mg/mL+12μg/mL DDP刺激组F值P值例数3 3 3 3 3 3 3 Bax 1.00±0.03 1.05±0.03 1.24±0.04 2.43±0.16 4.25±0.27 8.21±0.58 19.79±0.52 10.21<0.01 Bcl-2 1.00±0.02 1.01±0.02 1.02±0.02 0.53±0.03 0.37±0.02 0.24±0.04 0.13±0.02 4.54 0.01 Survivin 1.00±0.04 1.02±0.05 1.00±0.03 0.87±0.02 0.54±0.03 0.23±0.04 0.08±0.01 7.12<0.01
表2 不同药物组A549/DDP细胞Bax、Bcl-2、Survivin mRNA表达(RQ值,±s)

表2 不同药物组A549/DDP细胞Bax、Bcl-2、Survivin mRNA表达(RQ值,±s)
注:RQ:relative quantity,相对表达量;空白对照组:未加药物刺激;Bax:Bcl-2关联X蛋白;Bcl-2:B细胞淋巴瘤2;Survivin:凋亡抑制
组别空白对照组12μg/mL DDP刺激组1.0 mg/mL+12μg/mL DDP刺激组3.0 mg/mL+12μg/mL DDP刺激组5.0 mg/mL+12μg/mL DDP刺激组7.0 mg/mL+12μg/mL DDP刺激组9.0 mg/mL+12μg/mL DDP刺激组F值P值例数3 3 3 3 3 3 3 Bax 1.00±0.02 1.02±0.02 1.31±0.05 2.47±0.13 4.36±0.25 7.85±0.73 20.21±0.43 12.43<0.01 Bcl-2 8.01±0.53 5.03±0.02 4.89±0.03 3.57±0.02 1.32±0.04 0.51±0.02 0.21±0.03 9.17<0.01 Survivin 1.00±0.02 1.03±0.06 0.92±0.02 0.65±0.02 0.44±0.02 0.19±0.02 0.06±0.01 7.63<0.01
表3 不同药物组A549细胞Bax、Bcl-2、Survivin蛋白表达情况(ng/L,±s)

表3 不同药物组A549细胞Bax、Bcl-2、Survivin蛋白表达情况(ng/L,±s)
注:RQ:relative quantity,相对表达量;空白对照组:未加药物刺激;Bax:Bcl-2关联X蛋白;Bcl-2:B细胞淋巴瘤2;Survivin:凋亡抑制
组别空白对照组12μg/mL DDP刺激组1.0 mg/mL+12μg/mL DDP刺激组3.0 mg/mL+12μg/mL DDP刺激组5.0 mg/mL+12μg/mL DDP刺激组7.0 mg/mL+12μg/mL DDP刺激组9.0 mg/mL+12μg/mL DDP刺激组F值P值例数3 3 3 3 3 3 3 Bax 1.40±0.20 1.80±0.30 2.30±0.90 3.20±1.10 3.50±1.30 4.90±1.20 5.80±1.90 8.54<0.01 Bcl-2 5.40±2.30 4.30±2.00 2.80±1.00 2.40±1.50 1.50±0.90 1.40±0.80 0.90±0.40 9.38<0.01 Survivin 11.20±2.30 8.60±2.10 7.80±3.10 6.40±2.10 5.10±1.10 3.50±1.20 1.20±0.90 10.55<0.01
2.3 不同药物作用浓度组合对A549细胞Bax、Bcl-2、Survivin蛋白表达的影响 槐耳清膏与顺铂联合使用的情况下,随着槐耳清膏浓度的升高,A549细胞Bax蛋白表达量逐渐升高,Bcl-2、Survivin蛋白表达量逐渐降低,差异均有统计学意义(P<0.01)。见表3。
2.4 不同药物作用浓度组合对A549/DDP细胞Bax、Bcl-2、Survivin蛋白表达的影响 槐耳清膏与顺铂联合使用的情况下,随着槐耳清膏浓度的升高,A549/DDP细胞Bax蛋白的表达量逐渐升高,Bcl-2、Survivin蛋白量表达逐渐降低,差异均有统计学意义(P<0.01)。见表 4。
3 讨论
研究显示,肺癌的发生可能与细胞凋亡和细胞增殖的平衡被打破有关[9],细胞凋亡是一种机体细胞主动死亡过程,包含一系列基因激活、表达以及调控过程[10]。肺癌细胞的凋亡过程受到多种基因的表达调控,在其凋亡的信号传导过程中主要包含三个途径,分别是内质网途径、死亡受体途径和线粒体途径[11]。其中在线粒体途径中最重要的调控基因是Bcl-2基因家族,本研究中的Bcl-2基因和Bax基因均来自于该基因家族,而这两个基因的作用刚好相反,其中Bcl-2基因主要是在抑制细胞凋亡过程中发挥调控作用,Bax基因主要发挥的是促凋亡作用[11]。另外本研究中另一种Survivin基因是IAP家族的一员,是一种很强的细胞凋亡抑制因子,有研究显示其主要的功能是抑制细胞凋亡,促进细胞进行有丝分裂和血管生成,另外在肿瘤细胞的耐药性中也发挥着非常重要的作用[12]。
表4 不同药物组A549/DDP细胞Bax、Bcl-2、Survivin蛋白表达的情况(ng/L,±s)

表4 不同药物组A549/DDP细胞Bax、Bcl-2、Survivin蛋白表达的情况(ng/L,±s)
注:RQ:relative quantity,相对表达量;空白对照组:未加药物刺激;Bax:Bcl-2关联X蛋白;Bcl-2:B细胞淋巴瘤2;Survivin:凋亡抑制
组别空白对照组12μg/mL DDP刺激组1.0 mg/mL+12μg/mL DDP刺激组3.0 mg/mL+12μg/mL DDP刺激组5.0 mg/mL+12μg/mL DDP刺激组7.0 mg/mL+12μg/mL DDP刺激组9.0 mg/mL+12μg/mL DDP刺激组F值P值例数3 3 3 3 3 3 3 Bax 1.70±0.50 2.30±0.80 3.40±1.30 6.50±2.40 9.60±3.10 11.20±4.60 20.21±9.80 15.71<0.01 Bcl-2 24.30±7.50 19.80±5.50 15.40±4.90 12.60±5.10 8.50±2.50 5.40±2.10 1.60±0.70 17.98<0.01 Survivin 14.80±5.60 11.60±5.20 9.50±2.90 8.10±3.50 7.70±3.10 4.20±2.10 1.50±0.80 14.68<0.01
槐耳清膏与顺铂联合刺激作为一种中西医结合治疗方法能够显著抑制人肺癌细胞A549以及耐药性细胞A549/DDP的增殖,诱导细胞凋亡,逆转A549/DDP细胞的耐药性已经得到研究证实,但是其作用机制并不十分清楚[13]。本研究以Bax、Bcl-2以及Survivin基因作为研究对象,在仅使用顺铂刺激时A549细胞内Bcl-2基因的表达明显低于A549/DDP细胞,这点也正是A549/DDP细胞的耐药性产生的分子机制,即在A549/DDP细胞内抗凋亡基因高表达,与此同时凋亡基因低表达,其作用导致A549/DDP细胞能够进行不断增殖而变成癌细胞。有研究显示,A549/DDP细胞之所以能够具有耐药性是因为细胞内Bcl-2过表达而导致半胱氨酸蛋白酶-8(caspase-8)和细胞色素C的蛋白的表达下调,这也与本研究结果相符[14]。本研究结果显示,经过RT-PCR检测和ELISA检测,槐耳清膏与顺铂联合作用后,A549细胞和A549/DDP细胞中Bax基因的表达逐渐升高,Bcl-2、Survivin基因的表达逐渐降低,说明槐耳清膏与顺铂联合作用是通过上调凋亡相关基因的表达且下调抗凋亡相关基因的表达来诱导A549细胞和A549/DDP细胞的凋亡,另外也说明槐耳清膏能够逆转A549/DDP细胞的耐药性作用。然而本研究还处于体外试验阶段,笔者接下来计划通过蛋白抑制剂与槐耳清膏共同刺激A549细胞检测Bax、Bcl-2以及Survivin蛋白的表达情况,并通过细胞凋亡模型研究槐耳清膏的作用机制,并通过动物模型体内进一步进行体内验证。
综上所述,槐耳清膏与顺铂联合使用能够显著提高人肺癌细胞A549和A549/DDP的凋亡相关基因的表达,降低抗凋亡相关基因的表达。
