丹参注射液联合美常安对急性重症胰腺炎模型大鼠血清炎性因子及胰腺组织病理的影响
2019-02-23庄肇朦
庄肇朦 贾 杰
重症急性胰腺炎(Severe Acuter Pancreatitis,SAP)常伴有血清炎性因子和细胞因子水平的升高,可能引起多器官供能衰竭、全身炎症反应综合征[1-2]。在SAP治疗方案中,调节机体适度反应、保护机体防御功能越来越受到关注[3]。丹参注射液由唇形科草本植物经精制提纯而来的中药制剂,具有活血化瘀,促进血粘稠度下降和改善微循环的作用,能够改善SAP大鼠的炎症反应水平[4];美常安(枯草杆菌二联活菌)是一种微生态制剂,主要含有益生元和益生菌,能够促进肠道菌群的平衡,同时通过生物拮抗、生物夺取氧气和参与肠道的免疫反应从而改善肠道的屏障作用[5]。本实验通过建立SAP模型大鼠,观察丹参注射液联合美常安对SAP模型大鼠SOD和IL-10等因子表达水平的影响及其机制,探讨丹参注射液联合美常安治疗SAP效果及机制,报道如下。
1 实验材料
1.1 动 物 90只SD成年雄性大鼠(SPF级),购买自安徽医科大学动物实验中心(许可证号:SCXK2016003),体质量(300±10)g,喂养于自由进食进水、室温23℃~25℃、相对湿度45%~60%、光照12h的环境中。
1.2 药 品 牛磺胆酸钠(美国Sigma公司),丹参注射液(四川升和药业股份有限公司,批号1607117),美常安(北京韩美药品有限公司,批号MH6080001L)。
1.3 试 剂 超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所,批号20131203),丙二醛(MDA)试剂盒(南京建成生物工程研究所,批号20140117),LPS酶联免疫检测试剂盒(苏州江莱生物研究所,批号20141019)、TNF-α酶联免疫检测试剂盒(苏州江莱生物研究所,批号20150325)、IL-10酶联免疫检测试剂盒(苏州江莱生物研究所,批号20141211)、IL-6酶联免疫检测试剂盒(苏州江莱生物研究所,批号20150312)、IL-1β酶联免疫检测试剂盒(苏州江莱生物研究所,批号201500414)。
2 实验方法
2.1 分组及造模 90只实验大鼠随机分为空白对照组、实验对照组、SAP模型组、丹参治疗组、美常安治疗组和联合治疗组共六组,每组15只。用Aho方法[6]制造动物模型:5%牛黄胆酸钠溶液在胆胰管内逆行性注射制作SAP模型大鼠,所有实验大鼠术前禁食12h,1%戊巴比妥钠(25mg/kg)腹腔内注射麻醉。无菌情况下手术,上腹壁正中切口入腹,寻及十二指肠及胰胆管,用一小动脉夹夹闭胆管近肝门端,4号针头经肠壁从十二指肠乳头刺入胰胆管约0.8cm,对SAP模型组、丹参治疗组、美常安治疗组大鼠以0.25mL/min的速度向胰胆管内逆行推注5%牛磺胆酸钠溶液1.0mL/kg,注毕压迫5min,见胰腺出血坏死后去除小动脉夹关腹。术后禁食不禁水。
表1 各组大鼠血清炎症因子水平比较(±s)
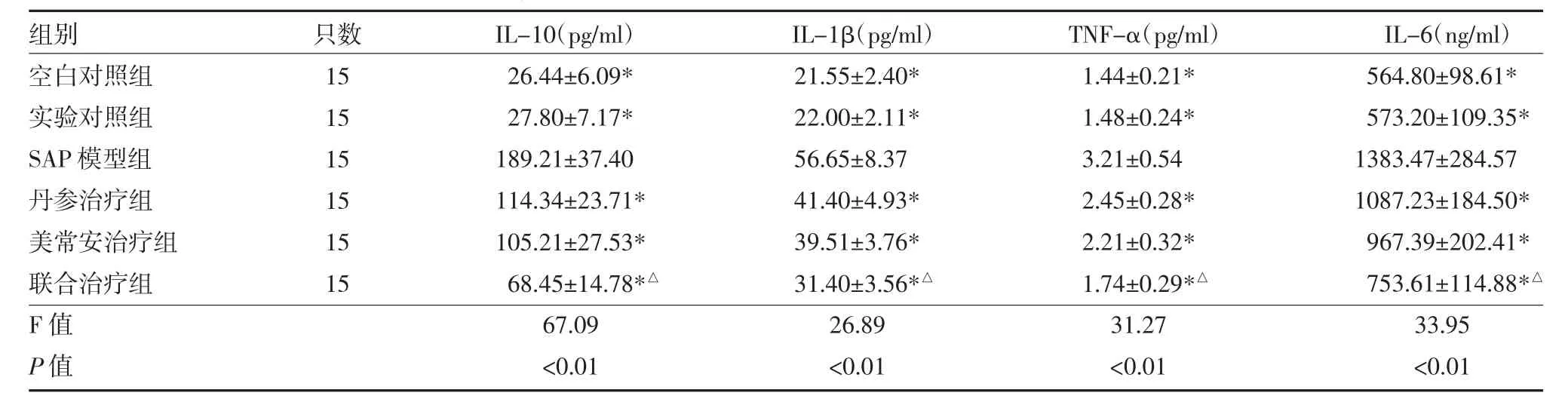
表1 各组大鼠血清炎症因子水平比较(±s)
注:与SAP模型组比较*P<0.05,与丹参治疗组、美常安治疗组比较,△P<0.05;SAP:重症胰腺炎;联合治疗组:丹参注射液+美常安
组别空白对照组实验对照组SAP模型组丹参治疗组美常安治疗组联合治疗组F值P值只数15 15 15 15 15 15 IL-10(pg/ml)26.44±6.09*27.80±7.17*189.21±37.40 114.34±23.71*105.21±27.53*68.45±14.78*△67.09<0.01 IL-1β(pg/ml)21.55±2.40*22.00±2.11*56.65±8.37 41.40±4.93*39.51±3.76*31.40±3.56*△26.89<0.01 TNF-α(pg/ml)1.44±0.21*1.48±0.24*3.21±0.54 2.45±0.28*2.21±0.32*1.74±0.29*△31.27<0.01 IL-6(ng/ml)564.80±98.61*573.20±109.35*1383.47±284.57 1087.23±184.50*967.39±202.41*753.61±114.88*△33.95<0.01
2.2 给 药 空白对照组仅进行开关腹术,胆胰管局部不予任何处理;实验对照组开腹后予0.9%氯化钠注射液逆行胆胰管注射;SAP模型组开腹后予5%牛黄胆酸钠溶液胆胰管内逆行性注射制作SAP模型大鼠;丹参治疗组造模后30min经尾静脉注射(5mL/kg体质量)丹参注射液1次,相同剂量每12h 1次,共给药4次;美常安治疗组造模后30min经空肠造瘘管注入美常安溶液,1×107CFU/只,相同剂量每 12h 1次,共给药4次;联合治疗组造模后分别经尾静脉注入同等剂量丹参注射液及经空肠造瘘管注入美常安溶液;空白对照组、实验对照组、SAP模型组不予任何注射治疗。
2.3 指标检测 检测血清 LPS、TNF-α、IL-10、IL-1β、IL-6,取3mL麻醉大鼠腹主动脉血,4℃下离心,3 000r/min,15min,保留血清,放在-20℃保存,严格按说明书要求操作ELISA方法检测。血清SOD,MDA水平检测,取6mL全血分装于2个抗凝剂试管内,4℃下离心,3 000r/min,15min,分离血浆及血清,-20℃保存,SOD采用SOD放射免疫试剂盒测定,MDA采用MDA硫代巴比妥酸法试剂盒测定。
2.4 病理学评分比较 各组大鼠72h后处死,取胰腺组织采用HE染色,观察各组大鼠胰腺组织病理学评分[7],主要依据胰腺水肿程度、腺泡坏死程度、出血及脂肪坏死程度、血管周围炎性细胞浸润程度进行评分,每一项评分0~4分,评分越高,胰腺组织病理变化程度越严重。
2.5 统计学方法 应用统计软件SPSS16.0,计量资料采用均数±标准差(±s),数据统计分析采用单因素方差分析法,组间两两比较采用LSD-t检验;P<0.05说明差异有统计学意义。
3 实验结果
3.1 各组大鼠血清炎症因子水平比较 SAP模型组、丹参治疗组、美常安治疗组、联合治疗组血清IL-10、IL-1β、TNF-α、IL-6 水平均高于空白对照组、实验对照组(P<0.05),表明造模实验成功;丹参治疗组、美常安治疗组及联合治疗组的血清IL-10、IL-1β、TNF-α、IL-6水平均低于 SAP 模型组(P<0.05),联合治疗组的血清 IL-10、IL-1β、TNF-α、IL-6 水平均低于丹参治疗组、美常安治疗组(P<0.05),见表1。
3.2 各组大鼠血清SOD、MDA、LPS水平比较 SAP模型组、丹参治疗组、美常安治疗组、联合治疗组血清MDA、LPS水平高于空白对照组、实验对照组(P<0.05),SOD水平低于空白对照组、实验对照组(P<0.05);丹参治疗组、美常安治疗组及联合治疗组MDA、LPS水平均低于 SAP模型组(P<0.05),SOD 高于SAP模型组(P<0.05);联合治疗组 MDA、LPS水平均低于丹参治疗组、美常安治疗组(P<0.05),SOD高于丹参治疗组、美常安治疗组(P<0.05),见表2。
3.3 病理学评分观察 SAP模型组、丹参治疗组、美常安治疗组、联合治疗组病理学评分高于空白对照组、实验对照组(P<0.05);丹参治疗组、美常安治疗组及联合治疗组病理学评分低于SAP模型组(P<0.05),联合治疗组病理学评分低于丹参治疗组、美常安治疗组(P<0.05),见表 3。
4 讨论
SAP是消化内科常见病,在其发生、发展过程中会产生大量的细胞因子和血管活性物质等,直接或
表2 各组大鼠血清SOD、MDA、LPS水平比较(±s)
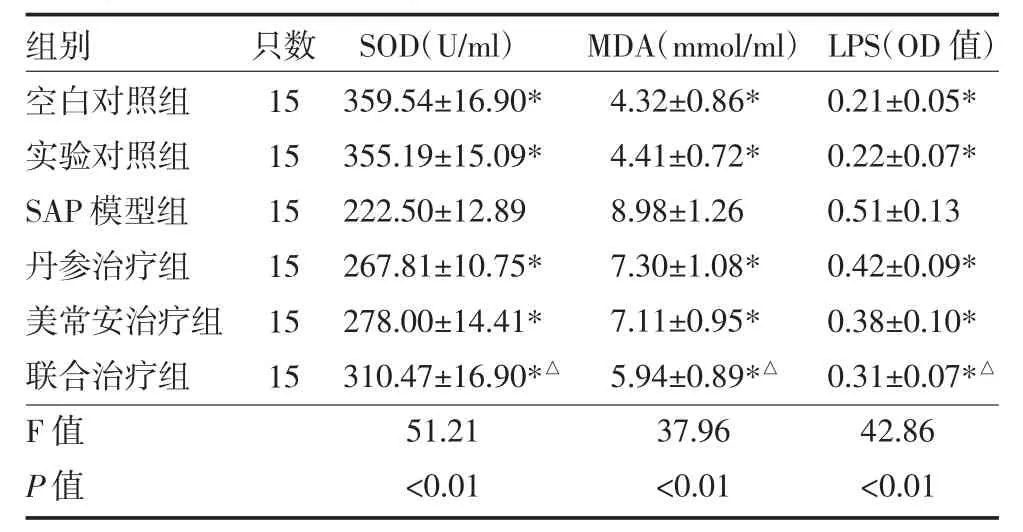
表2 各组大鼠血清SOD、MDA、LPS水平比较(±s)
注:与SAP模型组比较*P<0.05,与丹参治疗组、美常安治疗组比较,△P<0.05;SAP:重症胰腺炎;联合治疗组:丹参注射液+美常安
组别空白对照组实验对照组SAP模型组丹参治疗组美常安治疗组联合治疗组F值P值只数15 15 15 15 15 15 SOD(U/ml)359.54±16.90*355.19±15.09*222.50±12.89 267.81±10.75*278.00±14.41*310.47±16.90*△51.21<0.01 MDA(mmol/ml)4.32±0.86*4.41±0.72*8.98±1.26 7.30±1.08*7.11±0.95*5.94±0.89*△37.96<0.01 LPS(OD 值)0.21±0.05*0.22±0.07*0.51±0.13 0.42±0.09*0.38±0.10*0.31±0.07*△42.86<0.01
表3 病理学评分观察(分,±s)

表3 病理学评分观察(分,±s)
注:与SAP模型组比较,*P<0.05,与丹参治疗组、美常安治疗组比较,△P<0.05;SAP:重症胰腺炎;联合治疗组:丹参注射液+美常安
组别空白对照组实验对照组SAP模型组丹参治疗组美常安治疗组联合治疗组F值P值只数15 15 15 15 15 15病理学评分0.27±0.11*△0.30±0.21*△14.15±1.60 10.96±1.80*10.27±1.44*7.36±1.20*△57.090<0.001
本研究结果表明丹参注射液和美常安都能够降低SAP大鼠血清IL-1、IL-6、TNF-a水平,可能由于丹参降低患者体内炎症因子的水平,并且能通过抑制NF-kB表达而发挥抗炎作用,降低大鼠体内炎症因子的水平;美常安通过调节大鼠体内的菌群分布,改善大鼠肠道的微环境,降低炎症因子的水平,两者联合使用通过改善肠道菌群的分布和改善炎症水平,强化治疗效果。
丹参通过改善大鼠体内的微循环,减少胰腺组织缺血低氧和血管痉挛状态[16]。美常安重建宿主肠道菌群间的微生态平衡,抑制肠内有害菌和有害物质的产生[17]。本研究结表明,丹参可降低SAP后血浆MDA水平,能够升高SOD,可减轻SAP时对胰腺、肝、肾脂质过氧化作用,从而减轻肾的损伤,可通过降低SAP时氧自由基水平,延缓胰腺炎时的病理进程;美常安通过降低有害菌群的水平,降低体内的氧化损伤。
丹参和美常安联合使用能够有效改善大鼠体内炎症水平和氧化应激水平的同时,增强对胰腺组织的保护作用。本研究结果表明,丹参注射液联合美常安能够降低胰腺组织的损伤,通过调节体内的微循环和炎性反应,对胰腺起到一定的保护作用。间接引起局部血流速度降低、白细胞粘附、血流量减少、毛细血管通透性增加及功能性毛细血管密度降低等造成微循环功能障碍。减轻细胞因子及炎症介质导致的全身炎症反应综合征,改善胰腺微循环成为现今研究的热点问题[8]。
丹参注射液具有通脉养心、活血化瘀的功效,临床广泛用于急性心肌梗死、SAP、冠心病等疾病的治疗。丹参具有抑制血小板凝聚、降低血液黏度,达到改善微循环和血液流变学的作用[9]。同时能够抑制TNF-α、IL-6、IL-8等促炎因子分泌,并上调IL-10、IL-4等含量。大鼠L-精氨酸-SAP模型中,注射丹参注射液能够显著降低血淀粉酶和NF-kB表达水平,减轻胰腺组织的损伤、出血等[10]。
美常安为屎肠球菌和枯草杆菌二联活菌,是肠道中的正常菌群成员[11-12]。枯草杆菌能够迅速消耗环境中的游离氧,促进有益的厌氧菌生长,通过产生乳酸等有机酸,降低肠道PH值,抑制致病菌的生长;激活T、B淋巴细胞,提高免疫球蛋白和抗体水平,增强细胞免疫和体液免疫功能[13]。屎肠球菌属肠球菌属,是人肠道中正常菌群的一部分,能够抑制对人体肠系有害菌[14],调控人体肠系菌群和调整肠道菌群的平衡[15]。
