散发性结直肠癌微卫星不稳定状态与临床病理特征及预后的关系
2019-02-22隋燕霞蒋依娜张冠军
蒋 娜,隋燕霞,蒋依娜,张冠军
结直肠癌(colorectal cancer,CRC)是全世界第三高发恶性肿瘤,2015年CRC约占到全世界癌症总数的9.7%[1]。CRC的发生是一系列复杂的基因疾病的结果。微卫星不稳定(microsatellite instability,MSI)的肿瘤被定义为免疫组化(immunohistochemistry,IHC)染色检测有一个或多个错配修复蛋白(mismatch repair protein,MMR)缺失或基因检测表现出高频微卫星不稳定(high frequency microsatellite instability,MSI-H)。MSI占散发性CRC的15%,其具有独特的发生机制、预后、治疗方案以及与林奇综合征(Lynch syndrome,Lynch)有密切的关系。IHC法检测MMR缺失的被认可和使用,使得检测MSI变得简便易行,有利于为肿瘤治疗提供策略。秦云 等[2]证明此法的敏感度为94.9%,特异度为100.0%。目前关于MSI的研究不仅仅局限于发病机制上,其与CRC预后的关系也成为目前研究的热点。该研究通过分析CRC的临床病理特点与MSI的关系和随访CRC患者的生存状态,探讨MSI对中国人散发性CRC生存的影响。
1 材料与方法
1.1病例资料收集西安交通大学第一附属医院2014年1月~2016年12月经手术切除的CRC患者标本中213例的肿瘤组织与远离肿瘤组织正常直肠黏膜组织,有家族性腺瘤性息肉病的患者被排除。另外,入选病例术前均未行放、化疗。在分析的213例患者中,男118例,女95例;年龄19~92岁,中位年龄59岁,生存时间定义为自手术治疗之日至末次随访日或死亡所经历的时间,以月为单位计算。至研究终点(2017年12月)。依据2010版WHO组织学分级系统,将CRC分为高、中、低分化,如超过50%的肿瘤细胞表现为粘液分化,则被归为粘液腺癌。
1.2研究方法标本经10%中性福尔马林固定,常规脱水、包埋,4 μm切片,HE染色,光镜观察,并应用免疫组化Envision法染色。所用免疫组化一抗错配修复蛋白MSH2(mutS homolog 2)、错配修复蛋白MSH6(mutS homolog 6)、错配修复蛋白MLH1(mutL homolog 1)、错配修复蛋白PMS2(PMS1 homolog 2)及二抗[为鼠兔通用型抗体,二氨基联苯胺(DAB)显色]购自福州迈新公司。采用Ventana BenchMark XT system进行免疫组化染色。按照全部肿瘤细胞核均无着色方判定为该蛋白表达丢失。周围间质细胞和浸润淋巴细胞作为内对照。有MMR蛋白表达缺失的病例判定为MSI,未出现MMR蛋白表达缺失的判定为微卫星稳定(microsatellite stability,MSS)。MSI检测采用PCR-毛细管电泳法检测,选择肿瘤及远离肿瘤的正常切缘组织,采用德国Qiagen公司的DNA提取试剂盒(QIAamp DNA FFPE Kit)提取石蜡组织中的DNA,采用美国Promega公司的MSI检测试剂盒特异性扩增Bat25、Bat26、NR-21、NR-24、MONO-27位点,使用美国ABI公司Applied Biosystems 3500对扩增产物进行检测,使用GeneMapper4.1软件进行数据分析。
1.3统计学处理采用SPSS 18.0软件进行统计分析,计数资料比较采用χ2检验和Fisher确切概率法,生存分析采用Kaplan-Meier法并绘制生存曲线、Log-rank法比较组间生存时间的差异,P<0.05为差异有统计学意义。
2 结果
2.1CRC组织中MMR蛋白MLH1、MSH2、MSH6、PMS2免疫组化表达缺失率35例发生MMR蛋白表达缺失,见图1,其中12例为MLH1蛋白和PMS2蛋白表达缺失;6例为MSH2蛋白和MSH6蛋白表达缺失;4例为MSH2蛋白表达缺失;12例为MLHl蛋白表达缺失;1例为MSH6蛋白表达缺失。本研究显示MMR蛋白表达缺失病例多为肿瘤组织学分级为低分化,病理分型为粘液腺癌,右半结肠肿瘤,并与淋巴结转移情况及分期相关,MSI患者中只有4例发生淋巴结转移,大多数为Ⅱ期患者。而与患者年龄、性别、脉管浸润、神经浸润无显著相关性。见表1。
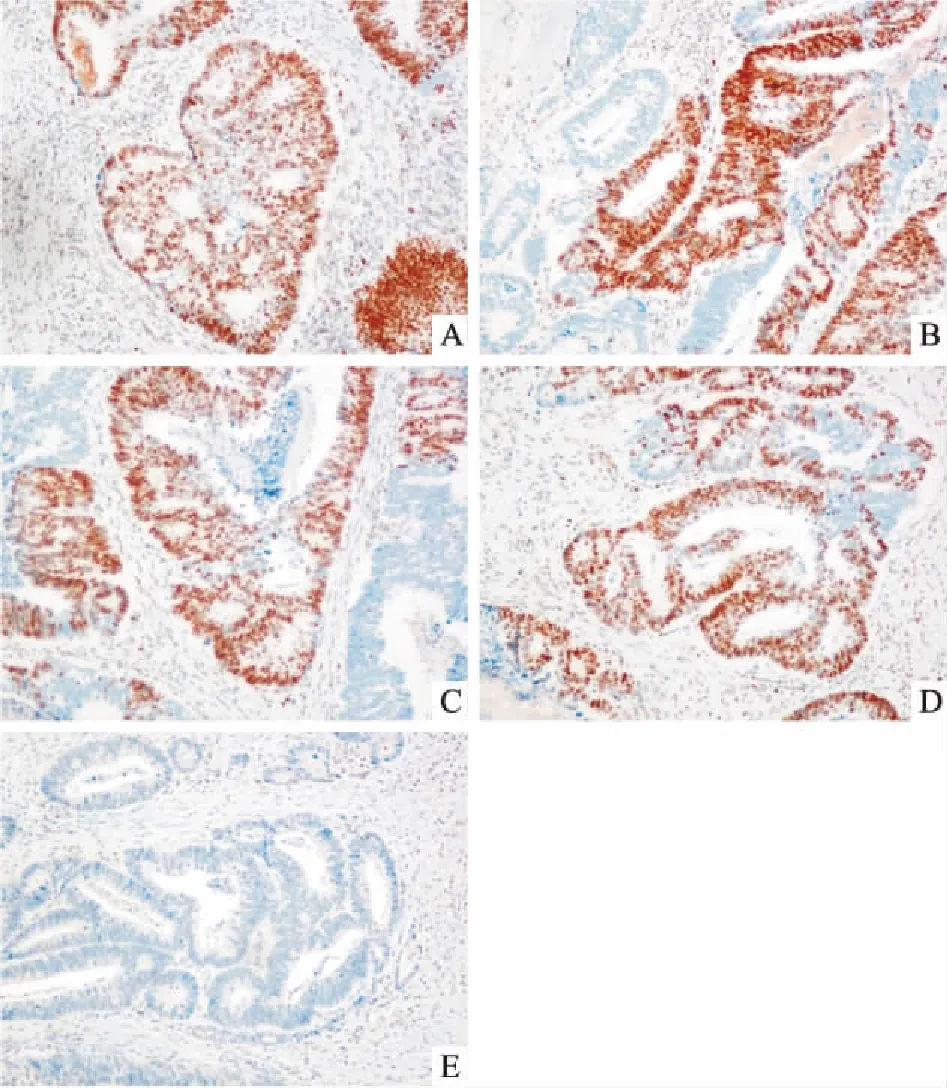
图1结直肠癌患者MMR表达情况×200
A:MSH2阳性;B:MSH6阳性;C:MLH1阳性;D:PMS2阳性;E:MMR蛋白阴性
2.2MSI检测结果随机抽取20例标本进行PCR-毛细管电泳法检测,其中3例肿瘤组织显示高频微卫星不稳定(high frequency microsatellite instability,MSI-H),其中1例肿瘤组织显示低频微卫星不稳定(low frequency microsatellite instability,MSI-L) ,其余肿瘤组织显示MSS,见图2。
2.3生存分析随访时间截止到2017年12月结束,41例(19%)的CRC患者死亡,均死于肿瘤复发转移,随访时间12~48个月,中位随访时间25个月。12例(6%)患者失访。同样,MSI患者总体生存时间(overall survival time,OS)高于MSS患者,预后较好(OS:χ2=4.004,P<0.05),见图3。
3 讨论
CRC在男女均是高发肿瘤,平均发病年龄62岁[3]。 Thibodeau et al[4]对导致Lynch综合征的错配修复基因进行微卫星研究,由此认识到一种定义为MSI的现象。MSI通路是由于DNA错配修复基因失活而发生,约15%的散发性CRC是由此发生。其病因通常是人类MLH1错配修复基因(human MutL homolog 1,hMLH1)启动子甲基化,MMR基因沉默导致IHC显示相关MMR蛋白阴性,表现MSI。然而,在散发性CRC,MSI的特征和重要性还知之甚少,并且MSI能否预测CRC患者预后仍有争论。
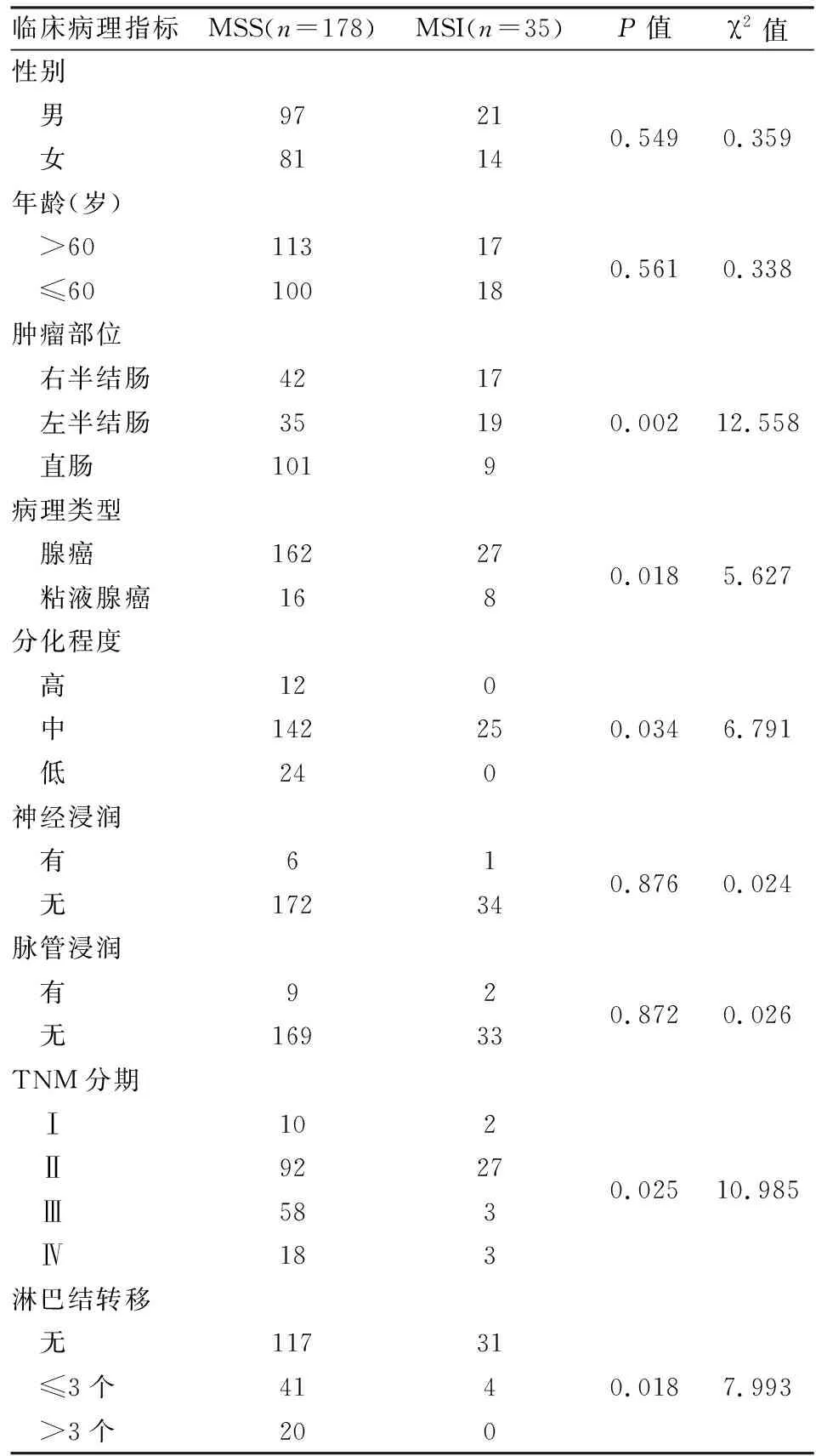
表1 MSI和MSS 结直肠癌患者临床病理特征的比较
本研究显示,大约16%的肿瘤表现为MSI,这一结果与之前的研究[5]结果基本一致。而且采用PCR-毛细管电泳法检测与IHC染色检测MMR蛋白获得的MSI-H比例一致。本研究结果还表明,MSI结直肠癌具有明显的临床病理特点,如多位于右半结肠,组织学多为粘液腺癌,组织学分级多为低分化,疾病分期早,淋巴结转移少见。有文献[6]报道MSI肿瘤多为女性,本研究没有证实性别与其有关,因此对于MSI-H与性别是否有关尚存在争议,有待进一步研究。 另外,值得注意的是有文献[7]报道MSI肿瘤患者年龄分布具有特点,伴有MLH1超甲基化的患者与伴有MMR基因胚系突变的患者相比年龄较大,而后者则较年轻。在一些学者的研究[8]中表明MMR缺失的病例较少发生淋巴结转移,这与本研究结果一致。还有些学者研究[9]表明MSI与肿瘤分期无关,但本研究显示MSI-H病例多为Ⅱ期患者,这可能和散发性MSI-H结直肠癌异质性更高,研究所选区域不能完全反映肿瘤整体,以及病例数量有关。
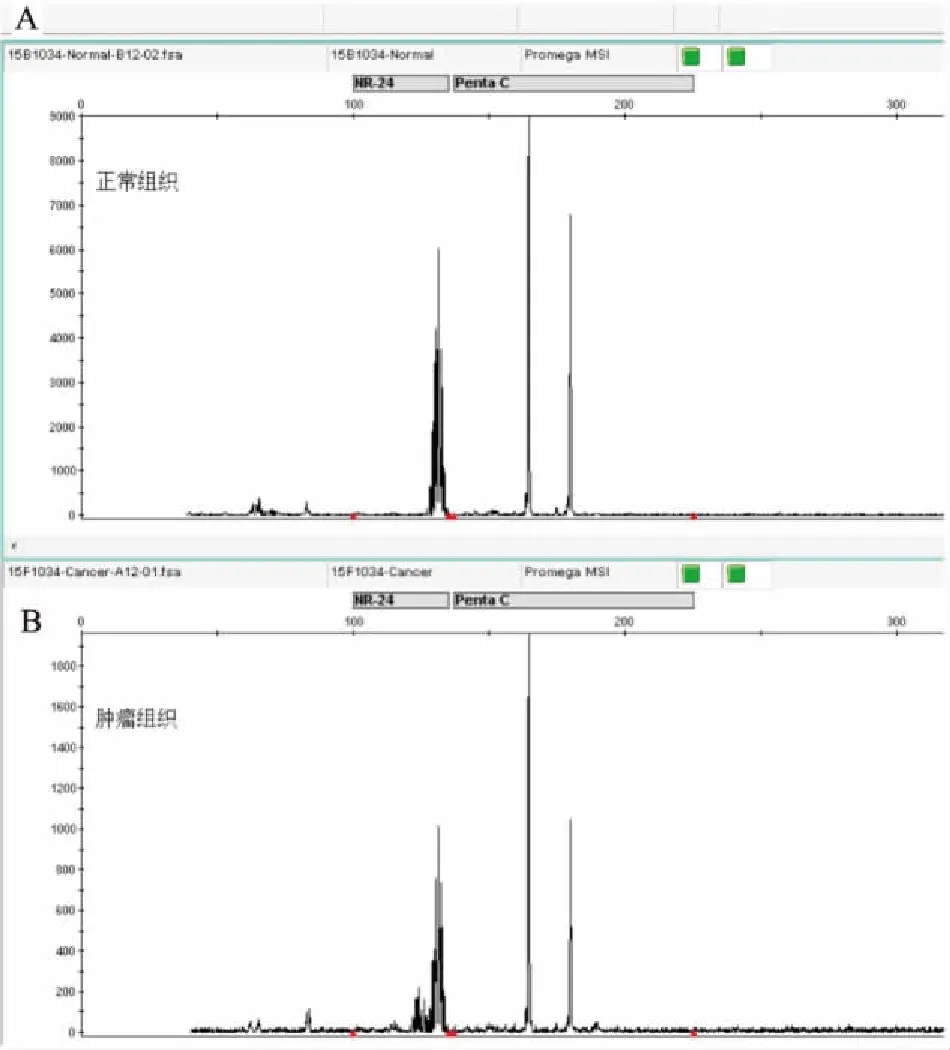
图2 PCR-毛细管电泳法检测
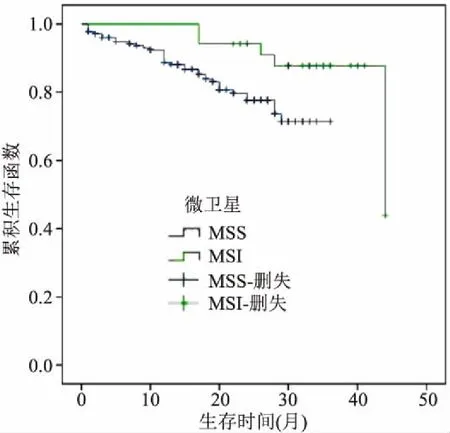
图3 结直肠癌患者的OS生存曲线
本研究显示不论任何一种组织学亚型的CRC,只要伴有MSI, 生存期均有所提高。有学者研究[10]显示伴有MSI的II期CRC患者6年生存率为97%,因此,这些患者手术后不需要辅助化疗。这些都提示MMR蛋白表达状态与CRC预后密切相关,并且可以很好地解释本研究结果中伴有MSI的肿瘤淋巴结转移的减少。虽然MSI检测是金标准,但IHC检查MMR蛋白性价比较高,更易于患者接受,因此所有CRC患者特别是<60岁患者都应进行筛查。IHC检查MMR蛋白为患者病情转归和化疗疗效提供预测,影响患者治疗策略的选择,并提示Lynch综合征,促进肿瘤的个体化治疗。
伴有MSI的CRC之所以有良好的预后是因为肿瘤本身的组织学特点。肿瘤组织周围以淋巴细胞为主的增强的炎症反应可能有助于生存时间的延长。目前本研究缺乏炎症反应方面的资料,但关于这一组织学特点的研究未来可能会成为研究的热点。
有研究[11]显示MMR蛋白缺失的Ⅲ期和Ⅳ期CRC患者发生肿瘤转移的比例较低,并且OS显著提高。散发性伴有MSI的CRC患者与染色体不稳定(chromosomal instability,CIN)途径发生CRC的患者相比预后较好。这一结果可能是由于p53和K-ras基因突变在伴有MSI的CRC较为少见。本研究的病例中,MSI患者以Ⅱ期肠癌为主,同时具有更长的总体生存时间,Ⅲ期和Ⅳ期患者相对较少,其中伴有MSI的病例则更少,因此微卫星状态对Ⅲ期和Ⅳ期CRC患者预后的影响了解较少。
