Omentin-1基因沉默后对结肠癌细胞增殖和凋亡的影响
2019-02-22李雪婷万丽娟张群慧陈明卫夏同佳唐松涛
李雪婷,万丽娟,张群慧,陈明卫,夏同佳,许 敏,唐松涛
肥胖与结肠癌[也称为结直肠癌(colorectal cancer,CRC)]之间的关系目前已有很多相关报道,肥胖患者CRC发生率较非肥胖人群明显增高[1]。近年来有许多关于脂肪因子(如瘦素、脂联素、内脂素等)与CRC之间的研究,网膜素(Omentin)是一种可增加胰岛素敏感性的脂肪因子,在血循环中Omentin-1是Omentin的主要表现形式,但目前关于Omentin与CRC之间的关系的研究较少。有研究[2]显示CRC患者中血清Omentin-1水平高于正常对照人群,而且这种改变与肥胖无关,提示CRC患者血清中高水平的Omentin-1与肥胖人群脂肪组织的分泌作用关系不大。课题组的前期研究[3]表明不同浓度的外源性Omentin-1分别干预SW480结肠癌细胞24 h、48 h,Omentin-1可促进SW480结肠癌细胞增殖、抑制其凋亡,效应呈浓度和时间依赖关系。 该研究通过体外实验RNA干扰沉默Omentin-1基因,进一步探索Omentin-1基因沉默后SW480结肠癌细胞增殖和凋亡的变化。
1 材料与方法
1.1材料人SW480结肠癌细胞株购自中科院上海细胞库;siRNA购自上海吉码制药技术有限公司;RNAiMAX、TRIzol购自美国Invitrogen公司;逆转录试剂盒购自美国Thermo公司;PCR扩增试剂盒购自日本TaKaRa公司;MTT、DMSO购自德国Sigma公司; Annexin V-FITC细胞凋亡试剂盒购自上海贝博生物公司;胎牛血清购自杭州四季青生物科技公司;RPMI-1640培养基购自美国HyClone公司;引物购自上海生物工程有限责任公司;Opti-ME购自美国Gibco公司。
1.2人SW480结肠癌细胞培养人SW480结肠癌细胞培养用含10%胎牛血清的RPMI-1640培养基常规置于37 ℃、5% CO2培养箱中培养,1 ~ 2 d换培养液,细胞生长至85%融合时传代。细胞在进行转染前1 d更换成无抗生素的RPMI-1640培养基。
1.3人SW480结肠癌细胞的Omentin-1基因转染将生长至对数生长期的SW480结肠癌细胞消化后收集细胞,以每孔2×105个细胞均匀铺在24孔板中,每孔500 μl无双抗的RPMI-1640培养基,24 h后,当细胞生长至汇合度为60% ~ 80%时进行转染。FAM-siRNA上游引物序列:5′-UUCUCCGAACGUGUCACGUTT-3′,下游引物序列:5′-ACGUGACACGUUCGGAGAATT-3′。设置FAM-siRNA转染终浓度为10、30、50、80、100 mmol/L 5组,分别取相应体积的FAM-siRNA稀释于25 μl Opti-MEM培养基中,另每组各取1.5 μl转染试剂RNAiMAX稀释于25 μl Opti-MEM培养基中,分别混匀后室温静置5 min,然后将两种稀释液混合后室温静置10 min,将混合液逐滴加入到24孔板中,轻轻摇晃24孔板使混合液与细胞充分接触,培养箱中避光孵育24 h后在荧光显微镜下观察转染情况。整个转染过程避光操作,使用无酶移液枪头和离心管。
1.4RT-PCR鉴定转染后Omentin-1基因沉默变化针对人Omentin-1基因的siRNA(human Omentin-1-siRNA)上游引物序列:5′-GCACUGAGAAUGGUGUUAUTT-3′,下游引物序列:5′-AUAACACCAUUCUCAGUGCTT-3′,阴性对照序列SiRNA:上游引物序列:5′-UUCUCCGAACGUGUCACGUTT-3′,下游引物序列:5′-ACGUGACACGUUCGGAGAATT-3′,将生长至对数生长期的SW480结肠癌细胞消化后收集细胞,以每孔5×105个细胞均匀铺在6孔板中,每孔加入2 ml无双抗的RPMI-1640培养基,实验分为转染组(转染目的基因siRNA)、阴性组(转染无关序列siRNA)、正常对照组(未转染组)、MAX组(只含转染试剂)。按照siRNA转染终浓度50 nmol/L(前一步已验证细胞在siRNA终浓度为50 nmol/L时转染效率最高)转染含有Omentin-1基因的siRNA,温箱中孵育24 h后,分别收集每组细胞,按照TRIzol一步法提取RNA,测定每组RNA浓度和纯度,然后根据逆转录试剂盒的步骤合成cDNA。human Omentin-1上游引物序列:5′-AGGAAAGTGCAGCTGAGACT-3′,下游引物序列:5′-GGAGACG AAGAACAGGTCCA-3′,扩增片段长度138 bp;GAPDH上游引物序列:5′-CAGGAGGCATTGCTGATGAT-3′,下游引物序列:5′-GAAGGCTGGGGCTCATTT-3′,扩增片段长度138 bp;扩增体系25 μl,分别为上下游引物各1 μl,cDNA 2 μl,DEPC水8.5 μl,SYBR Premix 12.5 μl。扩增程序:95 ℃、 30 s预变性,95 ℃、 5 s,60 ℃、 30 s,40个循环。读取每个反应的Ct值,2-ΔΔCt表示基因相对表达量。
1.5增殖实验将生长至对数生长期的SW480结肠癌细胞消化后收集细胞,以每孔6×104个细胞均匀铺在96孔板中,每孔加入100 μl无双抗的RPMI-1640培养基,24 h后进行转染,转染后24 h,弃去培养基,每孔加入180 μl不含血清和抗生素的RPMI-1640培养基和20 μl MTT(浓度为5 mg/ml),避光孵育4 h,去掉上清液,每孔加入150 μl DMSO,立即在酶标仪490 nm波长下检测吸光度(optical density, OD)值。实验重复3次,每次设4个复孔。
1.6凋亡实验将生长至对数生长期的SW480结肠癌细胞消化后收集细胞,以每孔5×105个细胞均匀铺在6孔板中,每孔加入2 ml无双抗的RPMI-1640培养基,24 h后进行转染,转染后24 h,用不含EDTA的胰酶消化收集细胞,预冷的PBS洗细胞2次,加入400 μl结合液重悬细胞,再加入5 μl Annexin V-FITC,混匀后,4 ℃避光孵育15 min,加入10 μl PI液,混匀后4 ℃避光孵育5 min,立即在流式细胞仪上检测各组细胞凋亡率,实验重复3次。采用Flowjo V7软件分析结果。

2 结果
2.1转染效率鉴定使用FAM-siRNA转染细胞24 h后在荧光显微镜下观察,镜下可见视野内带荧光的细胞。细胞在siRNA终浓度为50 nmol/L 时转染效率最高。见图1。
图1 荧光显微镜下观察细胞转染情况 ×40
2.2PCR鉴定基因沉默结果与正常对照组比较,阴性组和MAX组Omentin-1 mRNA相对表达量下降,差异无统计学意义(P>0.05);分别与正常对照组、阴性组和MAX组比较,转染组Omentin-1 mRNA相对表达量下降,差异均有统计学意义(F=8.044,P<0.05)。见图2。
2.3细胞增殖实验结果与正常对照组比较,阴性对照组和MAX组OD值没有明显变化,差异无统计学意义(P>0.05);分别与正常对照组、阴性组、MAX组比较,转染组OD值下降,差异均有统计学意义(F=8.499,P<0.05)。见图3。
2.4细胞凋亡结果与正常对照组比较,阴性对照组和MAX组凋亡率没有明显变化,差异无统计学意义(P>0.05);分别与正常对照组、阴性组、MAX组比较,转染组凋亡率升高,差异均有统计学意义(F=29.366,P<0.05)。见图4。
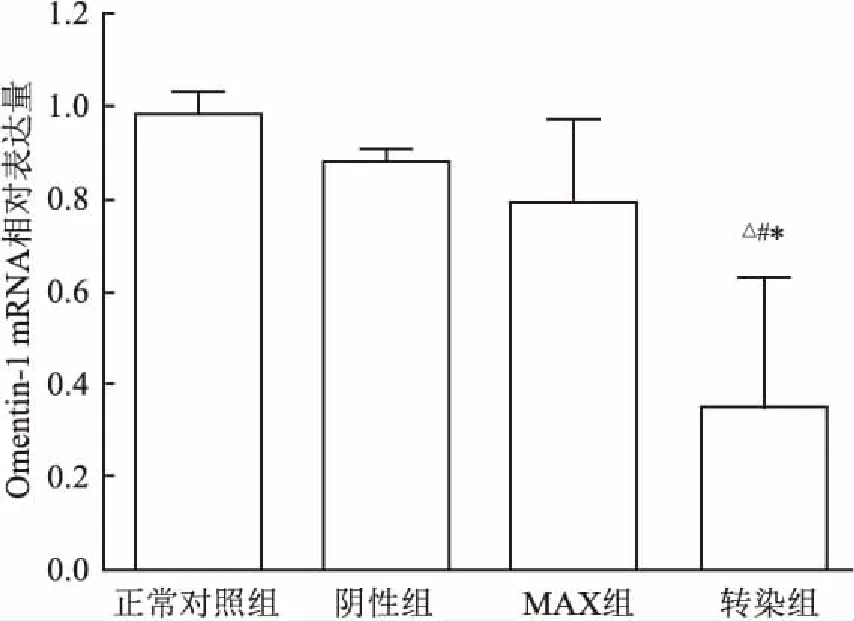
图2 Omentin-1基因mRNA沉默效果鉴定
与正常对照组比较:*P<0.05;与阴性组比较:△P<0.05;与MAX组比较:#P<0.05
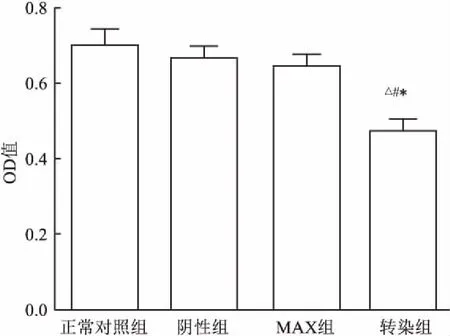
图3 细胞增殖实验结果
与正常对照组比较:*P<0.05;与阴性组比较:△P<0.05;与MAX组比较:#P<0.05
3 讨论
CRC是导致全球癌症患者死亡的第三大常见的癌症,研究[4]表明肥胖(特别是腹型肥胖)是CRC发生的高风险因素,研究[5-6]显示随着身体质量指数和腰围的增加,CRC患病的风险也将提高。目前有关肥胖与CRC的研究[7]表明,肥胖导致CRC风险增加可能与肥胖导致的慢性低度炎症状态,或与体内一些激素水平异常有关,如胰岛素、胰岛素样生长因子等。
近年来人们逐渐认识到脂肪组织分泌的脂肪因子可能在CRC的发病过程中发挥关键作用。网膜素是一种内脏脂肪表达的可增加胰岛素敏感性的脂肪因子,有两个结构基因:Omentin-1和Omentin-2,在血循环中,Omentin-1是主要的表现形式。临床研究[8]表明,肥胖人群中血清网膜素水平及网膜组织网膜素的基因表达水平均降低,且网膜素表达水平与身体质量指数及腰围等肥胖指标呈负相关。尽管肥胖患者Omentin-1水平明显降低,但是目前临床研究未能证实Omentin-1是肥胖患者发生CRC的独立危险因素,因此,在体外实验中,通过敲除CRC细胞株Omentin-1基因,从而降低Omentin-1水平,将有助于更清晰地阐明Omentin-1在CRC发生过程中的作用。
本研究结果显示,SW480细胞中Omentin-1基因被沉默后,Omentin-1表达明显降低,转染组凋亡率明显上升、增殖率明显下降,提示Omentin-1促进CRC细胞增殖、抑制其凋亡。Aleksandrova et al[9]的前瞻性群组研究表明,Omentin-1水平与CRC之间有密切的关系,高水平的Omentin-1更容易发生CRC,网膜素-1可以作为预测CRC风险的新型标志物,Szydo et al[10]研究显示Omentin-1蛋白在CRC中表达增加及Omentin-1基因在间皮瘤中表达增加,且Fazeli et al[2]研究也显示CRC患者Omentin-1水平明显高于健康对照者,与本研究结果一致。
但是,也有研究[11]显示,无糖尿病的Ⅲ期CRC患者进行手术和奥沙利铂、5-氟尿嘧啶等化学药物治疗后,Omentin-1水平明显升高。与此同时,Kimet al[12]研究表明intelectin-1水平的升高可以作为Ⅳ期癌症预后较好的标志。Maeda et al[13]通过对TMEM207(一种不典型的跨膜蛋白)研究表明Omentin-1水平的下调可能会导致进展期CRC患者预后不良。然而这与本课题组及Aleksandrova et al[9]、Fazeli et al[2]的研究结果相反。
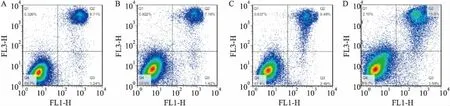
图4 流式细胞仪检测细胞凋亡
有研究[13]表明脂肪因子在促进肿瘤细胞增殖或凋亡效应上可能取决于不同癌细胞类型;Somasundar et al[14]研究显示瘦素可促进乳腺癌、前列腺癌细胞的增殖,但促进腺癌Mia-PaCa和PANC-1细胞凋亡;Zhang et al[15]研究结果显示Omentin-1可通过调节沉默信号调控因子(Sirt1)依赖的p53去酰化作用,促进肝癌细胞的凋亡;因此,Omentin-1对其他CRC细胞系(如CaCo-2、HCT116)在增殖凋亡方面可能也会产生不同的效应。关于Omentin-1对CRC细胞的作用有争议,还有一种解释是可能与Omentin-1在不同类型致癌过程中体现的“Janus-faced”病理生理学特性有关。因此Omentin-1与CRC细胞以及CRC之间的关系还需进一步的研究。
