碳纳米粒子的制备及性能
2019-02-22李永波
李永波, 王 汐
(1. 沈阳大学 师范学院, 辽宁 沈阳 110044; 2. 沈阳市第二十七中学, 辽宁 沈阳 110011)
传统量子点CdS、CdTe、PbS具有很高的荧光发光强度,使得它们在材料科学、生物化学电子器件及生物、医学等领域发挥重要的作用,尤其是在生物、医学领域有广泛的应用,比如生物传感器、活体细胞标记、生物成像技术及疾病诊断等方面.但是传统的半导体量子点含有重金属离子(Cd2+、Pb2+),其对生物生长和存活有很明显的影响,同时重金属离子的存在对环境也形成潜在的影响,使其应用受到一定限制.
2004年Xu[1]等在研究中偶然发现一种在紫外光下发出荧光的的物质,这种物质就是碳纳米粒子,经分离提纯后得粒径小于10 nm的碳纳米粒子,并称之为碳点(CDs).由于荧光碳纳米粒子特殊的性质和广泛的应用前景.科研人员对荧光碳纳米粒子制备方法、物理和化学性质及应用进行了系统研究.
荧光碳纳米粒子(CNPs)的制备方法归总为2类[2-3]:自上而下和自下而上.包括电化学合成法[4-5],微波合成法[6]等 .上述方法制备碳纳米粒子需使用强酸、强碱,强酸可使碳纳米粒子表面功能化,具有良好的亲水性和较高的荧光活性.碳纳米粒子的合成也可以采用有机物热分解法,有机酸、糖类、多羟基化合物等含有大量羟基、羧基等活性基团,热分解过程中会有一部分活性基团保留在碳纳米粒子表面[7-9](羟基、羧基),这样可以减少酸处理和钝化步骤.溶剂热法其优点是所用药品非常简单,合成步骤少成本低,采用常规加热,温度容易控制,所需设备简单,反应物利用率高, 无需后续分离,不用修饰,便可获得高亮度荧光碳纳米溶液.荧光碳纳米粒子具有强的荧光特性[10],其表面带有丰富的含氧基团,既是良好的电子受体,也是好的电子供体,具有宽且连续的激发光谱,可实现一元激发多重发射. 荧光碳纳米粒子主要由碳元素组成,自然界中的生物都是由碳元素构成的,所以荧光碳纳米粒子具有很好的生物相容性,且其毒性很低[11-12],对环境几乎没有任何影响,这一点对荧光碳纳米粒子的应用提供了非常便利的条件.
本研究采用溶剂热法,将富含羟基和羧基的柠檬酸和富含氨基和羧基的谷氨酸混和,在一定温度下反应获得了棕黄色荧光碳纳米粒子溶液,方法简单、成本低廉,所得产品可直接在实验中使用.
环境污染已严重影响到了人类的生存环境,如何治理环境污染已成为人们的重要研究课题.水中的污染物为无机废水和有机废水.印染废水是有机废水的一种,其中所含的有机染料在自然界中存留时间长,很难自然降解.而处理这样的污水需要耗费能源,寻找一种既经济又环保的方法处理污水一直是人们想要解决的问题.太阳能是大自然赋予人类的宝贵财富,太阳能取之不尽用之不竭,而且是对环境完全没有污染的清洁能源,合理利用太阳能是科研工作者的重要课题.光催化降解是一个化学反应,要完成这个降解反应,需要两个条件,一是光能,二是光催化剂.光催化剂是一些具有光活性和半导体性质的物质.在光的照射下能产生活性游离基,这种活性游离基具有强氧化性,能破坏有机物的结构而使其分解,传统量子点具有光催化活性,但其自身的污染会带来新的环境问题,应用受到限制.荧光碳纳米粒子是环保的光催化剂,对环境的影响很小[13]. 有关这方面的应用已有一些报道.本文对以荧光碳纳米粒子为光催化剂,以可见光为光源对甲基橙的降解进行了研究,实验表明,在过氧化氢的存在下,以荧光碳纳米粒子为光催化剂,可见光为光源甲基橙的脱色率可达95%以上.
1 实验部分
1.1 荧光碳纳米粒子的制备
溶剂热法制备荧光碳纳米粒子的方法如下:用天平称取柠檬酸1.00 g,谷氨酸0.20 g放入研钵中混合研匀研细;将研磨后的柠檬酸和谷氨酸放入50 mL烧杯中,加入20 mL乙二醇在磁力搅拌器上搅拌,加热使柠檬酸和谷氨酸溶解;将溶解后的溶液转移至反应釜中(反应釜内套为聚四氟乙烯材料,外套为不锈钢材料),将反应釜放入恒温干燥箱中加热,加热温度为170 ℃,加热时间为3 h,取出反应釜自然冷却至室温,得棕黄色荧光碳纳米粒子溶液(以上荧光碳纳米粒子的制备方法中,柠檬酸和谷氨酸的质量比为5∶1,在恒温干燥箱中加热温度可在150~180 ℃,加热时间可为2~3 h),备用.
1.2 试剂与仪器
柠檬酸、谷氨酸、乙二醇、过氧化氢、甲基橙均为分析纯试剂,均购自国药集团化学试剂有限公司,实验用水为蒸馏水,透析袋(MWCO:1000).
透射电子显微镜(TEM),日本日立公司;H-7650;荧光分光光度计,荷兰PANalytical 公司; X’Pert PRO X射线衍射仪;光源为150 W碘钨灯; 光强度测定采用TES1333R太阳能功率表,台湾泰任电子工业有限公司.
1.3 甲基橙光降解反应
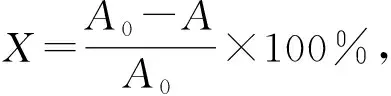
2 结果与讨论
2.1 荧光碳纳米粒子的表征
2.1.1 样品透射电镜图谱
图1为柠檬酸,谷氨酸及乙二醇所制备的碳纳米粒子的透射电镜图谱,图中显示碳纳米粒子为球形,粒径在10~30 nm之间,它们均匀地分散在溶液中,无团聚现象,说明所合成的碳纳米粒子具有良好的分散性.

图1 碳纳米粒子的TEM图Fig.1 TEM image of the carbon nanoparticles
2.1.2 样品XRD图谱
合成的碳纳米粒子XRD图谱如图2所示,在2θ=20°左右出现一宽峰,其为不定型碳的特征峰.

图2 碳纳米粒子XRD图Fig.2 XRD spectrum of the carbon nanoparticles
2.1.3 样品荧光光谱
图3为荧光碳纳米粒子溶液的激发和发射光谱图,从图中可以看出碳纳米粒子具有较宽的激发波长,从300~420 nm都可以激发,激发峰值为350 nm.发射波长在420~500 nm,发射峰值为440 nm.最大激发峰和最大发射峰峰值等高,相互间有90 nm的位移.碳纳米粒子溶液的激发峰和发射峰间的位移有利于生物成像中成像信号和背景信号的区分.图4为碳纳米粒子溶液在不同激发波长下的荧光发射图,所选激发波长在280~410 nm,图中显示,纳米粒子溶液的荧光发射峰与激发波长的峰值强度有关,激发波长的峰值越大纳米粒子溶液的荧光发射峰的最大峰值越高,于350 nm达最大值.随激发波长的增加荧光发射峰的最大峰值有向红外移动趋势,碳纳米粒子溶液的最大发射峰位置红移现象产生的原因可能是由于碳纳米粒子表面发射位点的不同或碳纳米粒子在合成时柠檬酸和谷氨酸结合的点位不同,在碳纳米粒子的表面产生缺陷造成的.

图3 碳纳米溶液的荧光激发和发射光谱

图4 碳纳米溶液不同激发波长的荧光光谱
2.2 碳纳米粒子光催化活性
2.2.1 碳纳米粒子对降解率的影响
在100 mL烧杯中固定含甲基橙为10.0 mg·L-1,加入1.0 mL质量分数为30%的过氧化氢,加入光催化剂荧光碳纳米粒子溶液0.20 mL,使烧杯中溶液的体积为50 mL,在磁力搅拌器上搅拌使溶液混合均匀.用紫外分光光度计测溶液502 nm的吸光度,光照1 h后,取溶液用紫外分光光度计测溶液502 nm的吸光度.另取光催化剂荧光碳纳米粒子溶液0.40、0.60、0.80、1.00、1.20 mL重复上面的实验,则不同加入量荧光碳纳米粒子溶液中,甲基橙的脱色率如图5所示.
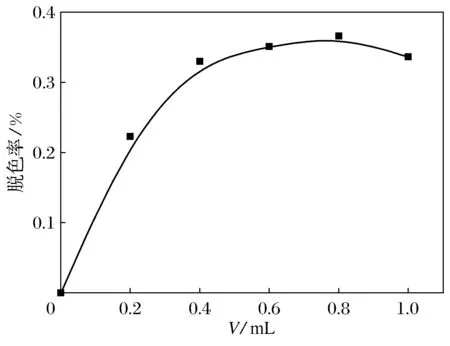
图5 不同碳纳米粒子溶液加入量对脱色率的影响
从图中可以看出光催化剂荧光碳纳米粒子对溶液中甲基橙脱色率的影响可分为2个阶段,第1阶段碳纳米粒子的加入量为0~0.80 mL,溶液中甲基橙的脱色率处于上升阶段,碳纳米粒子的加入量为0.80 mL达到峰值.第2阶段,碳纳米粒子的加入量为0.80~1.00 mL,溶液中甲基橙的脱色率开始缓慢下降.形成上述2个阶段的原因为,当碳纳米粒子的加入量为0~0.80 mL时,随着溶液中光催化剂的量的增加,由于光催化剂在溶液中起活性中心的作用,它在溶液中吸附有机染料,其空穴和光电子促使溶液中H2O2(电位1.77 V)生成活性更强的·OH(2.8 V).活性自由基·OH有强氧化性,可以破坏有机染料的结构,使有机染料分解,随着光催化剂量的增加,溶液中产生活性自由基·OH的量也增加,溶液中甲基橙的脱色速率增加,所以溶液中甲基橙的脱色率处于上升阶段.溶液中碳纳米粒子的加入量为0.80 mL时脱色速率达到最大值.当溶液中碳纳米粒子的加入量超0.80 mL时,溶液中甲基橙的脱色率开始缓慢下降.此时甲基橙光脱色主要受2个因素的影响.第一,随着溶液中光催化剂的量的增加,溶液中产生活性自由基·OH的量应该增加,溶液中甲基橙的脱色率应该增加.第二,碳纳米粒子光催化剂是固体颗粒,粒径在10~30 nm之间,它悬浮在溶液中,随着溶液中光催化剂量的增加,溶液中固体颗粒在增加,当可见光照射溶液时,固体颗粒对光照射产生影响.当可见光照射到固体颗粒表面时,光发生了散射现象,阻碍可见光的前进方向,光照无法达到溶液的深处,降低了可见光的光能,使溶液中生成活性自由基·OH的量在减少,从而影响了光催化脱色的效率.此阶段后者起决定作用,所以溶液中甲基橙的脱色率处于下降阶段.
2.2.2 过氧化氢对脱色率的影响
在100 mL烧杯中, 加入光催化剂荧光碳纳米粒子溶液0.80 mL, 加入质量分数为30%的过氧化氢0.60 mL, 固定溶液中含甲基橙为10.0 mg·L-1,保持烧杯中溶液的体积为50 mL.在磁力搅拌器上搅拌使溶液混合均匀.用紫外分光光度计测溶液502 nm的吸光度,光照1 h后,取溶液用紫外分光光度计测溶液502 nm的吸光度.另取质量分数为30%的过氧化氢0.80、1.00、1.20、1.40、1.60 mL重复上面的实验,则不同加入量过氧化氢溶液中,甲基橙的脱色率如图6所示.

图6 不同过氧化氢加入量对脱色率的影响
从图中可以看出随着溶液中过氧化氢加入量的增加,甲基橙的脱色率呈逐步上升趋势,开始上升比较缓慢,然后快速上升,最后上升速度趋于平缓.这是因为开始时溶液中过氧化氢的含量比较少,而光降解中破坏甲基橙分子结构的是活性自由基·OH,过少过氧化氢无法提供足够活性自由基·OH,所以甲基橙的降解率呈缓慢上升趋势.随着过氧化氢加入量的增加,溶液中过氧化氢的质量分数在增加,在光催化剂的作用下,溶液中活性自由基·OH的量在增加,使得甲基橙的脱色率快速上升.最后,过氧化氢的量进一步增加时甲基橙的降解率上升速度趋于平缓,这是因为过氧化氢既能在光催化剂的作用下产生活性自由基·OH,同时过氧化氢也能使活性自由基·OH失活.2个因素同时起作用,溶液中净产生活性自由基·OH的量变少,使得甲基橙的脱色率上升速度趋于平缓.
2.2.3 光照时间对甲基橙脱色率的影响
在100 mL烧杯中,加入光催化剂荧光碳纳米粒子溶液0.80 mL,加入质量分数为30%的过氧化氢1.50 mL,固定溶液中含甲基橙10.0 mg·L-1,保持烧杯中溶液的体积为50 mL.在磁力搅拌器上搅拌使溶液混合均匀.用紫外分光光度计测溶液502 nm的吸光度,置于灯光照射,每隔1 h取溶液,用紫外分光光度计测溶液502 nm的吸光度.则光照时间与甲基橙脱色率的关系如图7所示.

图7 光照时间对脱色率的影响Fig.7 Effect of illumination time ondecolorization rate
由图可知,甲基橙水溶液在荧光碳纳米粒子光催化条件下,甲基橙在502 nm处的特征吸收峰随时间下降很快,光催化脱色4 h后,特征吸收峰基本消失.随着反应时间的延长,光催化反应对甲基橙脱色率逐渐升高,光催化降解4 h,甲基橙脱色率可达95%.
3 结 论
甲基橙是一种偶氮化合物,在溶液中有2种存在形式,在酸性溶液中为醌式结构,在碱性溶液中为偶氮式结构.本实验以甲基橙为模拟污染物,以柠檬酸和谷氨酸为碳源,以乙二醇为溶液,采用溶剂热法合成的荧光碳纳米粒子溶液为催化剂,对甲基橙进行可见光光催化降解实验.结果表明,固定溶液的体积为50 mL甲基橙起始质量分数为10 mg·L-1,荧光碳纳米粒子溶液用量为0.8 mL,双氧水用量为1.5 mL,光照4 h,甲基橙的脱色率可达到95%.
