冷鲜猪肉中单增李斯特菌快速检测试纸条的初步研制
2019-02-22祁文婧齐颖颖张红星
赵 鑫,张 帅,祁文婧,齐颖颖,张红星
(北京农学院食品科学与工程学院/食品质量与安全北京实验室/北京市食品安全免疫快速检测工程技术研究中心/微生态制剂关键技术开发北京市工程实验室,北京102206)
单增李斯特菌(Listeriamonocytogenes, LM)是革兰氏阳性菌,无芽孢和荚膜,具有很强的环境耐受力,在弱酸性、中性乃至弱碱性条件下皆可存活,其生长温度范围可达0~50℃,具有低温存活生长性,因此,单增李斯特菌是为数不多的低温致病菌之一[1,2]。
单增李斯特菌已成为继大肠杆菌、沙门氏菌、金黄色葡萄球菌的第四大食源性致病菌,它在自然界中广泛存在,能对水源、饲料及各类食品造成污染,尤其是冷藏食品[3]。单增李斯特菌污染的食物会导致细菌性食物中毒,感染者会出现呕吐、腹痛等常见症状,严重时可引发婴儿化脓性脑膜炎、成人败血症和孕妇流产等李斯特氏菌病[4]。
为降低单增李斯特菌对人类健康的威胁,国内外学者进行许多针对性的研究,如添加细菌素等安全的新型天然防腐剂、采用现代物理化学联合杀菌技术、研究绿色包装材料等。此外,对食品安全性的检测也是其中重要的一环。目前检测单增李斯特菌的方法主要有传统国标法、分子生物学法、免疫法、生物传感器法等[5]。传统的检测方法由于检测用时长,无法应对突发性的食品安全事件;分子生物学法,在灵敏度和特异性方面有明显优势,但对工作人员和检测设备的要求较高,成本较高;生物传感器法还处于起步阶段,未得到广泛推广;而免疫学法基于抗原抗体特异性结合的原理,能快速、简便的得出结果,适用于大批量样品的快速检测。基于免疫技术的快速检测产品在市场上越来越受欢迎,以Faulk和Taytor在1971年将胶体金作为一种标记示踪物而发展起来的免疫胶体金技术为起点,一种新的免疫学检测方法逐渐建立起来,因其结果直观、操作简便的优势在各检测领域得到广泛应用[6-8]。基于该技术开发的胶体金试纸条可满足快速检测的要求,在几分钟之内就可得到肉眼可见的结果,适用于动植物检疫、食品安全监督等领域的现场检测。刘美辰等[9]利用单增李斯特菌的内化素A(lnlA)蛋白制备单克隆抗体并研制出灵敏度为106CFU/mL的胶体金免疫层析试纸条。熊国华等[10]针对单增李斯特菌制备的胶体金免疫层析试纸条的灵敏度为106CFU/mL。谢士嘉[11]等以胶体金免疫层析技术为基础建立快速定量检测单增李斯特菌的方法,其定量检测灵敏度可达到3.5×103CFU/mL,线性范围3.5×105~3.5×103CFU/mL。中国对于检测单增李斯特菌试纸条的研究并未达到成熟阶段,用于快速检测的试纸条也没有大范围进行推广。本试验以期制备出能快速检测冷鲜猪肉中单增李斯特菌的胶体金试纸条。
1 材料与方法
1.1 试验材料
单增李斯特菌、肠炎沙门氏菌、福氏志贺氏菌、阪崎肠杆菌、金黄色葡萄球菌、SP2/0骨髓瘤细胞均来自实验室保存,BALB/c小鼠购自北京维通利华动物中心。
胎牛血清、DMEM培养基购自美国GIBCO公司,HAT培养基、HT培养基、PEG2000、氯金酸购自美国Sigma公司,HRP标记山羊抗小鼠IgG购自北京鼎国昌盛生物技术有限公司,柠檬酸三钠购自国药集团化学试剂有限公司,其他试剂均为分析纯。
酶标测试仪购自美国Bio Rad公司,4MK2型洗板机购自美国Theromo公司,二氧化碳培养箱购自江苏Heal Force公司,倒置显微镜购自日本奥林巴斯公司,XYZ3050喷金划膜仪购自美国Bio-Dot公司。
1.2 试验方法
1.2.1 制备抗原 单增李斯特菌标准株活化后于固体培养基划线培养,37℃静置24 h,挑取单菌落接种于5 mL液体培养基中,置于180 r/min、37℃摇床中培养12 h,之后按2%的接种量扩大培养至1 L,分别取少量菌液,进行平板计数。取5 mL菌液12 000 r/min离心5 min,收集菌体,分别用无菌生理盐水洗涤菌体3次,之后用生理盐水重悬,121℃、30 min灭活后,再次用生理盐水洗涤3次,并调节抗原为1×109CFU/mL,于-20℃保存备用。
1.2.2 免疫小鼠 将制备好的抗原采用背部皮下多点注射方式免疫小鼠,首次免疫为抗原与完全弗氏佐剂等量混合,之后则与等量不完全弗氏佐剂混合。免疫剂量为100 μL/只,每14天免疫1次,3~4次后取血并用间接ELISA法检测血清效价。
1.2.3 制备单克隆抗体[12]选择效价较高的小鼠采用腹腔注射对其进行加强免疫,免疫剂量为100 μL。3 d后取其脾脏与培养好的SP2/0骨髓瘤细胞进行融合,筛选出阳性杂交瘤细胞,置于液氮中保存。将石蜡油注射进小鼠腹腔内致敏,之后将生长至对数期的杂交瘤细胞株注射到致敏的小鼠腹腔内,诱导腹水产生单克隆抗体并于7 d后收集腹水,离心去除脂肪及其他杂质。用间接ELISA法检测抗体效价,用SDS-PAGE法测定单克隆抗体的纯度。
1.2.4 单克隆抗体特性分析 通过双抗夹心ELISA体系[13]和抗体相加试验[14]筛选出一对稳定、高效的最佳配对抗体,并检测单抗的特异性和灵敏度。取灭活的单增李斯特菌、大肠杆菌、志贺氏菌、阪崎肠杆菌、金黄色葡萄球菌,分别用PBS稀释到108CFU/mL,以检测单抗的特异性。用PBS将单增李斯特菌进行10倍梯度稀释,依次调整为108、107、106、105、104、103、102CFU/mL以检测单抗的灵敏度。分别进行3次重复试验。
1.2.5 免疫胶体金试纸条的制备 采用柠檬酸三钠还原法制备胶体金:取100 mL0.01%的氯金酸溶液于锥形瓶中,置于电磁炉上边搅拌边加热至沸腾,立即加入柠檬酸三钠,继续加热至溶液变为透亮的红色,冷却至室温,定容到100 mL,4℃避光保存[15]。
金标抗体制备及鉴定:取9个1.5 mL的离心管,分别加入1 mL胶体金溶液,用0.1 mol/L的K2CO3将pH值分别调节至6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0,之后加入制备好的1.0 mg/mL的LM单抗50 μL,充分震荡,静置15 min,观察颜色变化,保持红色的最低pH值即为最适pH值;取7个1.5 mL的EP管分别加入1 mL胶体金溶液,用0.1 mol/L的K2CO3调至其最适pH值,按表1操作。
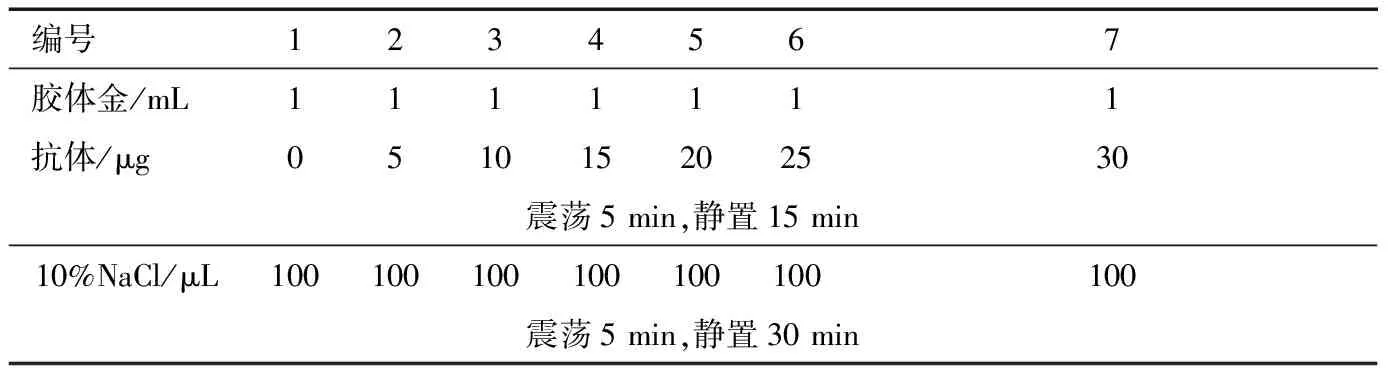
表1 抗体最佳标记量Tab.1 The optimal amount of antibody
试纸条的组装:使用三维喷金划膜仪,分别在硝酸纤维素膜(NC膜)的检测线(T线)和质控线(C线)位置喷涂适宜的金标抗体和1 mg/mL的山羊抗小鼠IgG,将喷好的NC膜放置于30℃真空干燥箱干燥25 h以上。将样品垫、NC膜、结合垫、吸水垫粘于PVC支撑板上,然后用可编程切割机将组装好的条子切割成39 mm宽度的试纸条,置于常温干燥缸中保存备用。
1.2.6 试纸条灵敏度试验 取灭活的LM标准菌株,按照1.2.4用PBS进行梯度稀释,测试试纸条的灵敏度并进行3次重复试验。
1.2.7 试纸条特异性试验 实验室保存的其他致病菌(大肠杆菌、志贺氏菌、阪崎肠杆菌、金黄色葡萄球菌)稀释成106CFU/mL,测定试纸条的特异性,重复3次。
1.2.8 试纸条实用性的验证 在本地市场和超市中随机购买一定数量的新鲜冷鲜猪肉样品,灭菌后在无菌条件下切碎样品,称取25 g于均质袋中,每袋加225 mL已灭菌的液体培养基,均质1~2 min,分别添加不同稀释(108、107、106、105、104、103CFU/mL)的LM菌液,37℃培养12 h。用本试验制备的试纸条进行检测。
2 结果分析
2.1 单克隆抗体的制备
在96孔细胞培养板中进行杂交瘤细胞的筛选,通过有限稀释法进行亚克隆至阳性率达到100%。最终通过间接ELISA法筛选出2株稳定的最佳配对抗体,命名为3B7、5C9,其效价均达到1∶102 400。将得到的分泌抗体的杂交瘤细胞注射入石蜡油致敏的小鼠腹腔内,收集腹水20 mL,辛酸硫酸铵法[16]纯化后得到单克隆抗体,用聚丙烯酰胺凝胶电泳(SDS-PAGE)法测定单克隆抗体纯度高于95%(图1)。

M:Marker;1:3B7;2:5C9图1 3B7、5C9单克隆抗体SDS-PAGE电泳图Fig.1 SDS-PAGE of 3B7、5C9 monoclonal antibody
2.2 单克隆抗体的特性分析
用间接ELISA法检测单抗对单增李斯特菌、大肠杆菌、志贺氏菌、阪崎肠杆菌、金黄色葡萄球菌的特异性(如图2),结果表明:单克隆抗体与单增李斯特菌表现出显著的阳性反应,与其他菌株无交叉反应,特异性良好。对单克隆抗体的灵敏度检测结果表明该体系的灵敏度可达到104CFU/mL(图3)。
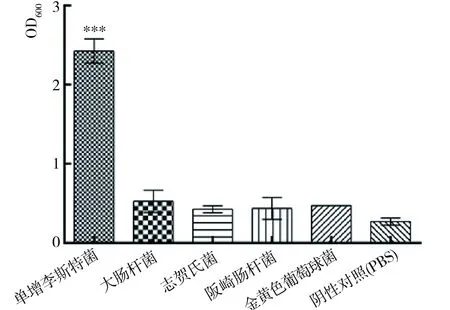
图2 ELISA法检测单克隆抗体的特异性(***,P≤0.001)Fig.2 The specificity ofmonoclonal antibody by ELISA (***,P≤0.001)

图3 单克隆抗体对单增李斯特菌的灵敏度检测结果Fig.3 The sensitivity ofmonoclonal antibody against L. monocytogenes
2.3 金标抗体的最适pH值
pH值为8.0的样品经肉眼观察仍保持透亮的红色,颜色变化最小,确定最适pH为8.0(图4)。
2.4 金标抗体的最适抗体标记
在最佳pH条件下,当抗体含量≥20 μg时,溶液稳定没有蓝色沉淀现象,仍保持红色。在此基础上将抗体含量增加20%为稳定胶体金的最适抗体标记,即24 μg(图5)。
2.5 试纸条特异性检测
阳性对照,即单增李斯特菌,正常显色,阴性对照及其他检测菌株均无显色,说明此试纸条特异性良好,与其他检测菌株无交叉反应(图6)。
2.6 试纸条灵敏度检测
当待测菌液达到106CFU/mL时,C线与T线均显示红色条带,而菌液低于106CFU/mL时试纸条呈阴性反应,因此,该试纸条灵敏度确定为106CFU/mL(图7)。

图4 目测法确定胶体金标记抗体最适pH值Fig.4 The optimization pH determination of gold colloid binding antibody by visual observation

图5 目测法确定金标记最适抗体Fig.5 The optimization concentration determination of gold colloid binding antibody by visual observation

图6 试纸条对单增李斯特菌的特异性检测Fig.6 The soecificity of strips on testing L. monocytogenes

图7 试纸条检测单增李斯特菌的灵敏度Fig.7 The sensitivity of strips on testing L. monocytogenes
2.7 试纸条实用性验证
对处理过的猪肉样品的检测结果表明,当LM菌液高于106CFU/mL时,试纸条检测结果呈阳性反应,低于106CFU/mL时,试纸条呈阴性反应,与试验结果保持一致。该试纸条具有一定的实用性。
3 讨 论
单增李斯特菌是李斯特菌属中唯一具有致病性的菌种,尤其易出现在低温制品中。为了能快速、简便、准确检测食品中的单增李斯特菌,利用胶体金免疫层析技术的试纸条应运而生。免疫胶体金试纸条应用前景广阔,既能快速直观看到检测结果,又不会对食品品质造成影响,是现场检测的最佳方法。本试验制备抗单增李斯特菌的单克隆抗体,通过建立双抗夹心ELISA体系初步制备出可检测单增李斯特菌的胶体金免疫层析试纸条,具良好的特异性,检测限可达到106CFU/mL,与常见的食源性致病菌无交叉反应。在实际生产和应用中,胶体金的制备和试纸条的组装条件是试纸条成功与否的关键步骤,此步骤需要大量实践数据的支撑,需要通过多次重复试验进一步调试。本试验受材料、经验及时间等条件限制,仅仅初步制备出实验室条件下模拟检测的试纸条,虽然距离实际生产应用的要求还有一定差距,但也为日后该类试纸条的推广奠定基本理论基础,积累宝贵经验。
