地鳖肽对H2O2刺激鸡骨骼肌卫星细胞增殖的影响
2019-02-22李静怡徐小艾晁雨竹李向东张永红
李静怡,徐小艾,晁雨竹,李向东,沈 红*,张永红*
(1.北京农学院动物科学技术学院/动物类国家级实验教学示范中心(北京农学院)/北京农学院兽医学(中医药)北京市重点实验室,北京 102206;2.中国科学院动物研究所,北京 100101)
肌肉是畜禽胴体的重要组成部分,肌纤维是骨骼肌的基本单位。动物骨骼肌纤维数目在出生前已确定,出生后骨骼肌发育和肌肉的再生主要依赖于肌卫星细胞[1]。当机体受到外界刺激(损伤、锻炼等)时,处于静息状态的骨骼肌卫星细胞就会被激活,从肌纤维肌膜与基底膜之间游离出来,经历增殖和定向分化形成完整的新的肌纤维或修复受损肌纤维[2]。卫星细胞从静止状态到被激活的过程中,受到众多因子及信号通路的精准调控,其中主要调控因子包括Pax3/7、生肌调节因子(Myogenic Regulatory Factors,MRFs)家族等。增殖调控因子Pax7对肌卫星细胞静息状态中的自我更新、肌肉形成、损伤后修复等过程中都起重要作用,Pax7在胚胎发育期的缺乏会导致肌卫星细胞数量大量减少[3]。此外,Pax7作为肌卫星细胞特异性标志之一,可通过免疫荧光等方法用于卫星细胞的鉴定。MRFs家族在肌肉发育、分化和功能完善的各个环节都发挥调控作用,包括MyoD、Myf5、myogenin和MRF4[4]。Myf5和MyoD作为肌细胞增殖期的标志,二者的表达代表肌卫星细胞处于活化状态[5]。研究骨骼肌卫星细胞增殖分化过程对提高动物产肉能力及肉品质具有非常重要的意义。
地鳖(EupolyphagasinensisWalker, ESW)作为中国传统中药材,具有药食兼用的特性[6]。现代药理学研究证明地鳖具有广泛的药理作用,但对于其有效活性成分的深入研究还相当薄弱[7]。地鳖富含蛋白质,其酶解产物多肽具有一定的抗氧化活性,但研究还较为浅显,有关作用机制的研究及对其他动物的作用仍未见报道。本试验通过体外分离培养鸡胸肌卫星细胞,建立H2O2刺激细胞模型,分析肌卫星细胞增殖及调控基因的相对表达,初步探讨地鳖肽(ESWP)对H2O2刺激下卫星细胞增殖的影响,以期为研究地鳖肽在肌肉发育中的功能提供试验依据。
1 材料与方法
1.1 材料
Ⅰ型胶原酶、胰蛋白酶、DAPI等购自北京索莱宝科技有限公司,鼠抗鸡Pax7单克隆抗体购自美国Santa Cruze公司,FITC-羊抗鼠IgG购自武汉博士德生物科技有限公司,TUREscript 1st Strand cDNA Synthesis Kit 购自北京艾德莱生物科技有限公司,SYBR© Premix Ex TaqTM(TliRnaseH Plus)(RR420A)购自日本TaKaRa公司,所用引物由华大科技公司合成。荧光倒置显微镜购于日本Olympus公司,全自动酶联免疫检测仪和核酸蛋白测定仪购于美国Merinton公司,荧光PCR仪购自美国Applied Biosystems公司。1日龄雏鸡购自北京富佳种禽中心。
1.2 方法
1.2.1 鸡胸肌卫星细胞(SCs)分离纯化与鉴定 1日龄雏鸡心脏采血处死,酒精浸泡后置于超净台中,取其胸部肌肉PBS洗涤,剔除血管和脂肪等,用剪刀将其剪至肉糜状,分别加入Ⅰ型胶原酶和胰蛋白酶消化,然后加入等体积完全培养基终止消化,过细胞筛后收集离心并重悬细胞,加入培养皿中置于培养箱培养备用。
采用差速贴壁法去除细胞悬液中的成纤维细胞,将细胞加入细胞板内,待细胞贴壁后用PBS清洗,4%多聚甲醛固定,加入0.1% TritonX-100静置10 min,10%山羊血清室温封闭,弃上清,加入一抗Pax7,4℃过夜,加入FITC标记的二抗,37℃避光孵育1 h,加入DAPI染色液,避光孵育5 min,PBS冲洗后,荧光倒置显微镜下观察及拍照。
1.2.2 MTT法检测细胞存活情况 SCs细胞贴壁密度达80%~90%左右,收集细胞加入含有不同浓度地鳖肽(0、50、100、200、400 μg/mL),96孔板培养细胞24 h,然后加入不同浓度H2O2(0、50、100、200、300、400、500 μmol/L),继续培养2、4、8、16 h。每孔加入MTT 37℃避光培养4 h后弃去上清液,每孔加入DMSO后振荡,置于酶标仪570 nm处测吸光度值,计算细胞存活率。
1.2.3 RT-PCR检测增殖因子表达水平 试验分为对照组、H2O2组和地鳖肽组。地鳖肽处理细胞培养24 h后,除对照组外,其余各组加入200 μmol/L H2O2刺激细胞8 h,然后每孔加入1 mL Trizol试剂,收集细胞悬液到EP管并加入0.2 mL氯仿,剧烈震荡后静置,4℃ 12 000 r/min离心15 min,将上层透明水相层吸到新EP管中,加入0.5 mL异丙醇,静置后离心弃上清,75%乙醇(DEPC水配制)洗3次,空气中干燥,加入少量DEPC水,溶解RNA并混匀,核酸蛋白测定仪检测RNA浓度和OD260/280值。
按照TUREscript 1st Strand cDNA Synthesis Kit说明,制备20 μL反应体系,RNA模板3 μL、Oligo(dT)18 1 μL、Rtase 0.8 μL、5×RTRraction Mix 4 μL、Rnase free H2O 补齐20 μL,置于PCR仪内进行反转录,42℃ 50 min、65℃ 15 min、4℃维持,即得cDNA。
建立20 μL PCR反应体系:cDNA 2 μL、上下引物各1 μL、SYBR Premix Ex Taq(2×)10 μL、ROX Reference Dye (50×) 0.4 μL、灭菌蒸馏水5.6 μL,反应条件为95℃ 30 s,95℃ 5 s,49~57℃(引物最适温度)30 s,95℃ 15 s,60℃ 1 min,95℃ 15 s,共40个循环。采用Step One Software v2.1分析PCR数据,按2-ΔΔCt法分析基因相对表达量。引物根据GenBank中的序列用Primer5.0软件设计,由北京华大科技有限公司合成(表1)。

表1 SYBR real-time PCR 反应引物序列Tab.1 Sequences of the primers in SYBR real-time PCR
1.2.4 统计分析 试验数据用平均值±标准差表示,先用Microsoft Excel作初步整理,然后使用Graph pad Prism6.0软件进行方差分析,差异显著时进行LSD各组间多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 肌卫星细胞分离培养与鉴定
采用两步酶消化法分离获得肌卫星细胞,差速贴壁法纯化细胞,倒置显微镜下观察细胞形态,结果刚分离的P0代肌卫星细胞培养24 h后开始贴壁,为梭形或纺锤形(图1A);继续培养细胞48 h贴壁完全,细胞数目不断增多、相互接触并联结成网;随着细胞培养时间的延长,细胞逐渐汇合并有规律平行排列,直至形成分布均匀的单层细胞;细胞传代培养后形态饱满且折光性较强(图1B);细胞冻存复苏后培养细胞在形态上无明显差异(图1C)。Pax7是肌卫星细胞静息期和增殖期表达标志基因,采用细胞免疫化学染色肌卫星细胞检测基因,结果阳性细胞细胞核表达Pax7,DAPI染核叠加观察肌卫星细胞Pax7阳性率可达95%以上(图2)。
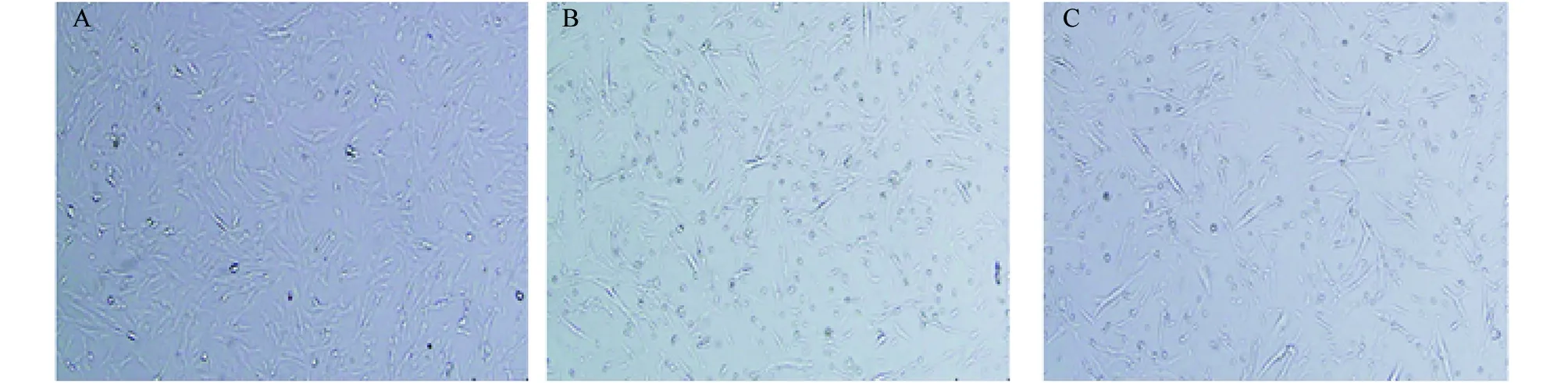
图1 原代肌卫星细胞培养过程中的细胞形态(A、B、C分别为P0代、P1代、复苏的肌卫星细胞;100×)Fig.1 Cell morphological state during primary SCs culture (ABC mean P0, P1 SCs and recovery SCs.100×)

图2 肌卫星细胞免疫荧光染色鉴定(100×)Fig.2 Immunofluorescence staining of muscular satellite cells (100×)
2.2 不同处理条件对肌卫星细胞活力的影响
采用MTT法检测不同时间不同浓度H2O2对SCs细胞活力的影响,结果随着H2O2浓度的增加,细胞活力逐渐降低,当H2O2浓度为200 μmol/L时刺激细胞8 h其活力显著降低为65.16%,此时细胞受损但并未大量死亡,后续试验选取H2O2作用条件为200 μmol/L为受处理细胞8 h(图3)。地鳖肽在50~200 μg/mL范围内单独处理肌卫星细胞,其对细胞活力影响不明显,但浓度在400 μg/mL时细胞活力稍有下降但差异不显著(图4A);当地鳖肽浓度在50~200 μg/mL时预处理细胞,然后200 μmol/L H2O2刺激细胞8 h,此时细胞活力从77.73%升高至83.89%,与H2O2组相比差异极显著,且地鳖肽剂量依赖性缓解H2O2导致的细胞活力下降(图4B)。
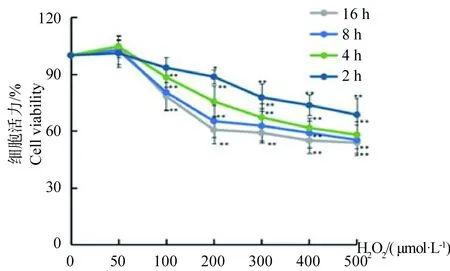
图3 不同浓度H2O2作用不同时间对肌卫星细胞活力的影响(与0 μmol/L相比,*P<0.05,** P<0.01)Fig.3 Effects of different concentrations of H2O2 on the viability of SCs cells at different time(Note: Compared with 0 μmol/L, * P<0.05, ** P<0.01)
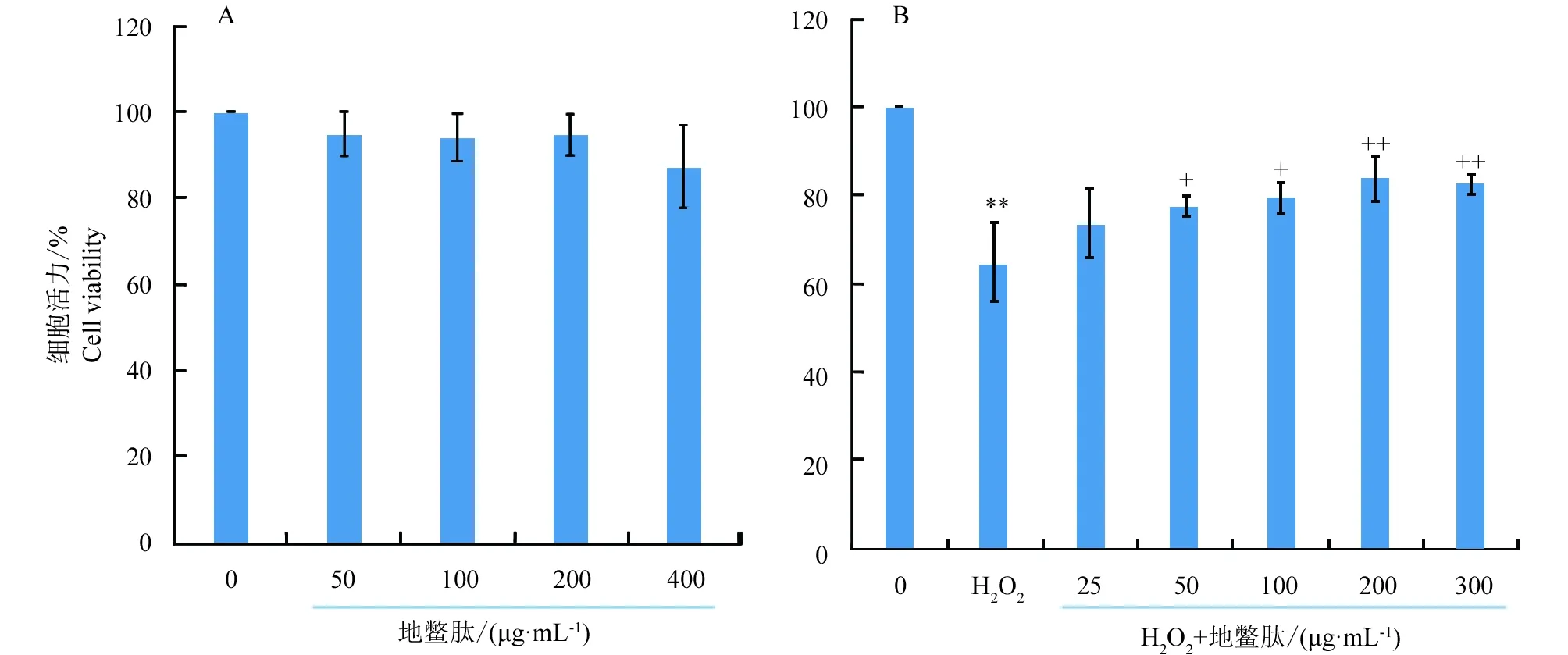
图4 地鳖肽对鸡卫星细胞活力的影响(与对照组相比**P<0.01;与H2O2组相比++P<0.01,+P<0.05)Fig.4 Effects of ESWP on the viability of chicken satellite cells viability (Compared with the control group, **P<0.01.Compared with H2O2 group, ++P<0.01, + P<0.05)
2.3 地鳖肽对H2O2刺激后肌卫星细胞增殖因子表达的影响
RT-PCR检测地鳖肽对H2O2刺激后肌卫星细胞增殖因子表达,结果与正常组相比,H2O2显著降低细胞中Pax7、Myf5和MyoD基因的相对表达量;与H2O2组相比,不同浓度地鳖肽预处理细胞可不同程度的促进增殖因子基因表达,其中低浓度地鳖肽显著增加Pax7和MyoD基因表达量,Myf5基因表达稍有增加,但不具有显著性差异;中浓度地鳖肽组细胞内基因表达均有显著提高,高浓度地鳖肽组MyoD基因表达量显著高于H2O2组(图5)。
3 讨 论
出生后骨骼肌组织中的成肌细胞是以肌卫星细胞的形式存在,肌卫星细胞是肌组织的前体细胞,在骨骼肌的生长、发育、损伤及移植中具有重要作用。已经报道有多种分离纯化骨骼肌卫星细胞的方法,包括肌组织块酶消化、直接分离单根肌纤维培养和根据细胞表面分子标志的流式细胞和免疫磁珠分选等[8, 9],本试验采用酶消化法获得肌卫星细胞。肌卫星细胞处于肌膜与基底膜之间,细胞连接紧密,普通的单种酶处理没有办法完全释放它,所以必须首先将基膜分解[10]。I型胶原酶可消化组织中连接部分使其成为单个细胞,之后再用胰蛋白酶使肌卫星细胞从肌纤维上充分解离,分离的肌卫星细胞中混有大量成纤维细胞,通过差速贴壁法对肌卫星细胞进行纯化[11, 12]。本试验采用两步酶消化法,三次差速贴壁后能获得阳性率在95%以上的肌卫星细胞(SCs)。
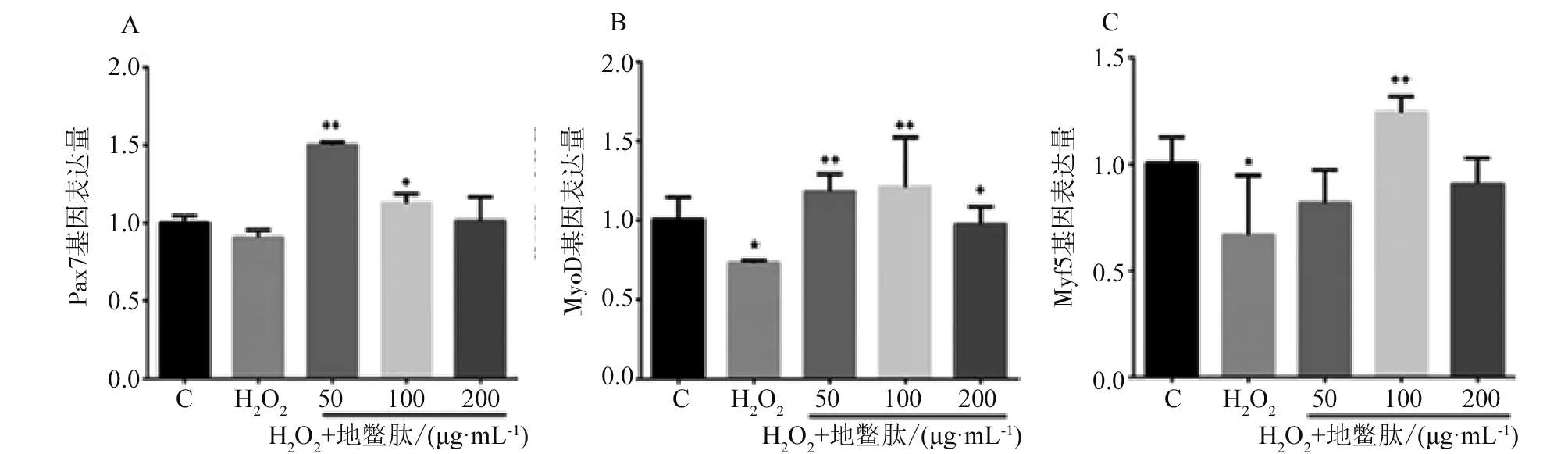
注:ABC分别为Pax7、MyoD和Myf5基因;与对照组相比**P<0.01;与H2O2组相比++P<0.01,+P<0.05。Note: A B CmeanPax7; MyoDand Myf5gene respectively; Compared with the control group, **P<0.01. Compared with H2O2 group, ++ P<0.01, + P<0.05.图5 地鳖肽对H2O2刺激肌卫星细胞增殖的影响Fig.5 Effect of ESWP on the proliferation of chicken satellite cells stimulated by H2O2
肌卫星细胞可以通过特殊的分子标记物来鉴定,标志性基因有Pax7、M-Cadherin、Desmin、MyoD等[13, 14]。本试验中选用Pax7单克隆抗体,用间接法对肌卫星细胞静息期和增殖期特异表达的标志蛋白Pax7进行细胞免疫化学染色,结果Pax7在胞核染色呈阳性,表明分离培养获得骨骼肌卫星细胞。MRFs家族是启动和维持骨骼肌卫星细胞分化、发育和生长的一个主要调控基因家族,在骨骼肌的生长、发育、损伤及修复中具有重要作用,Myf5和MyoD是肌细胞增殖期的标志,只在激活的肌卫星细胞中表达,能将多种类型细胞转化为成肌细胞,并调控MyoG促使成肌细胞融合为肌管[15]。Calor等对小鼠卫星细胞永生化得来的细胞株C1C12进行病理性缺氧处理,结果缺氧能显著抑制MyoD、Myf5和myogenin的表达,阻断细胞分化等生命进程[16]。本试验发现H2O2刺激会引起肌卫星细胞内Pax7、MyoD和Myf5基因表达的降低,地鳖肽的添加能缓解这一影响,促进受损细胞的增殖过程。
本研究通过两步酶消化法体外分离获得鸡骨骼肌卫星细胞(SCs),肌卫星细胞增殖期表达标志基因Pax7的阳性细胞率达95%以上。
