马钱子碱通过钾离子通道调节外周镇痛*
2019-02-22李永丰
李永丰 任 维
(陕西师范大学现代教学技术教育部重点实验室,西安 710062)
马钱子碱(Brucine,又名布鲁生)是一种弱碱性的吲哚类生物碱,其量大约占马钱子总生物碱的30%~40%[1,2]。研究马钱子碱的镇痛作用已经有200多年,王绚[3]发现马钱子总生物碱中发挥镇痛作用的主要成分是马钱子碱。马钱子碱既有中枢镇痛作用,也有外周镇痛作用[4],马钱子碱不产生身体依赖性,在镇痛方面应用马钱子碱比应用马钱子更为有利,但关于马钱子碱的镇痛作用机制仍然不清楚,缺乏深入研究,需要进一步阐明马钱子碱的镇痛机制,以便马钱子碱镇痛药物广泛应用。
谢益宽认为在CCI模型的轴突损伤区及胞体膜上大量堆积的钠、钾、钙等离子通道蛋白和受体形成起步点 (pacemaker) 使神经元产生自发电活动,是产生疼痛的基础[5],万有也提出损伤区大量胞体膜及多种离子通道的聚集造成膜功能重塑是产生异位放电以及疼痛的主要原因[6],其中钾离子通道(potassium channel) 与疼痛的产生密切相关[7],尤其是在损伤后的初级感觉神经元上钾离子通道的变化。钾离子通道广泛分布于神经、血管、血液等的细胞中,在调节细胞,尤其是神经细胞的膜电位和兴奋性中起重要作用,外周神经损伤后钾通道(Kv)表达的改变与慢性疼痛有关,Wells JE认为Kv1.4是唯一一个表达在小直径神经元上的Kv,是Aδ和C纤维兴奋性的决定因素,提出其对特异疼痛有良好的治疗效果[8,9],认为激活钾通道在疼痛的发生、发展中起着重要的作用[10,11],为探索马钱子碱在外周的镇痛作用是否与钾离子通道相关,本文展开以下研究。
方 法
1.实验方法
(1)慢性神经病理性疼痛模型的建立:选用健康的成年雄性SD大鼠50只,由西安交通大学实验动物中心提供,体重150~300 g,参照文献报道[12]的方法,建立慢性神经病理性疼痛模型:用戊巴比妥钠(40 mg/kg,i.p)腹腔注射进行麻醉后,暴露左侧坐骨神经主干,用鼠尾胶原纤维(约5#羊肠线直径)从坐骨神经中枢端到外周端依次轻度结扎打三个结,结扎环间0.15 mm, 结扎松紧程度以左后肢出现轻微收缩为宜,对坐骨神经形成区段性假手术;只暴露出坐骨神经不结扎,其余步骤和建模完全一致。
(2)机械缩足阈值测定 (PWT):术后第3、5、7、9、11、13、15、17、19、21 d以及给药前后进行测试,将大鼠放入底为铁丝网的不透明有机玻璃箱 (45 cm×20 cm×25 cm) 内,让大鼠在此环境适应 30 min,待大鼠的梳理和探究活动基本消失后,用Von Frey垂直刺激大鼠左后肢足底中部,持续加力,记录能引起左后肢产生缩足反应的力,重复2到3次[13]。
(3)热缩足潜伏期测定 (PWL):术后第3、5、7、9、11、13、15、17、19、21 d以及给药前后进行测试,将大鼠置于底为3 mm厚玻璃板的不透明有机玻璃箱 (45 cm×20 cm×25 cm) 中,使其适应30 min,待大鼠的梳理和探究活动基本消失后,热刺激痛觉测试仪照射大鼠左后肢足底中部(落在足底的光斑直径约为3 mm),记录从照射开始至大鼠出现抬腿回避时间即为TWL,照射时间不超过30 s,以防大鼠足底灼伤。每只大鼠测量3次,对侧间隔 5 min,去掉最大和最小值,计算3次TWL的平均值[14]。
(4)单纤维放电频率变化检测:手术后7~15 d,用乌拉坦腹腔注射麻醉手术后,再次将损伤区域暴露,去除结扎线、游离损伤区段的坐骨神经,用34~35℃正常灌流液浸浴损伤区域。在距离损伤区域约20 mm的中枢端处另行切口,可暴露出一段正常未受损伤的坐骨神经,再用34~35 ℃温热石蜡油浸浴正常区段的神经,在显微镜下分离出中枢端神经细束,切断它与中枢神经的联系,使其仅与损伤区域相连将分离出的神经细束放于铂金丝引导电极上,用Chart 5.5软件观察并记录神经细束的自发放电情况.计算神经传导速度以对神经纤维进行分类,速度大于2 m/s为A类神经元小于2 m/s为C类神经元[15],若出现了单个A纤维放电则进行记录保存。神经电活动信号可经power Lab系统放大、采集之后输入计算机系统,采样频率是10 kHz。顺序记录相邻动作电位峰峰间期时间间隔,获得神经自发放电峰峰间期(Inter-Spike Interval)序列,所得数据用origin软件分析并作相应的时间序列图等.实验中利用TEA、Brucine替换正常灌流液灌流损伤区分别记放电的频率变化.
2.药品、实验溶液
TEA,Brucine购于Sigma公司。正常灌流液:NaCl 150 mM 、KCl 5 mM、MgCl2mM、CaC121.2 mM、HEPES 10 mM。所用药物浓度:TAE 10 mM,Brucine 10 μM,以上药品溶于三蒸馏水后,用l mol/L的NaOH或者HCl调节pH至7.35-7.45。
3.统计处理
实验数据均以均数±标准误(±SEM)表示。采用SPSS 20.0处理,组间差异检验用单因素方差分析(One-Way ANOVA),重复测量方差分析(Repeated ANOVA)组间多重比较行LSD检验。P< 0.05为差异具有统计学意义,P< 0.01为具有显著性差异,P< 0.001为具有极显著性差异。
结 果
1.TEA阻断马钱子碱的镇痛作用
结果显示术后5、7、9、11、13、15、17、19、21 d,Sham和CCI组之间机械缩足阈值和热缩足潜伏期都表现出极显著性差异(P< 0.001,见图1 A, B),术后14 d 机械缩足阈值降至最低。术后第3 d Sham和CCI组之间大鼠机械缩足阈值出现显著性差异(F= 8.935,P= 0.011,P< 0.05, 见图1 A),而热缩足潜伏期无显著性差异(F= 2.237,P= 0.157,见图1B),提示CCI造模成功。在手术后的第13、14d在外周损伤区,进行局部注射TEA(10 mM)和马钱子碱(Brucine, 10 μM),观察到马钱子碱显著提高了机械缩足阈值(P= 0.005,P< 0.01,见图1 C)和热缩足潜伏期(P< 0.001, 见图1 D),提示其起到了显著的镇痛作用,并且其对于热痛敏的镇痛作用持续时间更长,但局部注射TEA之后再注射马钱子碱,可发现马钱子碱的镇痛作用消失(见图1 C, D)。
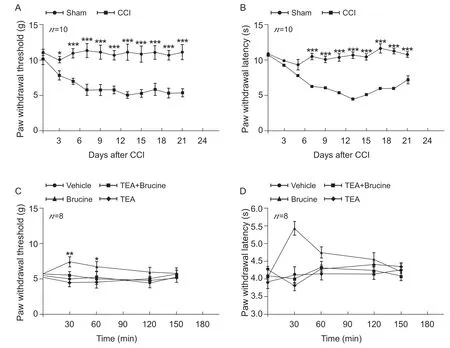
图1 大鼠在建立慢性神经病理性疼痛模型之后机械缩足阈值以及热缩足潜伏期的动态变化(±SEM)***P < 0.001,手术组与假手术组比较(A,B);观察在损伤区局部注射TEA、马钱子碱后机械缩足阈值(C)和热缩足潜伏期(D)在给药后30、60、90、120、150分钟后阈值的变化,***P < 0.001,**P < 0.01,*P < 0.05,马钱子碱组与溶剂组相比Fig.1 (A) Mechanical withdrawal threshold and (B) Thermal withdrawal latency of CCI group and Sham group (±SEM)***P < 0.001, compared with sham group.(C-D) Effects of brucine, TEA , TEA + Brucine on mechanical withdrawal threshold and thermal withdrawal latency test at 30, 60, 120, and 150 min after the administration.***P < 0.001,**P <0.01,*P < 0.05, Brucine vs.Vehicle.
2.马钱子碱能够显著地降低起步点自发放电的频率
在实验中分别选取3分钟稳定状态记录在再灌流槽中加入马钱子碱观察每分钟自发放电个数的变化,12例起步点自发放电的变化一致观察到马钱子碱能够显著地降低每秒自发放电的个数(n= 11,F(1,20) = 22.649,P< 0.001,见图2 A)。
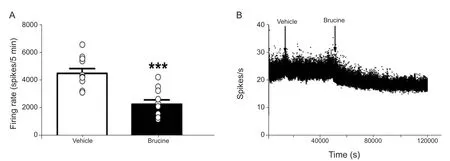
图2 马钱子碱诱发的损伤神经自发放电频率变化(A)马钱子碱(10 uM)能够显著地抑制自发放电的频率,***P < 0.001,与溶剂组比较;(B)马钱子碱抑制自发放电变化示意图Fig.2 (A) The injection of Brucine signif icantly suppressed the f iring rates of injured nerves***P < 0.001, compared with the vehicle group; (B)The Histogram show the suppression of ectopic f iring after application of 10 uM Brucine on one f iber.
3.TEA调节马钱子碱在起步点的作用
研究发现使用非特异性钾通道阻断剂四乙基铵(TEA)可以诱发损伤神经起步点呈现自发放电频率变化,并伴随节律的转迁,并且TEA与低钙诱发的转迁历程非常相似[16]。研究显示加入TEA灌流液之后自发放电的频率显著地升高(P= 0.016,P< 0.05,见图3 A),加入Brucine之后放电频率(P= 0.011,P< 0.05, 见图3A),没有显著性差异,表明ETA能够阻止Brucine使起步点放电频率降低,结果提示钾离子介导了Brucine在外周的镇痛作用。
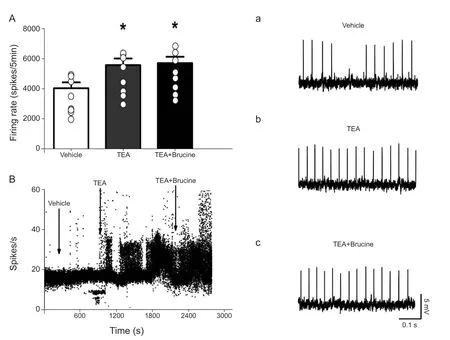
图3 (A)TEA使损伤区自发放电的频率增加,TEA抑制了Brucine使损伤区自发放电降低,*P < 0.05, 与溶剂组相比;(B)先后灌入 Vehicle , TEA, TEA+Brucine单根神经纤维放电频率的变化过程;(a-c)单根神经纤维在先后灌入Vehicle、TEA、ETA + Brucine后自发放电变化示意图Fig.3 (A) showing the increasing of ectopic f iring after TEA application.TEA inhibited Brucine' s reduction of spontaneous discharge.*P < 0.05, compared with the vehicle group.(B) The Histogram showed ectopic f iring after application of Vehicle,TEA, TEA + Brucine on one f iber.(a-c) Illustrates single-f iber recording from a representative f iber showing attenuation of f iring after TEA , TEA and Brucine application.
4.钙依赖激活钾离子在起步点自发放电中的作用
我们实验室以往研究发现钙激活钾通道参与损伤神经自发放电的调节[17],是受胞内游离钙离子调控的一种特殊离子通道,该通道按药理学性质及单通道电导大小的不同可分为:大电导钙激活钾离子通道(BKca)、中电导钙激活钾离子通道(IKca)和小电导钙激活钾离子通道(SKca)[18],其中BK通道分布于轴突、树突及突触末端,控制着神经元兴奋性并影响神经信号的传递[19];SK通道与动作电位后超级化电位(AHp)的产生相关,而AHp是决定神经元兴奋性的一个重要因素[20,21],猜测钙激活钾通道可能与神经源性疼痛发生有重要关系,因此本研究进一步探究钙激活钾通道的作用,当正常灌流换成含有钙离子鳌合剂EGTA (10 mmol/L)的无钙灌流液灌流损伤区时,主要阻断了钙通道,也抑制了钙依赖激活钾通道的作用,观察到放电节律发生了变化,并且放电频率显著增加(n= 4,P= 0.011,P< 0.05,见图 4 A),但当灌流EGTA + Brucine (10 μM/L)时,却显著的降低了放电频率(n= 4,P= 0.042,P< 0.05,见图4 A),加入EGTA + Brucine使放电频率降低至38.9%,但直接加入Brucine使放电频率降低至32.8% (见图1 A ),相比表明钙离子参与介导Brucine镇痛的调节,但不是主要的因素,说明钙依赖激活钾离子通道不是介导Brucine外周镇痛的主要机制。
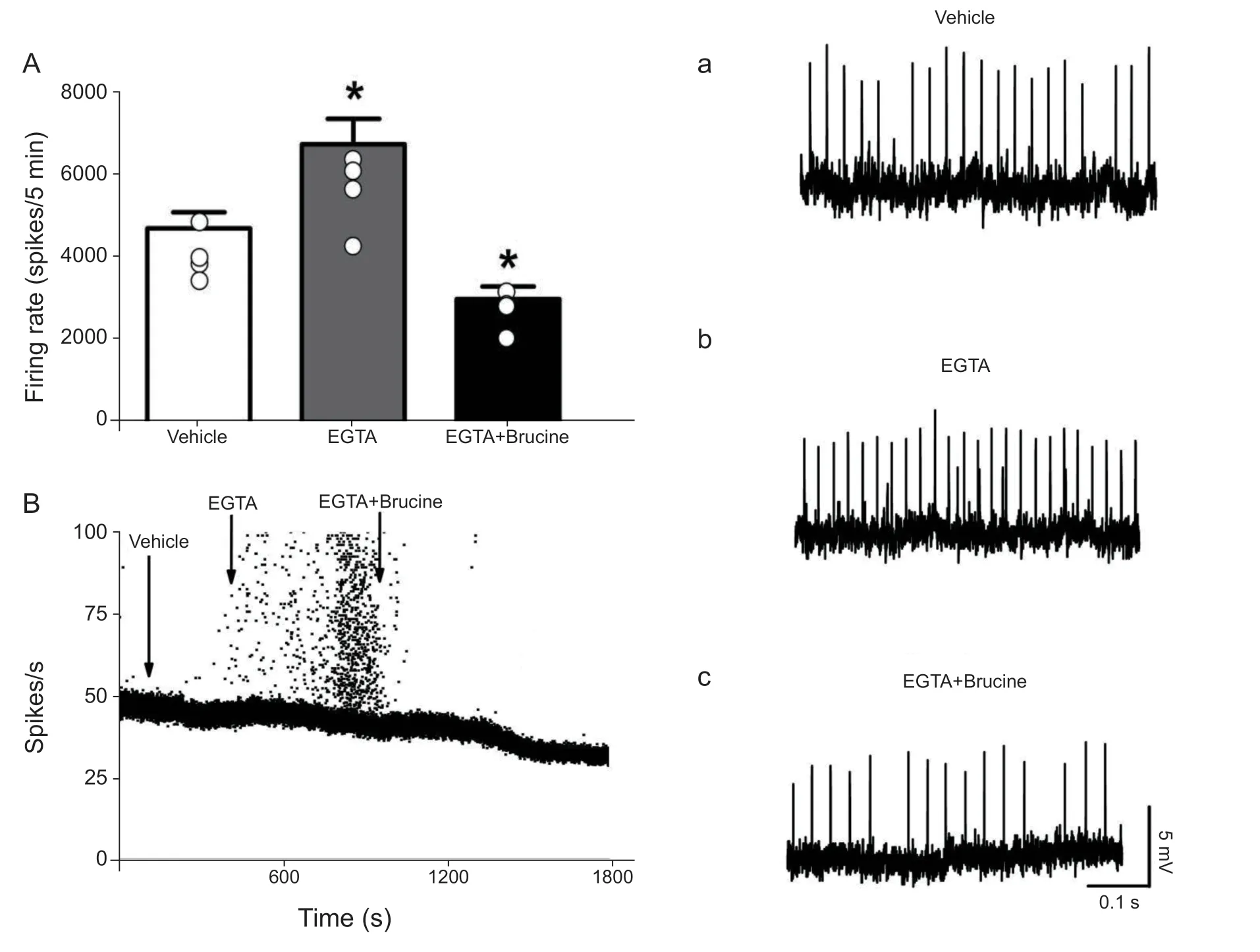
图4 (A)钙离子螯合剂EGTA显著增加损伤区起步点自发放电频率,但EGAT没有能够阻止马钱子碱降低损伤区自放电频率的作用。*P < 0.05,与溶剂组相比;(B)给予正常灌流液(Vehicle)时表现出周期1簇放电;加入EGTA灌流液时,放电节律由周期1变成了周期2或周期3;加入Brucine时放电节律转化为周期1,放电频率显著降低;(a)灌入Vehicle时放电节律为周期I;(b)灌入EGTA放电节律为周期I、周期II混合节律;(c)灌入EGTA+Brucine时放电节律为周期IFig.4 (A) The frequencies and f iring pattern trains induced by decreasing Ca2+ and Brucine in an experimental pacemaker;(B) The f iring pattern was changed from period 1 bursting to period 1 spiking after perfusing with EGTA.Brucine reduced f iring frequencies and changed f iring pattern, Vehicle vs EGTA *P < 0.05, Vehicle vs EGTA + Brucine *P < 0.05.a: period 1 bursting trains.b: period doubling bifurcation between period 1 and period 2.c: period 1 spiking trains in the experimental pacemaker; (a)The f iring pattern was period 1 when perfused into Vehicle; (b) The f iring pattern between period 1 and preiod 2 when perfused into EGTA; (c) The f iring pattern was period 1 when perfused into EGTA + Brucine.
讨 论
本文研究发现在外周损伤区,损伤部位定位注射马钱子碱,可以观察到明显的镇痛作用,与《本草纲目》、《得配本草》等书中记载中药马钱子具有散结消肿、镇痛的功效,并可开通经络、透达关节、镇痛力强等特点以及近年来研究发现的马钱子碱具有明显的镇痛作用[22,23]等结果一致,证明外周局部给予马钱子碱可以起到镇痛的作用。
观察到马钱子碱能够抑制外周损伤区异位放电,说明马钱子碱在外周的镇痛作用是通过抑制起步点自发放电产生的。CCI模型神经病理性疼痛是由外周神经损伤引起的,初级感觉神经元的兴奋性异常增高成为慢性痛的信号源。Wall等[24]利用分离坐骨神经单纤维细胞外记录的方法,发现在神经瘤模型大鼠坐骨神经上可以记录到电活动,当时人们即推测这种放电可能就是神经病理性痛的病理基础。单纯切断大鼠的背根或腹根均不引起疼痛反应,切断脊神经的动物则表现出对机械刺激和热刺激的敏感性增高,说明周围神经的损伤是引起神经病理性痛产生的重要因素。这些实验表明,受损神经的异位放电在动物的机械痛觉过敏、触诱发痛和持续性自发痛的产生和维持起重要的作用[25,26]。Han[27]等应用大鼠脊神经结扎模型对神经异位放电与动物痛行为的关系进行了研究。手术后一周,动物对机械刺激和冷刺激呈现痛敏反应,并且有持续性自发疼痛的表现,手术后10周,动物痛敏反应明显减轻,同时记录到产生自发放电的神经束降至50%,单纤维放电频率也明显降低。这种变化趋势说明异位自发放电与疼痛反应程度相关。Nystrom[28]等的研究显示,截肢病人的幻肢痛与在腓神经记录到的持续异位放电有关,敲击病人的截肢部分可引起剧烈的疼痛,同时初级传入纤维产生强烈的阵发放电,应用局部麻醉药可以抑制这种放电和减轻疼痛。
马钱子碱在外周损伤区通过抑制自发放电的频率起到镇痛作用,损伤区自发放电的形成主要与钾,钙,钠离子等密切相关,钾离子通道激活或关闭的状态对动作电位的出现、放电频率及放电节律有重要的影响作用。其中近年来钾离子通道受到了广泛的关注;任维的研究中,将不同浓度的钾离子通道阻隔剂TEA (2 mmol/l~10 mol/l)作用于呈周期放电的神经纤维上,观察到自发放电节律出现加周期的变化[29];段玉斌[30]的实验中观察钾离子浓度对损伤神经自发放电节律的变化有重要影响,且不同节律间可以相互转化,慢性疼痛状态下钾离子通道能够紧急抑制DRG (dorsal root ganglion, DRG)胞体或局部异位放电[31,32]等说明了疼痛的形成与钾离子通道密切相关,但钾离子通道依据其性质主要分为电压依赖钾离子通道(Voltage-gated K+channels, KV),Kv1.1功能丧失能够衰退热刺激和机械刺激敏感[33],Kv1.2表达减少导致机械和冷刺激阈值上升[34]在外周;钙依赖钾离子通道(Ca2+-activated K+channels,KCA),细胞内游离Ca2+能调控K+外流,影响动作电位的后超级化影响动作电位的形状,持续时间,并参与调节动作电位发放的频率在神经末梢[31],发现BK表达降低,SK表达不变在神经损伤后,因此暗示这些通道的开放能够缓解疼痛[35];串联孔域型钾离子通道(Two-pore K+channels, K2P)在感觉神经元上有15种超家族的K2P表达,在疼痛状态下酸敏感性钾离子通道表达降低[36],同时串联孔域型钾离子相关通道(two-pore weak inwardly rectifying K+related channel, TRESK)在神经轴突终末损伤后表达抑制能够减少C类纤维过渡兴奋和痛行为发生[37];内向性整流型钾离子通道(Inward rectif iers, Kir)中Kir2.1能够通过恢复DRG神经元的兴奋性治疗疼痛[38],同时G蛋白调节内向性整流型钾离子2型通道(G-protein-regulated inward rectif iers K+chan-nels,GIRK2)能通过类阿片调节外周镇痛[39]。暗示了钾离子通道的多种亚型参与了外周疼痛的形成或镇痛,坐骨神经损伤诱发起步点放电异常,马钱子碱能够使放电频率降低,而阻断非特异性钾离子通道能够抑制马钱子碱使起步点降低的作用,同时进一步研究是否钙激活钾离子通道介导这一过程,研究表明其虽然参与但并非主要介导,提示可能通过钾离子通道的其它亚型介导马钱子碱镇痛。
本研究在大鼠慢性压迫损伤模型基础上,外周损伤区定位给药,并用在体单纤维技术观察马钱子碱对 A 类神经元自发放电的影响,探讨马钱子碱在外周的镇痛作用,可能是通过钾离子通道起作用,为进一步深入的的研究马钱子碱的外周镇痛作用提供参考,同时也为马钱子碱在外周具有镇痛作用提供了依据,但是钾离子通道的亚型种类较多,具体主要是那种类型还需要进一步探究,相信随着对马钱子碱的深入研究,马钱子碱的外周镇痛机制将被进一步阐明,钾离子通道与马钱子碱镇痛的研究具有广阔前景。
