基于石灰石法脱硫浆液的K2S2O8氧化Hg0性能
2019-02-21
(中国矿业大学 环境与测绘学院,江苏 徐州,221116)
我国的能源格局长期以来一直以煤炭为主,煤炭的使用量居于世界首位。到2016年,中国原煤产量达34.1亿t,全国发电装机容量为164 575万kW,比上年末增长8.2%,其中火电装机容量105 388万kW,增长 5.3%[1]。预计到 2020年,全国发电装机容量将达到20亿kW,年均增长5.5%,这将进一步增加煤炭的消耗量和燃煤烟气污染物排放量,同时面临着国家和地方政府对燃煤烟气污染物排放标准的不断严格,特别是新增了对燃煤烟气Hg排放浓度的限值要求[2]。2013年我国“汞污染防治技术政策编制说明”(征求意见稿)数据显示,2007 年汞在大气中的排放量约为643 t,燃煤锅炉和燃煤电厂是最大的大气汞排放源,总计超过 50%[3]。因此,我国燃煤锅炉和燃煤电厂的Hg污染物的治理和减排对全国Hg排放总量的控制具有举足轻重的作用。针对我国现有大型燃煤电厂90%以上采用石灰石-石膏湿法脱硫的现状,利用现有脱硫设备实现烟气高效除汞是最为经济合理的途径[4-5]。大量试验结果表明:脱硫浆液虽然能够有效吸收烟气中Hg2+,却很难将Hg0氧化为Hg2+,且被吸收的Hg2+很容易被还原为Hg0再次释放到烟气中[6-9]。因钙基产物对Hg0氧化性能的影响课题组前期试验已有试验和结论[10],所以,本文作者利用前期试验筛选出的促进Hg0氧化性能最佳的氧化剂,着重考察氧化剂浓度、脱硫浆液pH、金属离子和烟气入口Hg0和SO2质量浓度对氧化除汞性能的影响,试验结果有助于利用现有石灰石-石膏湿法脱硫技术实现同时高效脱硫除汞[11]。
1 试验装置与方法
试验系统在原有汞液相氧化反应器基础上加以改进[12],底部增设鼓泡装置以强化气液接触和传质性能;为了满足气液有效接触时间保证充分反应,增加了反应器塔体高度,有效高度达到25 cm,反应器内径为12 cm;同时增设浆液补充和浆液排出系统,保证试验过程中反应器内浆液体积维持在1.5 L,且浆液pH维持稳定,也便于在反应过程中测试浆液组分变化,确保整个试验系统运行更为稳定可靠,试验系统如图1所示。
汞源主要由汞渗透管、U形管和恒温水浴加热 3部分组成,Hg0质量浓度通过调节恒温水浴温度和载气(N2)流量来实现。Hg0质量浓度采用美国利曼-徕伯斯公司的Hydra II AA 全自动测汞仪进行分析,仪器根据汞质量浓度(µg/m3)响应值自动生成标准曲线,试验要求相关度R2>0.999 9[13]。Hg0质量浓度通过改变水浴温度实现,试验所得水浴温度与Hg0释放质量浓度之间的关系如表1所示。

图1 基于石灰石-石膏湿法脱硫浆液的K2S2O8氧化Hg0试验系统示意图Fig.1 Schematic diagram of Hg0 oxidation by K2S2O8basing on limestone-gypsum desulfurization slurry

表1 Hg0释放质量浓度随水浴温度的变化关系Table 1 Relationship between mercury release concentration and water bath temperature
2 试验结果与分析
2.1 浆液pH对K2S2O8氧化Hg0性能的影响
在石灰石-石膏湿法脱硫系统运行过程中,浆液pH是影响烟气脱硫效率的关键因素之一,脱硫浆液pH在满足高效脱硫的同时,对Hg0氧化性能影响的研究有助于对现有脱硫系统参数进行调整和优化,同时实现高效脱硫除汞。基于前期研究基础和实际石灰石-石膏湿法脱硫系统pH运行范围,本阶段试验浆液pH设置在3.0~6.5之间,通过添加质量分数为5%的石灰石浆液调节pH;氧化剂K2S2O8浓度设定为5 mmol/L;为消除周围空气对水浴温度的干扰而影响汞渗透管释放速率,确保试验期间Hg0质量浓度的稳定,同时为了使试验结果更具可比性,Hg源温度设定为50 ℃,Hg源载气流量Q(N2)为1 L/min(下同),鼓泡反应器内浆液体积为1 L(下同),试验结果如图2所示。
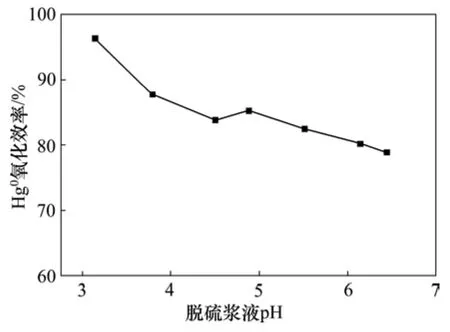
图2 脱硫浆液pH对Hg0氧化效率的影响Fig.2 Effect of desulfurization slurry pH on Hg0 removal efficiency
由图2可知:当浆液pH为3.14时,系统对Hg0氧化效率达到96.36%,随浆液pH的升高Hg0氧化效率呈下降趋势,当pH达到6.44时,Hg0氧化效率降至78.94%,为试验pH变化范围内氧化除汞效率的最低点。高pH条件下由于OH-的存在,降低了Hg2+转化为Hg(OH)+或Hg(OH)2的可能性,导致大量游离的Hg2+发生还原反应而再次释放到烟气中。低 pH条件Hg0氧化效率高的原因是 K2S2O8被 H+催化,与 H2O发生非对称反应,从而导致S=O的断裂,同时浆液还吸收了烟气中部分金属离子如Fe3+和Cu2+等,促使K2S2O8发生金属催化反应,生成一定浓度的 O2和H2O2,强化浆液的氧化性能,促进了Hg0的氧化,可能的反应方程式如下[14-15]。

通过脱硫浆液pH对Hg0氧化性能试验结果的分析,结合实际火电机组石灰石-石膏湿法脱硫系统运行的 pH运行范围,为实现同时高效脱硫除汞,可将pH控制在5.0左右,Hg0氧化效率可稳定在83%以上。后续试验将脱硫浆液pH均设定在5.0左右。
2.2 K2S2O8浓度对Hg0氧化性能的影响
为考察不同K2S2O8浓度对系统Hg0氧化性能的影响,以及系统运行的稳定性,结合前期试验结论,将试验汞源温度定为50 ℃,反应温度为室温(10 ℃,冬季)。因 K2S2O8在常温下较为稳定、初始反应缓慢,故在反应进行10 min后开始采样,不同浓度K2S2O8下的Hg0氧化效率如图3所示。

图3 不同浓度K2S2O8条件下反应时间对Hg0氧化效率的影响Fig.3 Effect of reaction time on mercury oxidation efficiency with different K2S2O8concentrations
由图3可知:当K2S2O8浓度为0.5 mmol/L时,Hg0氧化效率随反应时间的延长逐渐降低,在反应至70 min处开始出现小幅上升,上升的原因可能是反应产物对汞发生快速吸附作用[16];反应100 min后Hg0氧化效率快速降低,反应至130 min时,Hg0氧化效率仅为12%。当初始K2S2O8浓度分别为1 mmol/L和3 mmol/L时,Hg0氧化效率分别由反应 10 min时的90.82%和94.04%下降到反应130 min时的44.28%和57.70%,下降幅度分别为51.24%和38.64%;当初始K2S2O8浓度到达 5 mmol/L时,Hg0氧化效率由反应10 min时的93.68%减小到反应130 min时的93.39%,仅降低了 0.29%,反应随时间变化较为稳定。同时在反应时间t为100 min处,出现了试验阶段Hg0氧化效率最高点97.48%,在试验时间内,Hg0氧化效率均在90%以上,并呈现很好的运行稳定性。经综合考虑,后续试验除金属离子强化K2S2O8氧化Hg0试验以外,K2S2O8浓度均设定为5 mmol/L。
2.3 金属离子强化K2S2O8氧化Hg0性能的影响
脱硫浆液中金属离子(Fe3+,Mn2+,Ag+,Co2+和Mg2+)的存在能够催化K2S2O8产生比•OH氧化性更强的。金属离子催化K2S2O8生成的可快速将Hg0氧化为Hg2+进入脱硫浆液。结合实际石灰石-石膏湿法脱硫浆液中金属离子的浓度范围和诸多文献研究结论,以及提高各组试验效果的可对比性,基于前期研究结论,本研究设定Mn2+,Ag+和Co2+的浓度均为0.05 mol/L,Mg2+和Fe3+的浓度范围在0.5~5.0 mmol/L之间。试验先考察Mn2+,Ag+和Co2+3种金属离子的存在对K2S2O8氧化Hg0性能的影响。
2.3.1 Mn2+,Ag+和 Co2+对 K2S2O8氧化 Hg0性能的影响
本阶段试验汞源温度仍为50 ℃,为使反应结果更具可比性,3种金属离子分别与3 mmol/L K2S2O8进行组合,Hg0氧化效果则分别与3 mmol/L和5 mmol/L K2S2O8氧化效果进行比较,其他试验参数设置同上,试验结果如图4所示。

图4 Mn2+,Ag+和Co2+对K2S2O8氧化Hg0性能的影响Fig.4 Effect of Mn2+,Ag+ and Co2+ on mercury oxidation efficiency by K2S2O8
由图4可知:脱硫浆液中Mn2+,Ag+和Co2+的存在不仅可以提高K2S2O8氧化Hg0性能,还能增加系统稳定性。初始K2S2O8浓度为3 mmol/L、反应进行至70 min时,Hg0氧化效率明显下降;当浆液中分别加入一定浓度的金属离子催化剂(c(Ag+)=0.05 mol/L、c(Co2+)=0.05 mol/L或c(Mn2+)=0.05 mol/L)时,在整个试验时间内,系统都维持高效Hg0氧化状态,但相互间差异不大。这是因为金属离子的加入降低了K2S2O8氧化 Hg0反应的能垒,使在冷态环境下较为稳定的K2S2O8受到激发,短时间内增加了浆液中处于活化状态的 K2S2O8浓度,同时等自由基的生成加快了反应进程。以Ag+为例,可能的反应机理如下[17]。

虽然加入金属离子能够提升系统氧化Hg0性能,但适量提高浆液中K2S2O8浓度(5 mmol/L)也能达到同等效果,系统氧化Hg0效率维持在89%以上,还可抑制Hg2+的还原[18]。且浆液中加入的金属离子会随反应进行最终进入脱硫副产物石膏中,延长石膏晶体诱导时间,抑制了石膏结晶,影响石膏晶体的形态,降低了石膏脱水性能[19]。
2.3.2 Mg2+和Fe3+对K2S2O8氧化Hg0性能的影响
石灰石-石膏湿法脱硫系统在实际运行过程中,往往会在脱硫浆液中加入一定浓度的 Mg2+以促进石灰石的溶解,提高系统脱硫能力。同时脱硫浆液中含有少量的Fe3+,Fe2+甚至Fe,在采用强制氧化技术或者加入汞氧化剂时,浆液中Fe2+或Fe会氧化为Fe3+。试验分别考察浆液中 Mg2+和 Fe3+对 K2S2O8氧化 Hg0性能的影响,试验条件与2.3.1一致,试验结果如图5所示。

图5 Mg2+和Fe3+对K2S2O8氧化Hg0性能的影响Fig.5 Effect of Mg2+ and Fe3+ on mercury oxidation efficiency by K2S2O8
由图5可知:与图2所示仅含K2S2O8(5 mmol/L)浆液的Hg0氧化效率相比,随浆液中Mg2+的加入Hg0氧化效率有所降低。浆液中 Mg2+浓度由 0.83 mmol/L(即 100 mg/L)增加到 1.67 mmol/L(即200 mg/L)时,Hg0氧化效率由 92.75%降至 86.46%,降幅达到6.29%。其原因是Mg2+与亚硫酸根形成中性离子对,能有效降低液相游离态的活性浓度。低浓度的活性与Hg结合生成HgSO3,HgSO3的稳定性远低于的稳定性,即HgSO3的Hg0释放速度明显比的高。因此,浆液中 Hg0释放速度随着浆液中浓度的减低而升高[6]。
在 K2S2O8+Fe3+系统中,随浆液中 Fe3+浓度的增加,系统氧化Hg0性能得到提升,并维持高于94%的Hg0氧化效率。浆液中Fe3+浓度由0.5 mmol/L(即100 mg/L)增至 1.0 mmol/L(即 200 mg/L),Hg0氧化效率由90.47%提升至95.65%,继续增加浆液中Fe3+浓度效率趋于稳定,这主要是因为Fe3+的加入,对Hg2+还原产生抑制作用,当浆液中Fe3+浓度增加到1.0 mmol/L时,浆液中 Hg2+还原性能已经得到有效抑制,继续增加Fe3+浓度,对 Hg2+还原性能抑制并不明显,系统氧化Hg0效率较为稳定。当浆液中 Fe3+浓度增至 2.0 mmol/L(400 mg/L)以上时,Hg0氧化效率再次呈现上升趋势,其原因主要是浆液中高浓度的Fe3+和亚硫酸根不能大量共存,会发生离子间的氧化还原反应, Fe3+将氧化成,反应方程式为

从反应方程式(7)可以看出:高浓度的Fe3+与反应后浆液中浓度降低,系统的pH也不断降低,导致浆液浓度比降低,抑制了 Hg0的释放速率,从而提高了系统的Hg0氧化性能[7]。
2.4 Hg0和 SO2质量浓度对 K2S2O8氧化 Hg0性能的影响
实际烟气组分较为复杂,主要包括未被捕集的飞灰、NOx、O2、重金属和 SO2等。在实际工程运行期间,Hg0和SO2的质量浓度变化范围较大,Hg0和SO2的存在相互之间都会产生影响[20-22]。本阶段考察不同质量浓度Hg0和SO2对氧化性能的影响。当试验汞源温度分别为30,50和60 ℃(相应的入口Hg0释放质量浓度见表1),入口SO2质量浓度在100~1 600 mg/m3之间,液气比为17 L/m3,空塔风速v为0.275 m/s时,试验结果如图6所示。

图6 3种Hg0质量浓度条件下入口SO2质量浓度对Hg0氧化效率的影响Fig.6 Effect of SO2mass concentration on mercury oxidation efficiency with three Hg0 mass concentrations
由图6可知:当汞源温度为30 ℃时,随入口SO2质量浓度的增加,Hg0氧化效率先递增后逐渐下降,Hg0氧化效率最高可达85.57%,与试验范围内最低效率相比仅降低6.11%。汞源温度为50 ℃和60 ℃时,SO2质量浓度变化对 Hg0氧化效率的影响类似。SO2质量浓度较低(小于1 428 mg/m3)时,随SO2质量浓度的增加,系统氧化Hg0效率得到小幅提升,其原因是SO2质量浓度的不断提高,增加了脱硫浆液中浓度,促进了HgSO3向的转化,与HgSO3相比,更稳定,分解释放 Hg0的速度要慢得多[7]。继续增加 SO2质量浓度,系统氧化 Hg0效率出现缓慢下降,表明脱硫浆液中过量的SO32-浓度对Hg0氧化已无明显促进作用。从图6还可知:3种汞源温度条件下Hg0氧化效率变化并不明显,其可能的原因是5 mmol/L的K2S2O8氧化Hg0能力最佳,且该浓度条件下的浆液氧化Hg0容量远远高于试验期间进入浆液中被氧化的Hg0总量。由此得出结论,试验条件所设定 3种不同质量浓度 Hg0烟气对 K2S2O8氧化 Hg0性能无明显影响,SO2的存在提高了脱硫浆液中K2S2O8氧化Hg0的稳定性。
3 结论
1) 低pH脱硫浆液有利于K2S2O8高效氧化Hg0,Hg0氧化效率最高可达96.36%,并随浆液pH的升高呈下降趋势。浆液pH在5.0左右时,Hg0氧化效率虽有所降低,但仍能维持在83%以上。
2) 当K2S2O8浓度为0.5,1.0和3.0 mmol/L时,Hg0氧化效率变化幅度较大,最高可达 50%以上。当K2S2O8浓度为5 mmol/L时,Hg0氧化性能较稳定,氧化效率均维持在90%以上。
3) 浆液中 Mn2+,Ag+或 Co2+的存在可提高系统Hg0氧化性能和系统稳定性,但三者间差异不大,适量提高浆液中 K2S2O8浓度也能达到同等效果;Mg2+的加入,系统 Hg0氧化性能反而有所降低。Hg0氧化效率随Fe3+浓度的增加呈先增加后趋于稳定,当Fe3+浓度增至2.0 mmol/L以上时,Hg0氧化效率再次增加。
4) 试验条件下不同质量浓度 Hg0烟气对 K2S2O8氧化Hg0性能无明显影响;随入口烟气SO2质量浓度的增加,Hg0氧化效率先增加后逐渐下降,Hg0氧化效率最高可达 85.57%,SO2的存在可提高脱硫浆液中K2S2O8氧化Hg0的稳定性。
5) 利用 K2S2O8氧化 Hg0具有较高的氧化效果,且运行较为稳定。在实际应用中,若浆液成分较为简单,浆液中还原性成分偏少,对浆液中其他成分的存在形式变化无特殊要求,则该方法的应用价值较高。若浆液中存在较高浓度的还原性成分,则会额外消耗氧化剂用量,且会与Hg0存在竞争影响。若应用环境对浆液中还原性成分的存在形式或浓度有特殊要求时,则在使用过程中需考虑K2S2O8氧化所带来的影响。
