Ca(H2PO4)2-H3PO4-H2O 体系的相平衡过程研究
2019-02-19谢晨光唐盛伟王辛龙钟本和
谢晨光,唐盛伟,王辛龙,钟本和,张 涛
(四川大学化学工程学院,四川 成都 610065)
磷酸二氢钙[Ca(H2PO4)2]是磷酸钙盐中磷含量较高的一种化合物[1]。磷酸二氢钙因其具备质量轻、化学稳定、与骨骼矿物相类似的优点,在医药行业用作骨移植材料。在饲料和食品行业,因为磷酸二氢钙中的钙和磷均易被吸收,并且生物效价高,因此可以用作饲料添加剂、食品添加剂等。 在化工行业,磷酸二氢钙可以作为原材料,生产其他磷酸盐,如焦磷酸盐、聚磷酸盐;也可以作为乳化剂、稳定剂等。 目前, 制备饲料级磷酸二氢钙的工艺主要为湿法和干法[2]。但在这些工艺中,磷矿中的钙资源以磷石膏的形式被作为废弃物排放, 造成一定的环境污染。 同时, 制备磷酸二氢钙所需要钙源又来自开采的碳酸钙资源,造成资源的浪费和生产成本升高[3]。 直接使用磷酸与磷矿石反应,反应产物可为CaHPO4、Ca(H2PO4)2·H2O 及其水合物[反应式(1)~(3)]。 只需要通过控制合适的反应条件和结晶分离条件, 就可以从反应液中分离出磷酸二氢钙产品。 反应产物在反应液中的存在形态以及如何从反应液中分离出目标产物磷酸二氢钙产品是该生产过程的关键。
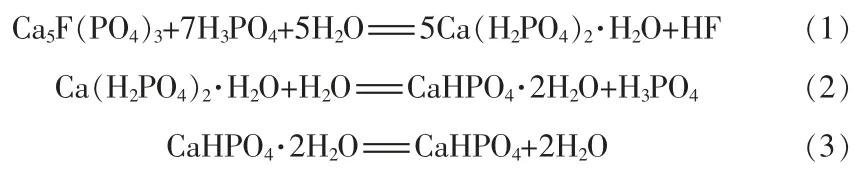
磷酸二氢钙在磷酸水溶液中存在Ca(H2PO4)2和Ca(H2PO4)2·H2O 两种形态[4]。 同时,也可能发生式(2)和(3)的水解反应。为了从Ca(H2PO4)-H3PO4-H2O 体系中分离结晶出一定结晶形态的磷酸二氢钙,就需要了解该体系中各组分的平衡组成。 因此,有必要研究和掌握磷酸二氢钙在磷酸溶液中的相平衡行为, 目前已有部分文献涉及CaO-P2O5-H2O相图[5-6]。但相关结果仍然不能完全提供前述拟开发生产工艺所需要的相平衡信息。 笔者以一水磷酸二氢钙和磷酸为原料,系统研究磷酸二氢钙在磷酸溶液中的溶解平衡行为,并用电解质NRTL(E-NRTL)模型对实验数据做了拟合,为磷酸二氢钙的结晶与分离提供基础数据。
1 实验部分
1.1 试剂与仪器
试剂:在本实验中使用水均为超纯水(电导率≤1×10-4S/m)。 一水磷酸二氢钙(纯度≥98%,天津光复试剂厂)、磷酸(纯度≥85%,成都科龙化工试剂厂)、乙醇(纯度≥99.7%,成都科龙化工试剂厂)。
仪器:CY50A 型循环水浴槽(使用精度为±0.01℃)、FA2004B 型电子天平(使用精度为±0.0001g)、DX2700 型X 射线衍射仪。
1.2 实验方法
采用静态法测定一水磷酸二氢钙在不同浓度磷酸溶液中的溶解度[7]。 首先确定平衡所需的时间。 测定恒定温度下相同组成的溶液经过不同平衡时间的液相平衡组成,发现经过24 h 后平衡液相组成不再随时间变化, 即体系在24 h 即可达到平衡。为了确保体系的每一个点都达到固液平衡,实验过程中控制的平衡时间为48 h。
相平衡研究的步骤:一定质量的一水磷酸二氢钙和磷酸溶液加入带有机械搅拌的250 mL 三口烧瓶中,三口烧瓶置于温度恒定的水浴槽中,控温精度为±0.01 ℃。使用精度为±0.1 ℃的水银温度计测定烧瓶内的温度。 整个实验过程中,保持三口烧瓶处于密闭状态, 以确保在实验过程中物料组成恒定。在恒温条件下搅拌48 h 后停止搅拌, 静置12 h 以使固液分层。 取一定质量的上清液,稀释后分析液相组成。 过滤体系平衡时的固相,并使用乙醇洗涤至无残留磷酸, 在对应相平衡温度下烘干, 随后做XRD 分析。 饱和溶液中,各物质的质量计算公式:

式 中,wA、wB分 别 代 表 体 系 中P2O5和CaO 质 量 分数,%;mA为取样溶液中P2O5的质量,g;mB为取样溶液中CaO 的质量,g;m总为称量总质量,g。
1.3 分析测试方法
每个平衡液相至少测定3 次。 溶液中总P2O5质量分数采用磷钼酸喹啉重量法测定[8-9],不确定度为0.003 2[10]。 溶液中Ca 质量分数是以铬黑T 为指示剂,使用乙二胺四乙酸二钠(EDTA)络合滴定法测定[11],不确定度为0.002 9[12]。 体系中水的质量分数使用差减法计算。
2 实验结果与讨论
2.1 磷酸二氢钙在磷酸水溶液中的相平衡行为
使用静态法测定了40~80 ℃条件下一水磷酸二氢钙在磷酸溶液中的相平衡过程。其中,P2O5和CaO均以质量分数表示。所有平衡固相经洗涤、干燥处理后进行XRD 表征,结果见图1。 由图1 可见,在研究的P2O5-CaO-H2O 体系相平衡中,加入的Ca(H2PO4)2·H2O 会出现转换,呈现出不同的固相结晶。从图1 还可见,在相同温度下,随着磷酸浓度的增大,可分别结晶出不同固相:CaHPO4、CaHPO4+Ca(H2PO4)2·H2O、Ca(H2PO4)2·H2O 等。
由图1 可见,一定温度条件下,Ca(H2PO4)2·H2O在不同浓度磷酸溶液中表现出不同的相平衡特性及固相析出特性。 随着磷酸溶度的增大,XRD 谱图中表现出3 个阶段的平衡特性:第一阶段是当P2O5质量分数为3.97%~12.93%时,Ca(H2PO4)2·H2O 全部水解为CaHPO4, 平衡固相为CaHPO4; 第二阶段是当P2O5质量分数为12.93%~25.34%(不包含两端端点)时,Ca(H2PO4)2·H2O 部分水解成为CaHPO4,平衡固相为CaHPO4和Ca(H2PO4)2·H2O 的混合物;第三阶段,当P2O5质量分数为25.34%~49.61%时,平衡固相为Ca(H2PO4)2·H2O。 相平衡数据结合XRD 结果显示,在50、60、70、80 ℃时,Ca(H2PO4)2·H2O 水解时的P2O5浓度与40 ℃时的不同, 但是均存在类似于40 ℃条件下Ca(H2PO4)2·H2O 水解的3 个阶段。在本研究中的所有温度下, 磷酸二氢钙的溶解行为随磷酸浓度变化趋势是相同的。 以40 ℃为例,磷酸浓度增大,水解部分逐渐减少,最终完全消失。
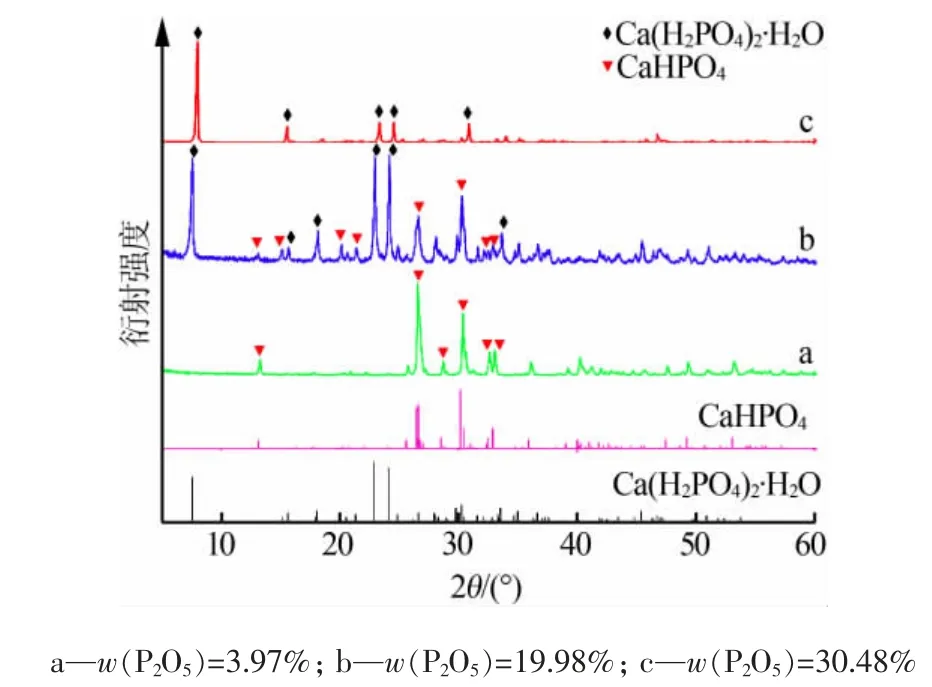
图1 40 ℃下一水磷酸二氢钙相平衡过程XRD 谱图
根据实验数据可以得到体系的三元相图, 结果如图2 所示。 由图2 可以看出,以40 ℃为例,曲线ad代表CaHPO4在磷酸水溶液中液相平衡线; 曲线de(不包含点d和e)代表CaHPO4和Ca(H2PO4)2·H2O共存时在磷酸溶液的液相平衡线;曲线ef代表Ca(H2PO4)2·H2O 在磷酸溶液中的液相平衡线。 区域adD为CaHPO4的结晶区,区域dDMe(不包含点d和e)为CaHPO4和Ca(H2PO4)2·H2O 的共结晶区,区域efM为Ca (H2PO4)2·H2O 的结晶区。 在相平衡体系中,存在仅有CaHPO4和仅有Ca(H2PO4)2·H2O 在磷酸水溶液中达到固液平衡的过程, 因此可以得到CaHPO4和Ca(H2PO4)2·H2O 磷酸溶液中溶解度变化趋势。一定温度下,随着磷酸浓度的升高,CaHPO4溶解度增大,而Ca(H2PO4)2·H2O 溶解度减小。 在一定磷酸浓度时,随着温度的升高,CaHPO4溶解度减小,而Ca(H2PO4)2·H2O 溶解度增大。 随着温度的升高,Ca(H2PO4)2·H2O 水解程度逐渐增大。

图2 40 ℃时CaO-P2O5-H2O 的相平衡图
2.2 实验数据拟合
为了进一步掌握无水磷酸氢钙和磷酸二氢钙在磷酸溶液中的热力学性质及相平衡行为, 需要建立合适的热力学模型。 溶度积常数经常用于计算固液平衡时物质的溶解度, 通过活度系数和溶液离子物质的量分数定义的溶度积(KS):
式中,a、ν、γ、x分别代表活度、 电解质化学计量系数、活度系数和盐在溶液中的物质的量分数;上下标中的+和-分别代表阳离子和阴离子。
在本实验中,采用E-NRTL 模型计算离子活度系数, 该模型可用于整个电解质浓度范围内描述电解质水溶液以及混合溶剂电解质系统[13]。 该模型是基于同类离子排斥和局部电中性的假设, 基于超额吉布斯能的模型:
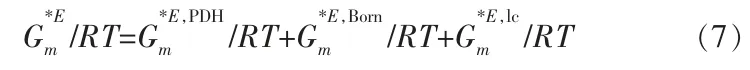
式 中,非 对 称 的Pitzer-Debye-Hückel(PDH)项 和Born 项表示离子之间的长程交互作用,Born 项用来描述离子的参考态从无限稀释混合溶剂溶液到水溶液无限稀释的离子的Gibbs 能的转换。 lc 项代表局部交互作用,以Non-Random Two Liquid(NRTL)理论表示。 由式(7)得出:

其中,使用Pitzer-Debye-Hückel 表示长程相互作用:

Born 项表达形式:
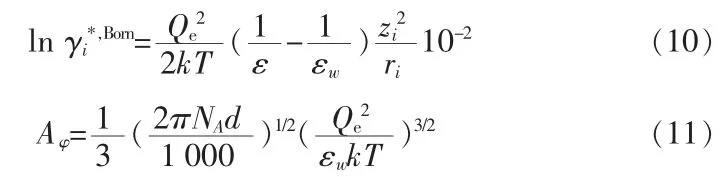
式 中,MS为 溶 剂S的 分 子 量,g/ mol;Aφ为Debye-Hückel 参数,kg1/2/mol1/2;zi为离子i的价数;ρ 是与离子最近距离有关的常数;Ix为离子强度;NA为阿伏伽德罗常数,mol-1;d为溶剂密度,kg/m3;Qe为电子电荷,C;εw为水的绝缘常数,F/m;k为玻尔兹曼常数,J/K。
对于多组分系统,局部交互作用可按下式表示:
阳离子的活度系数方程:
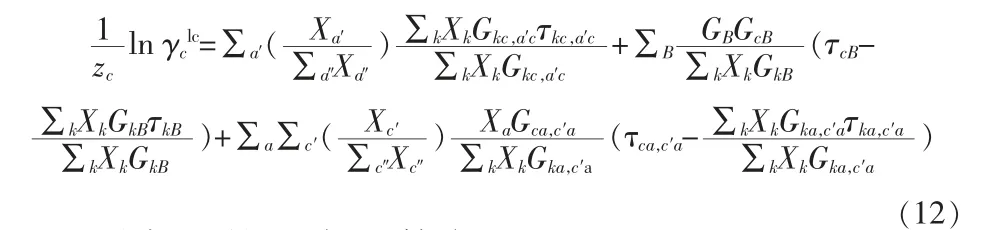
阴离子的活度系数方程:
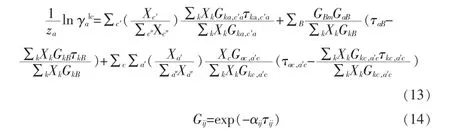

式中,Xj=xjCj(对于离子,Cj=zi; 对于分子,Cj=1),τ为二元作用参数,以温度函数表示,可表示为下式:

式中,aij和bij为各组分间的交互作用参数, 可通过拟合实验数据得到。
使用E-NRTL 模型,分别对仅CaHPO4和Ca(H2PO4)2·H2O 在磷酸溶液中相平衡数据进行拟合,获得相关模型参数如表1 所示。为了比较模型的准确性, 将实验结果与由该模型计算的结果进行比较,如图3 所示。 由图3 可得出,E-NRTL 模型可以较好地模拟CaHPO4和Ca(H2PO4)2·H2O 在磷酸溶液中的相平衡数据。 该模型可以用于计算无水磷酸氢钙和一水磷酸二氢钙在磷酸溶液中的溶解度,从而为工艺开发提供相应的基础数据。
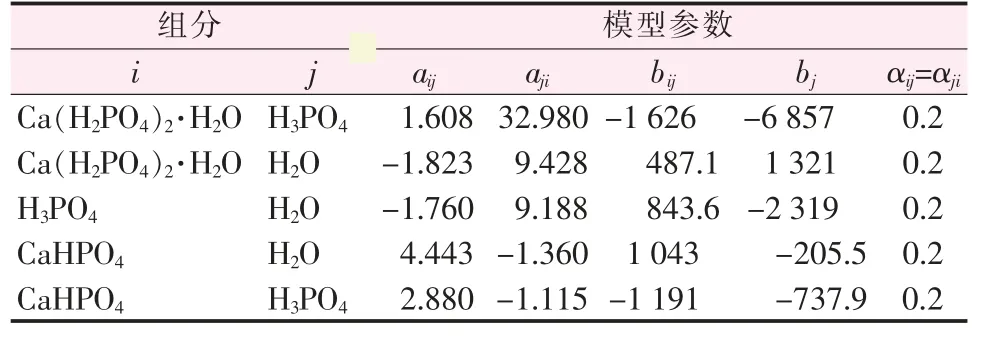
表1 Ca(H2PO4)2-H3PO4-H2O 相平衡中E-NRTL 模型参数

图3 平衡固相仅为CaHPO4(a)和Ca(H2PO4)2·H2O(b)相平衡数据实验值与理论值对比图
3 结论
采用静态法测定了Ca(H2PO4)2·H2O 在磷酸溶液中的相平衡行为。研究发现,在不同条件下存在不同的结晶固相,分别为CaHPO4、CaHPO4+Ca(H2PO4)2·H2O、Ca(H2PO4)2·H2O。 在同一温度条件下,随磷酸浓度的增大,Ca(H2PO4)2·H2O 在磷酸溶液中的相平衡过程呈现出3 个阶段。首先是Ca(H2PO4)2·H2O 全部水解成为CaHPO4;其次为Ca(H2PO4)2·H2O 部分水解, 平衡固相为一水磷酸二氢钙和无水磷酸氢钙共存;第三阶段是Ca(H2PO4)2·H2O 全部不水解。 通过E-NRTL 模型可以很好地计算CaHPO4和Ca(H2PO4)2·H2O 在磷酸溶液中的相平衡数据, 该模型可以为新工艺的发展提供数据和理论基础。
