枸杞总黄酮提取工艺优化及其体外抗氧化活性分析
2019-02-18李越鲲梁晓婕闫亚美
禄 璐,米 佳,罗 青,李越鲲,梁晓婕,闫亚美
(宁夏农林科学院枸杞工程技术研究所,宁夏银川 750002)
黄果枸杞是近年来新发掘的枸杞品种,属于宁夏枸杞的变种[1],果实呈黄色,酸甜可口,含氨基酸、多糖、类胡萝卜素、多酚等多种营养及功效成分,目前主要集中在宁夏地区示范推广种植[2-3]。
黄酮是一类重要的天然有机化合物,结构复杂多样,具有很强的药理作用。大量研究表明,黄酮类化合物具有较强的抗氧化作用,可广泛影响心血管系统、免疫系统和消化系统[4-7],对保护肝损伤亦有显著疗效[8]。黄果枸杞富含黄酮类化合物,如芦丁、柚皮素、香叶木素、儿茶素、表儿茶素、槲皮素、山奈酚、柚皮素-7-O-葡萄糖苷等。一般提取黄酮的方法有水提法、醇提法、超声波/微波辅助提取法、亚临界乙醇提取法、生物酶提取法等等[9-11],通过对溶剂的选择、提取水温、提取时间的调控与优化,提高黄酮得率[12-14]。但目前由于黄果枸杞尚未形成规模化种植和管理,因此,黄果枸杞的诸多基础研究,如功效成分的提取与鉴定、功效评价等方面的工作还未开展。
本研究基于黄果枸杞中丰富的黄酮物质,采用响应面方法优化黄酮提取工艺,并对不同种质枸杞黄酮提取物进行体外抗氧化活性测定分析,以期为枸杞的基础研究及资源的开发利用提供科学依据和理论支撑。
1 材料与方法
1.1 材料与仪器
黄果枸杞(“宁农杞4号”、“宁农杞5号”、“宁夏黄果”)、红果枸杞(“宁杞1号”)、黑果枸杞 国家枸杞工程技术研究中心种质资源圃(宁夏,银川),经国家枸杞工程技术研究中心种质资源室鉴定。取样时,随机摘取枸杞树不同位置的果实,果实八成熟,并保持成熟度相对一致,采后迅速置于-80 ℃超低温冰箱速冻备用;维生素C、没食子酸、芦丁标准品 成都曼思特生物科技有限公司;无水乙醇、亚硝酸钠、硝酸铝、福林酚、丙酮、浓盐酸、醋酸钠、冰乙酸、过硫酸钾、ABTS、DPPH、甲醇、三吡啶三吖嗪(TPTZ)等 均为国产分析纯。
BS224S分析天平 德国赛多利斯公司;TU1810紫外可见分光光度计 北京普析通用仪器有限责任公司;恒温水浴锅 北京长源实验设备厂;SHZ-D(Ⅲ)循环水式多用真空泵 天津华鑫仪器厂;全数字超声波发生器 武汉嘉鹏电子有限公司;Centrifuge 5810 R冷冻型台式大容量高速离心机 德国艾本德公司。
1.2 实验方法
1.2.1 黄果枸杞黄酮提取工艺优化 以“宁农杞5号”黄果枸杞作为优化提取黄酮工艺的试验材料。称取超低温速冻的黄果枸杞3.0 g于研钵中,迅速研磨至果泥状,转入烧杯中,加入一定浓度、一定体积倍数的乙醇溶液溶解,搅拌混合均匀后在一定的水浴温度下加热一定时间,再置于300 W超声波下辅助提取30 min,冷却后,3000 r/min离心5 min,取上清液,得到黄酮提取液,随即测定总黄酮的含量。
1.2.2 单因素试验 采用控制变量法,按照1.3.1黄酮提取工艺,考察乙醇浓度(50%、60%、70%、80%、90%)、乙醇体积倍数(乙醇添加体积与样品质量的倍数,10、20、30、40、50)、水浴温度(40、50、60、70和80 ℃)、水浴时间(30、50、70、90和110 min,)对提取总黄酮含量的影响。考察某一因素时,其他因素条件固定为:乙醇浓度70%,乙醇体积倍数40,水浴温度70 ℃,水浴时间90 min。
1.2.3 响应面优化试验 在单因素试验的基础上,利用Design-Expert 8.06软件Box-Behnken 设计,进行响应面优化设计,以乙醇浓度(A)、乙醇体积倍数(B)、水浴温度(C)、水浴时间(D)为因变量,以总黄酮含量为响应值,设计四因素三水平响应面优化试验,中心试验重复5 次,共29 组试验,具体如表1所示。
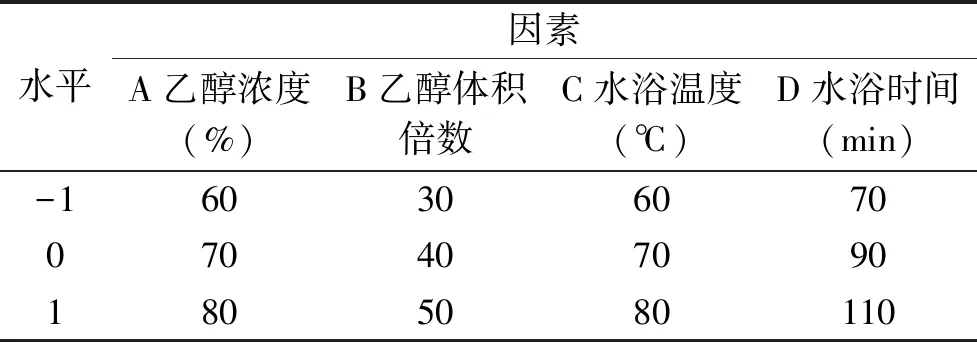
表1 Box-Behnken设计因素与水平表Table 1 Variables and levels in Box-Behnken central composite design
1.2.4 黄果枸杞黄酮提取物体外抗氧化活性测定
1.2.4.1 黄果枸杞黄酮提取物成分测定 以三种种质黄果枸杞为研究对象,以红果枸杞(宁杞1号)、黑果枸杞为对照组,按照优化后的黄酮提取方法,进行黄酮化合物提取,并对不同种质的黄酮提取物进行总黄酮、总酚含量的测定。
总黄酮含量采用硝酸铝显色法测定总黄酮含量[15]。取提取液10 mL于25 mL容量瓶中,加5% NaNO2溶液0.5 mL摇匀,放置6 min,加入10% Al(NO3)3溶液0.5 mL摇匀,放置6 min,加4% NaOH 4 mL,再用30%乙醇定容,摇匀,放置10 min,于510 nm处测定样品吸光值。以不同浓度芦丁标准品溶液绘制所得标准曲线为:y=0.1066x-0.0017,R2=1.0000,x为吸光值,y为芦丁含量(μg/mL),以此计算样品中总黄酮的含量(μg/g 鲜重,以芦丁计)。
总酚含量测定采用Folin-Ciocalteu法测定[16]。称取2.00 g样品于250 mL圆底烧瓶,加入40 mL体积分数60%乙醇溶液,搅拌均匀,在恒温水浴锅中75 ℃水浴,提取50 min。提取液以3000 r/min离心200 min,取上清液1 mL加入福林酚试剂1 mL,摇匀后再加入质量分数12% Na2CO3溶液2 mL,用水定容至25 mL,摇匀,室温下避光反应2 h后,765 nm波长下测定吸光值。同法制备不同浓度没食子酸标准溶液,绘制所得标准曲线为:y=0.0904x+0.0012,R2=0.9982,x为吸光值,y为没食子酸含量(μg/mL),并由此计算总酚含量(mg/g鲜重,以没食子酸计)。
1.2.4.2 ABTS自由基清除能力测定 参照Oyaizu[15]测定方法。将7 mmol/L ABTS+溶液与2.45 mmol/L K2S2O8混合,置于暗处反应16 h制成ABTS+储备液,用甲醇稀释ABTS+溶液至吸光度为0.70±0.02(波长734 nm)制成ABTS+工作液。取30 μL黄酮提取液,加入3 mL ABTS+溶液涡旋10 s混匀,6 min后测量其在波长734 nm处的吸光度,ABTS+清除率(A)计算公式如下:
式中:A2为加入提取物的吸光度;A1为本底吸收的吸光度;A0为空白溶液的吸光度。
配置不同浓度VC标品溶液,以VC的质量(mg)为横坐标,清除率(%)为纵坐标,得到VC清除ABTS+自由基的标准曲线,y=9959.4485x-0.4185,R2=0.9934。将样品清除率代入标曲,结果表示为每克鲜黄果枸杞的VC当量(mg VCeq./g鲜重)。
1.2.4.3 DPPH自由基清除能力测定 参照Atoui[16]测定方法。吸取黄酮提取液0.5 mL,加入 0.1 mmol/L DPPH自由基溶液4.0 mL,用甲醇定容至6 mL摇匀,放置30 min。以60%甲醇调零,517 nm处测定吸光度。DPPH自由基清除率(B)计算公式如下:
式中:A2为加入提取物的吸光度;A1为本底吸收的吸光度;A0为空白溶液的吸光度。
以VC的质量(mg)为横坐标,清除率(%)为纵坐标,得到VC清除DPPH自由基的标准曲线,y=2454.2697x-1.7252,R2=0.9932。将样品清除率代入标准曲线,结果表示为每克鲜黄果枸杞的VC当量(mg VCeq./g鲜重)。
1.2.4.4 还原力测定(FRAP) 参照Wang[17]测定方法。取10 mmol/L TPTZ溶液 10 mL,0.3 mol/L醋酸钠缓冲液(pH=3.6)100 mL,20 mmol/L的FeCl3溶液10 mL 混合均匀后置于35 ℃水浴中孵化30 min后使用,现用现配。吸取不同浓度VC标准品溶液0.1 mL,加入TPTZ工作液0.9 mL,醋酸钠缓冲液9 mL。于35 ℃水浴中反应30 min,分别测定597 nm 波长处吸光值,FRAP值以吸光值表示。
以VC的质量(mg)为横坐标,吸光值为纵坐标,得到VC标准溶液FRAP标准曲线,y=24.5559x+0.0411,R2=0.9933。样品的测定方法同标曲,将样品吸光值代入标曲,结果表示为每克鲜黄果枸杞的VC当量(mg VCeq./g 鲜重)。
1.2.5 相关性分析 分析比较不同黄果枸杞黄酮提取物的抗氧化活性与其总黄酮、总酚含量的相关性。
1.3 数据处理
采用SPSS 21.0统计软件、Origin 8.5绘图软件进行数据方差显著性处理和分析,测定数据以平均值±标准差表示。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇浓度对总黄酮含量的影响 如图1所示,总黄酮含量随着提取剂乙醇浓度的增大而升高,当乙醇浓度为70%时,总黄酮含量最高;当其浓度大于70%时,总黄酮含量逐渐减少。黄酮类物质在一定的乙醇-水体系下容易溶出,而当乙醇浓度过大时,其他醇溶性色素、亲脂溶性物质溶出增多,这些成分与黄酮类化合物竞争同乙醇-水分子结合[9-10],从而抑制黄酮类物质的溶出,导致总黄酮含量下降。

图1 乙醇浓度对总黄酮含量的影响Fig.1 Effects of ethanol concentration on total flavonoids content注:图中不同字母表示差异显著(P<0.05),图2~4同。
2.1.2 乙醇体积对总黄酮含量的影响 提取溶剂的量是提取天然产物过程中尤为重要的因素之一。如图2所示,随着乙醇体积的增加,总黄酮含量呈现先升高后下降趋势,这表明溶剂体积的增加,能够促进物料和溶剂更加充分的接触和反应,使黄酮类物质更易溶出;当乙醇体积倍数达到40时,提取的总黄酮含量最高。
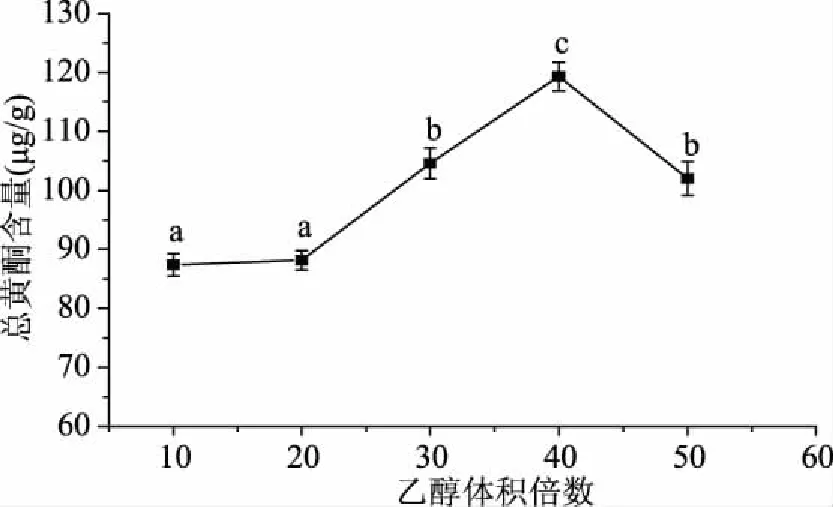
图2 乙醇体积对总黄酮含量的影响Fig.2 Effects of ethanol volume on total flavonoids content
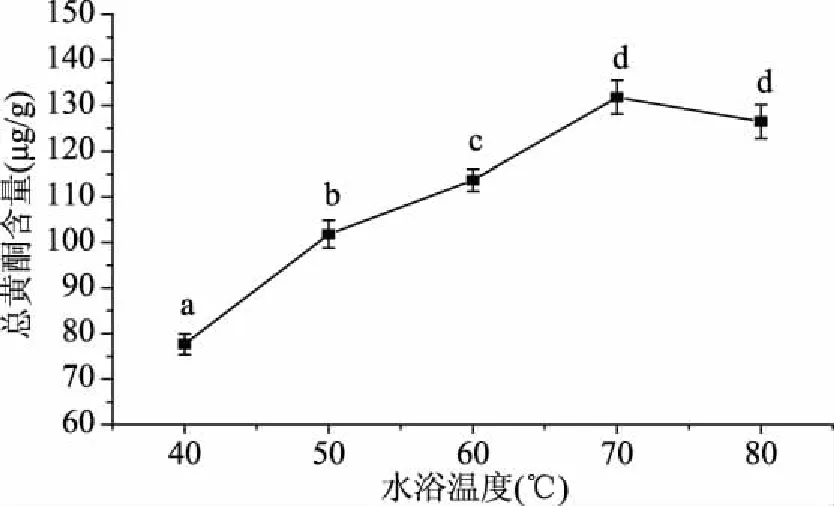
图3 水浴温度对总黄酮含量的影响Fig.3 Effects of water bath temperature on total flavonoids content
2.1.3 水浴温度对总黄酮含量的影响 如图3所示,随着水浴温度从40 ℃向70 ℃升高,总黄酮含量随之升高,当温度达到80 ℃时,黄酮含量略微下降(但不显著),适当水浴升温可增加分子动能,增强渗透扩散能力,利于物质溶出。因此,水浴温度应控制在70 ℃。
2.1.4 水浴时间对总黄酮含量的影响 总黄酮含量随着水浴时间延长而不断升高,当高于90 min后,总黄酮含量显著下降,分析原因可能是由于水浴时间过长,乙醇挥发较多,使总黄酮的提取下降,也可能是黄酮类物质已经基本溶出,此时延长水浴时间,不仅引起其他物质溶出,还会使部分热敏化合物发生降解反应[17-18]。
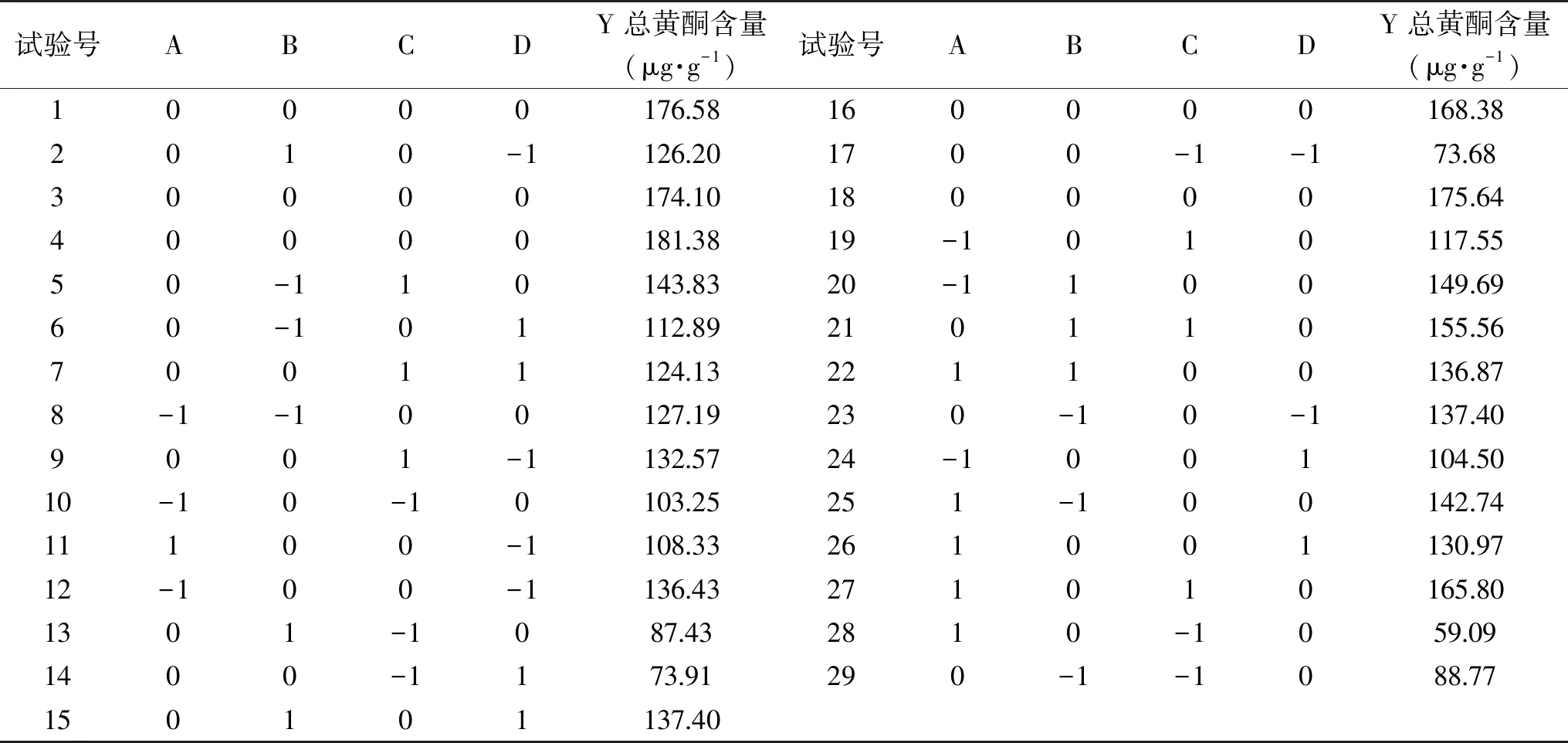
表2 响应面优化试验结果Table 2 Results of response surface experiments

图4 水浴时间对总黄酮含量的影响Fig.4 Effects of water bath time on total flavonoids content
2.2 响应面试验结果分析
基于单因素试验确定的适宜范围,依据响应面试验设计原理,设计四因素三水平黄果枸杞黄酮提取优化试验,共29组试验,试验结果如表2所示。
经Design-Expert 8.06软件回归拟合,建立提取工艺参数回归模型,得到总黄酮含量(Y)对乙醇浓度(A)、乙醇体积倍数(B)、水浴温度(C)、水浴时间(D)的二次多项回归方程:Y=175.22+0.43A+3.36B+29.44C-2.57D-7.09AB+23.10AC+13.64AD+3.27BC+8.93BD-2.17 CD-22.15A2-14.2B2-41.75C2-32.65D2。
对上述回归方程进行方差分析及显著性检验,如表3所示。结果表明:回归方程模型极显著(P<0.01);失拟项不显著(P>0.05),模型相关系数为0.9957,调整确定系数为0.9914,预测模型系数为0.9873,说明模型与实际试验拟合程度良好,误差较小,模型成立,可用来优化分析、预测黄果枸杞黄酮提取工艺及其含量。
除乙醇浓度因素不显著外,体积倍数(B)、水浴温度(C)、水浴时间(D)均显著(P<0.05)或极显著(P<0.01);各因素对提取总黄酮的影响强弱顺序依次为:水浴温度(C)>乙醇体积倍数(B)>水浴时间(D)>乙醇浓度(A)。其中,乙醇浓度与体积倍数(AB)、乙醇浓度与水浴时间(AD)、乙醇浓度与水浴温度(AC)、体积倍数与水浴时间(BD)因素之间交互作用极显著(P<0.01),如图5所示。
由Design-Expert 8.06软件预测出的最佳提取工艺参数为:乙醇浓度为72.10%、体积倍数为41.17、水浴温度为72.08 ℃、水浴时间为90.13 min,此条件下,总黄酮含量为181.556 μg/g,为验证模型的可靠性,考虑到实际操作条件,调整工艺参数为:乙醇浓度70%、体积倍数40倍、水浴温度70 ℃、水浴时间90 min,进行五组试验,得到总黄酮含量为(175.21±1.69) μg/g,理论值与预测值相差3%,误差较小,说明此模型可以有效用于黄果枸杞中的黄酮提取工艺优化。

表3 回归方程系数显著性检验和结果Table 3 Test of significance for regression coefficient and results
注:**表示差异极显著,P<0.01;*表示差异显著,P<0.05。
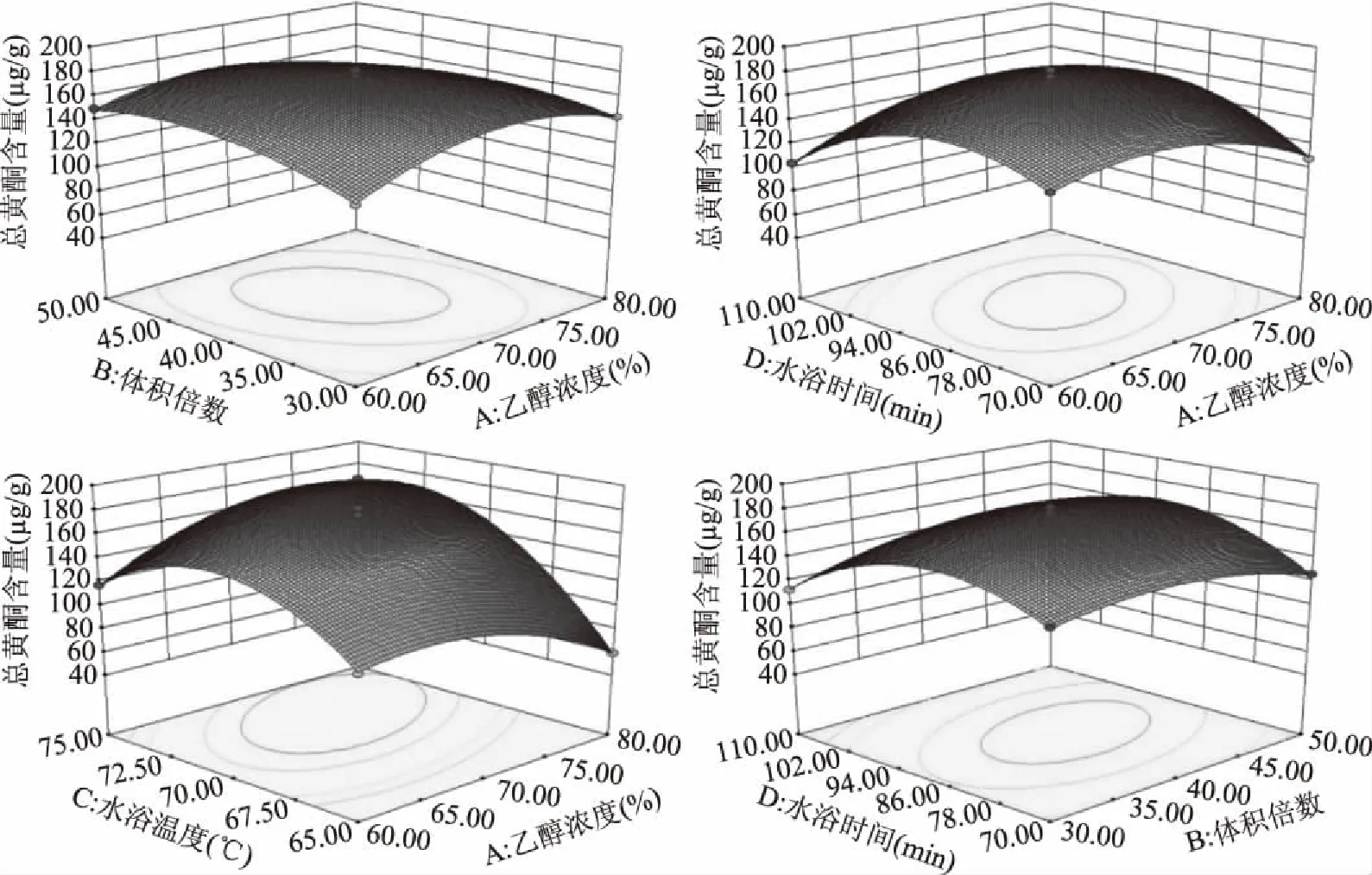
图5 黄酮提取优化试验响应面图Fig.5 Response surface plots for flavonoids extraction yield
2.3 体外抗氧化活性分析
2.3.1 不同枸杞抗氧化活性分析 “宁农杞4号”、“宁农杞5号”和“宁夏黄果”是黄果枸杞品系中最具代表性的三个品种,以红果枸杞(“宁杞1号”)和黑果枸杞作为对照组,均按照上述“宁农杞5号”响应面优化后的黄酮最佳提取方法制备,获得不同品种枸杞黄酮提取液,并比较不同品种枸杞黄酮提取物的抗氧化活性,结果如图6所示。对ABTS自由基的清除能力由强到弱依次为:黑果枸杞>宁农杞5号>宁夏黄果>宁杞1号>宁农杞4号,其中宁夏黄果与宁杞1号差异不显著(P>0.05),DPPH清除能力结果与ABTS结果一致;Fe3+还原能力由强到弱依次为:黑果枸杞>宁杞1号>宁农杞4号>宁农杞5号>宁夏黄果,其中宁农杞4号、宁农杞5号和宁夏黄果差异不显著(P>0.05)。
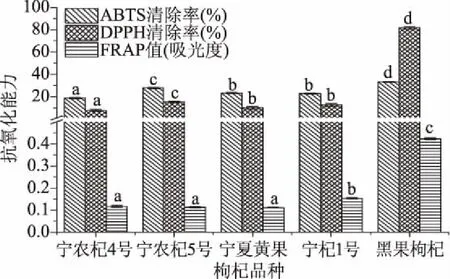
图6 不同枸杞黄酮提取物体外抗氧化能力比较Fig.6 Comparison of antioxidant activity of flavonoids extract from different wolfberry in vitro
将上述抗氧化活性结果转换化成VC当量,得到表4,结合图6可知,五种枸杞中,黑果枸杞和“宁农杞5号”黄果枸杞具有较强的清除ABTS+和DPPH自由基的能力。
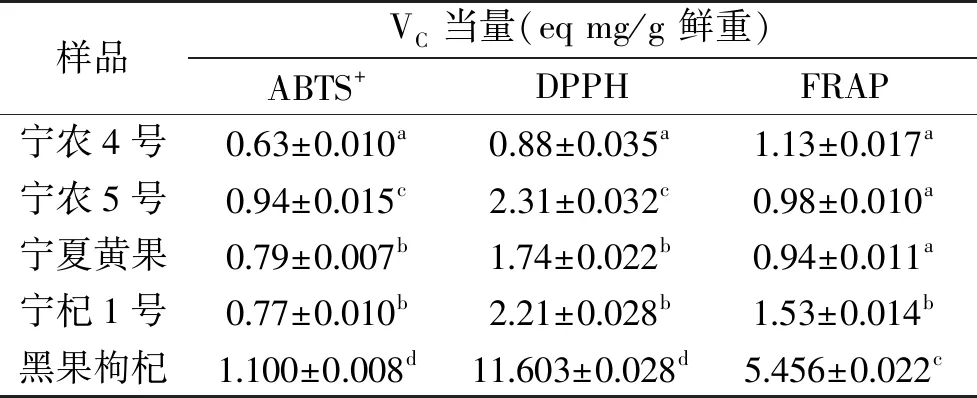
表4 不同抗氧化指标对应的VC当量 Table 4 VC equivalent of different antioxidant indexes
注:同列不同小写字母表示差异显著(P<0.05)。
2.3.2 不同抗氧化活性与活性成分的相关性分析 由表5可知,三种黄果枸杞中,“宁农5号”总黄酮及总酚含量最高,其中总黄酮含量是其他两种黄果枸杞的1.4~2.3倍,是红果枸杞的1.7倍,对照组红果枸杞(“宁杞1号”)总酚含量最低。黑果枸杞由于其种质特殊性,含有丰富且独特的花色苷成分,因此总黄酮和多酚含量在几种枸杞果实中含量最高。已有研究表明,不同黄酮化合物组成对抗氧化活性影响较大,酚羟基及内氢键数目是黄酮类化合物表现抗氧化活性的重要影响因素,7-O位黄酮衍生物具有较母体化合物强的生物活性,特别是山奈酚衍生物和槲皮素衍生物,是黄酮类化合物表现抗氧化、抗癌等生物活性的重要物质组成[18-20],但目前黄果枸杞中的黄酮组成还不明晰,有待进一步研究。

表5 不同枸杞黄酮提取物组成Table 5 Compose of flavonoids extract of different wolfberry
注:同列不同小写字母表示差异显著(P<0.05)。

表6 不同枸杞黄酮提取物组成与抗氧化能力的相关性Table 6 Correlation between flavonoids extract and antioxidant capacity of different wolfberry
注:表中“*”表示相关性显著(P<0.05);“**”表示相关性极显著(P<0.01)。
如表6所示,总黄酮含量与ABTS+清除率呈显著正相关(P<0.05),相关系数为0.909,与DPPH清除率和FRAP呈极显著正相关(P<0.01)相关系数分别为0.992和0.969;总酚含量与ABTS+清除率、DPPH清除率呈显著正相关(P<0.05),相关系数分别为0.903和0.907。综合表明,黄酮是黄果枸杞表现抗氧化活性的主要成分[21-22]。
3 结论
黄酮类化合物是黄果枸杞功效物质的重要组成,试验结果表明,水浴温度是影响黄果枸杞黄酮提取的主要因素,最佳提取工艺参数为:乙醇浓度70%、乙醇体积倍数40倍、水浴温度70 ℃、水浴时间90 min,此时黄酮含量为(175.21±1.69)μg/g;体外抗氧化活性分析表明,黄果枸杞中“宁农杞5号”对ABTS+清除率和DPPH清除能力最强,高于红果枸杞(“宁杞1号”),但不及黑果枸杞;通过相关性分析可知,总黄酮含量与ABTS+清除率呈显著正相关,与DPPH清除率和FRAP值呈极显著正相关;总酚含量与ABTS清除率、DPPH清除率呈显著正相关。综合表明,黄酮类化合物是黄果枸杞表现抗氧化活性的主要成分。后续将对黄果枸杞中的黄酮化合物进行进一步分离鉴定,为黄果枸杞的综合开发与利用提供理论支撑。
