紫草素抑制非小细胞肺癌A549侵袭和迁移能力①
2019-02-18张小方
张小方 赵 影 李 琦
(河南省驻马店黄淮学院,驻马店 463000)
肺癌给人类健康造成了严重的威胁,根据组织学特性可分为两种亚型:小细胞肺癌(Small cell lung cancer,SCLC)和非小细胞肺癌(Non-small cell lung cancer,NSCLC)。NSCLC是肺癌的主要亚型,占肺癌病例的85%~90%[1]。目前NSCLC的治疗主要包括手术切除、化学治疗、放疗及免疫治疗[1-3]。对不同时期的NSCLC需要不同的治疗策略[4]。早期NSCLC主要采用手术切除进行治疗(68%),其中16%的患者手术的同时需要辅助化疗或放疗,约18%和15%的NSCLC晚期患者分别采用化疗和放疗,有33%的NSCLC晚期患者需要进行放化疗[5]。化学疗法在NSCLC的治疗过程中占据着重要的位置。中草药由于其副作用小而被广泛运用于化学治疗。紫草素是紫草的主要活性成分,结构式见图1A,属于萘醌类物质。紫草素具有抗炎、抗癌、抗氧化、神经保护、心脏保护、抗菌及伤口愈合等作用,已在多种疾病中报道,例如关节炎、哮喘、狼疮性肾炎、急性肺损伤、黑色素瘤、神经胶质瘤、宫颈癌、结肠癌、肝癌等[6]。本文主要探索紫草素对NSCLC细胞A549运动能力的影响及其调控机制。
1 材料与方法
1.1细胞系及主要试剂 肺癌细胞系A549(ATCC号:CCL-185)购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。紫草素购自Sigma公司,溶解于二甲基亚砜(Dimethyl sulfoxide,DMSO)。培养基DMEM、胎牛血清购自赛默飞世尔科技公司。CCK-8试剂盒购自日本同仁化学公司。Transwell小室及人工基底膜购自美国BD公司。血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)、基质金属蛋白酶14(Matrix metalloprotein 14,MMP-14)、纤维连接蛋白(Fibronectin,FN)、波形蛋白Vimentin、PI3K、p-AKT和p53抗体购自Abcam公司。
1.2方法
1.2.1细胞培养及细胞活力检测 A549细胞于含10%胎牛血清和1%青-链霉素的DMEM培养基中,置于37℃、5% CO2的恒温培养箱中培养。细胞增殖到约80%时传代继续培养。首先用培养液将紫草素稀释到0.5、1、2、5、10、20、50、100、200、400 mmol/L,再用上述含不同浓度紫草素的培养液将细胞制成5×104个/ml的细胞悬液。然后向96孔板中接种100 μl上述细胞悬液,对照孔用添加DMSO的培养液制成的细胞悬液,每个浓度接种5个孔。培养24 h向各孔加入10 μl的CCK-8溶液,并在37℃培养1~4 h,检测450 nm处吸光值计算细胞活力。
1.2.2Transwell检测细胞侵袭能力 用添加了DMSO或不同浓度的紫草素的1%胎牛血清的DMEM培养基将A549细胞制成细胞密度为1×106cells/ml的细胞悬液,首先在Transwell下室中加入含20%胎牛血清的DMEM培养基,然后将上述细胞悬液加入铺有人工基底膜的Transwell的上室中,37℃培养24 h。最后用0.5%的结晶紫对上室底部细胞进行染色,并用棉签将上室内侧的细胞除去。显微镜下观察细胞并统计每个视野下的细胞数量。
1.2.3划痕实验检测细胞迁移能力 首先将A549细胞接种于6孔板中,过夜培养至形成单层细胞。在单层细胞上用10 μl的枪头划横线,PBS洗3次,洗去因划痕而脱落的细胞后加入添加了DMSO或不同浓度的紫草素的完全培养基置于37℃培养。在0 h和24 h时显微镜下拍照测量划痕宽度计算划痕愈合率。
1.2.4蛋白印迹 收集各组A549细胞用PBS清洗3次,再用含蛋白酶抑制剂的细胞裂解液进行裂解提取总蛋白。然后进行SDS-PAGE凝胶电泳分离并转至PVDF膜。经5%的BSA进行封闭后依次孵育相应的一抗和二抗。最后进行显色并统计灰度值计算相对表达量。
1.3统计学分析 用SPSS16.0软件对实验数据进行统计学分析,两两比较用独立的t检验。P<0.05表示差异有统计学意义。
2 结果
2.1紫草素对NSCLC细胞A549细胞活力的影响 通过CCK-8分析不同浓度(0.5~400 mmol/L)的紫草素对NSCLC细胞A549细胞活力的影响。如图1B所示,用低浓度的(0~10 mmol/L)的紫草素处理A549后,细胞活力仍然可以保持90%以上。高浓度的(100~400 mmol/L)的紫草素会导致A549细胞活力下降,且A549细胞活力会随着紫草素浓度的升高而降低。上述结果表明,紫草素可减弱NSCLC细胞A549细胞活力,后续实验采用20、50、100 mmol/L作为低中高三组处理组。
2.2紫草素对NSCLC细胞A549侵袭能力的影响 利用Transwell检测NSCLC细胞A549侵袭能力。图2A显示,紫草素处理A549后,穿过Transwell小室基底膜的细胞数目明显变少。由图2B可知,紫草素(20、50、100 mmol/L)组每个视野下的侵袭细胞数目明显少于对照组(P<0.05)。由此可见,紫草素可减弱NSCLC细胞A549细胞侵袭能力。
2.3紫草素对NSCLC细胞A549迁移能力的影响 通过划痕试验分析紫草素对NSCLC细胞A549细胞迁移能力的影响。如图3A所示,划线24 h后,紫草素组划痕间距明显大于对照组。由图3B可知,与对照组相比,紫草素(20、50、100 mmol/L)组划痕愈合率明显降低(P<0.05)。以上结果表明,紫草素可减弱NSCLC细胞A549细胞迁移能力。
2.4紫草素对NSCLC细胞A549上皮间质转化的影响 为了分析紫草素对NSCLC细胞A549上皮间质转化的影响,蛋白印迹检测上皮间质转化相关蛋白VEGF、MMP-14、Fn和Vimentin的表达。图4A显示,添加紫草素后A549细胞VEGF、MMP-14、Fn和Vimentin表达明显减弱。统计灰度值计算相对蛋白表达量,如图4B所示,A549细胞VEGF的表达会随着紫草素浓度的增加而减弱;紫草素组(20、50、100 mmol/L)MMP-14、Fn和Vimentin的表达也都低于对照组(P<0.05)。由此可见,紫草素可抑制NSCLC细胞A549上皮间质转化。

图1 紫草素化学结构式(A)和CCK-8检测A549细胞活力(B)Fig.1 Chemical structure of shikonin(A)and cell viability was tested by CCK-8(B)

图2 Transwell检测细胞侵袭Fig.2 Cell invasion was detected by TranswellNote: A.Crystal violet staining ×100;B.The statistical histogram of the number of invasive cells per field,*.P<0.05,**.P<0.01,***.P<0.001 vs DMSO.

图3 划痕试验检测细胞迁移能力Fig.3 Cell migration was measured by wound healing assayNote: A.Scratch space was photographed under inverted microscope ×40;B.The statistical histogram of the wound closure rate,*.P<0.05,**.P<0.01,***.P<0.001 vs DMSO.
2.5紫草素对NSCLC细胞A549中PI3K/AKT信号通路的影响 为探索紫草素影响NSCLC细胞A549的分子机制,蛋白印迹检测PI3K/AKT信号通路蛋白及抑癌基因p53的表达。图5A显示,添加PI3K/AKT通路激活剂IGF-1后,PI3K和p-AKT表达升高,p53表达降低;紫草素处理A549后,PI3K和p-AKT表达降低,p53表达升高。由图5B可知,PI3K/AKT通路激活剂IGF-1可增强PI3K和p-AKT表达,降低p53表达(P<0.05)。与IGF-1组相比,紫草素组(20、50、100 mmol/L)PI3K和p-AKT表达降低,p53表达升高,逆转IGF-1诱导的PI3K/AKT信号通路的激活和p53表达的降低(P<0.05)。上述结果表明,紫草素可通过PI3K/AKT信号通路对A549进行调控。
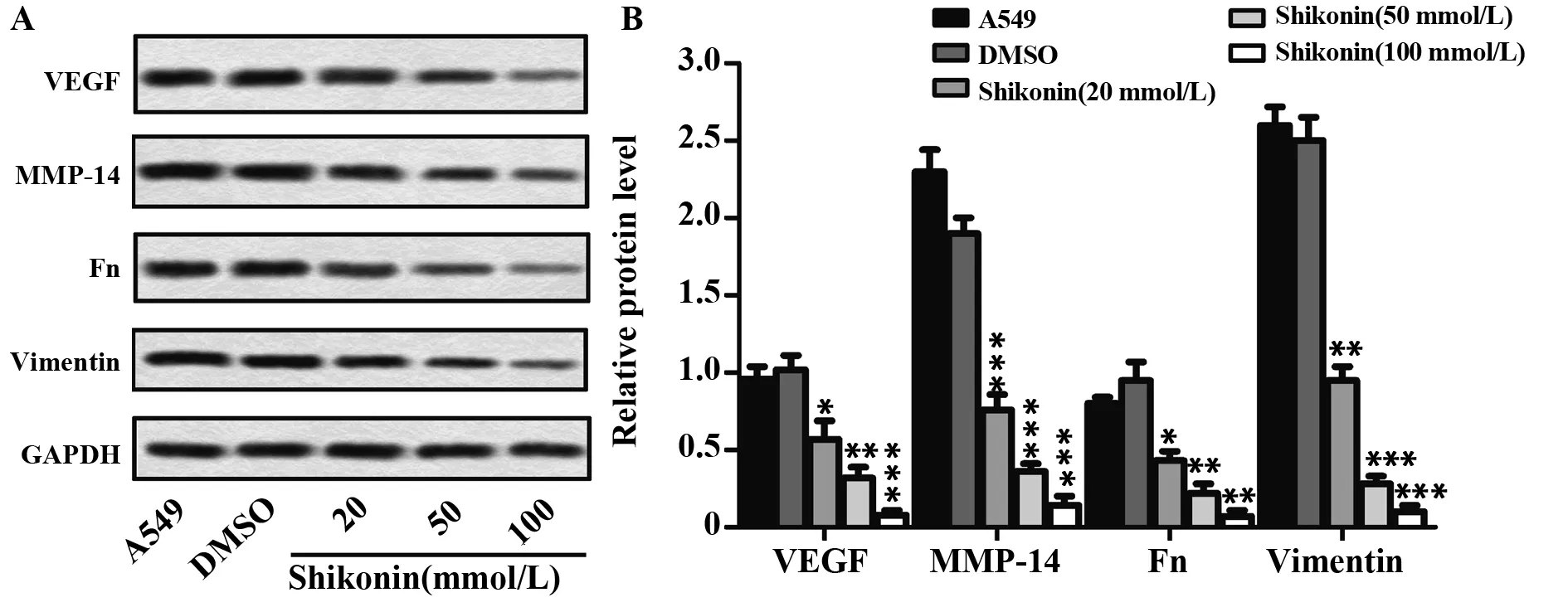
图4 蛋白印迹检测上皮间质转化相关蛋白表达Fig.4 Expression of epithelial-mesenchymal transition related proteins was detected by Western blotNote: A.Representative picture of Western blot;B.The statistical histogram of the Western blot,*.P<0.05,**.P<0.01,***.P<0.001 vs DMSO.
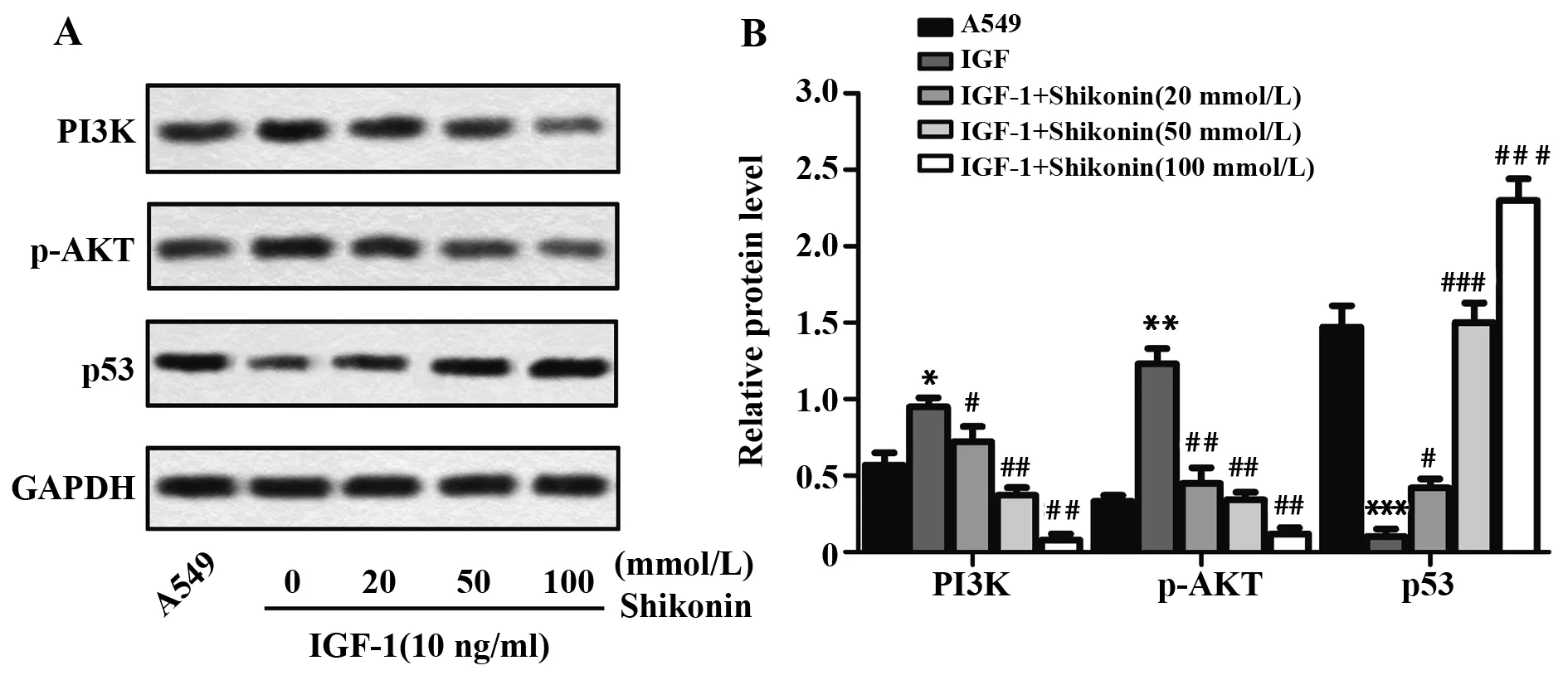
图5 蛋白印迹分析PI3K/AKT信号通路相关蛋白和p53的表达Fig.5 Expression of PI3K/AKT pathway related proteins and p53 was tested by Western blotNote: A.Representative picture of Western blot;B.The statistical histogram of the Western blot.*.P<0.05,**.P<0.01,***.P<0.001 vs A549 group;##.P<0.01,###.P<0.001 vs IGF group.
3 讨论
肺癌一直以来都是发生率和死亡率最高的癌症。全球肺癌病例从2002年的125万上升到2012年的180万,肺癌死亡人数从2002年的118万增加到2012年的160万[7,8]。而且肺癌的5年以上存活率十分低,在英国肺癌5年以上存活率仅为16.8%[9]。肺癌严重影响患者的生活质量且给卫生保健系统带来巨大的财政压力,2010年英国用于肺癌的直接医疗成本约121亿美元[10]。开发有效的且副作用小的肺癌治疗方法对人类健康事业的发展具有重要意义。植物提取物由于其副作用小而在疾病治疗方面受到广泛关注。
大量文献报道了植物提取物在抑制癌细胞活力方面起着积极作用。有数据显示从金钟柏树叶中提取的黄酮醇可抑制A549细胞活力[11]。据报道,重楼皂苷处理A549后,细胞活力明显减弱[12]。有研究发现紫草素可抑制胃癌细胞及人表皮样癌A431细胞活力[13,14]。Huang等[15]发现紫草素还可抑制神经胶质瘤细胞活力。与前人结果类似,本研究结果显示,NSCLC细胞A549细胞活力会随着紫草素处理浓度的增加而降低。
癌细胞的运动能力在癌症发展进程中具有重要作用。许多植物提取物都可以减弱癌细胞的运动能力。有研究发现银杏叶提取物和紫苏醇均可抑制A549细胞侵袭[16,17]。据报道栝楼果实可抑制A549细胞迁移及侵袭[18]。Hao等[19]研究显示紫草素可减弱卵巢癌细胞侵袭能力。有研究数据显示紫草素可抑制乳腺癌细胞及结肠直肠癌细胞侵袭和迁移[20,21]。本研究结果表明,紫草素(20、50、100 mmol/L)可明显减弱NSCLC细胞A549侵袭及迁移能力。
越来越多的文献表明植物提取物可抑制癌细胞上皮间质转化。Shi等[22]发现没食子儿茶素-3-没食子酸酯可抑制尼古丁诱导的A549细胞上皮间质转化。有研究发现在甲状腺癌细胞中,紫草素可减弱皮间质转化相关蛋白Vimentin及MMP-14的表达,抑制上皮间质转化[23]。有数据显示紫草素和替莫唑胺混合物可抑制恶性胶质瘤细胞Vimentin表达[24]。Hsieh等[25]发现紫草素可减弱肺癌细胞HCC827波形蛋白Vimentin的表达。与前人结果一致,本研究表明,紫草素(20、50、100 mmol/L)会降低A549细胞VEGF、MMP-14、Fn和Vimentin表达,抑制上皮间质转化。
大量数据表明抑制PI3K/AKT信号通路,提高p53水平对癌症的治疗具有积极作用。有研究表明毛梗豨莶草提取物可通过抑制AKT的活化减弱A549细胞活力和侵袭能力[26]。有数据显示丹参酮可降低NSCLC细胞Glc-82、A549和H460中AKT磷酸化水平,提高p53表达,减弱细胞活力[27]。据报道紫草素可通过PI3K/AKT信号通路抑制胰腺癌细胞活力[28]。Zhang等[29]研究发现紫草素可通过抑制PI3K/AKT信号通路减弱胶质母细胞瘤的侵袭和迁移能力。本研究结果显示,紫草素(20、50、100 mmol/L)可抑制A549细胞PI3K/AKT通路激活剂IGF-1诱导的PI3K/AKT信号通路的激活和p53表达的降低。
本研究表明,紫草素可减弱A549细胞活力;降低细胞侵袭及迁移能力;减弱VEGF、MMP-14、Fn和Vimentin表达,抑制上皮间质转化;逆转PI3K/AKT通路激活剂IGF-1诱导的PI3K和p-AKT表达的升高及p53表达的降低。综上所述,紫草素可通过PI3K/AKT通路实现对A549细胞侵袭和迁移的抑制作用。下一步计划进行紫草素抑制NSCLC的体内研究,为发掘新的肺癌治疗策略奠定基础。
