IL-38及MIP-2在大鼠肺纤维化中的作用①
2019-02-18孙云晖刘振欣鲍文华王一新牛圆圆
孙云晖 刘振欣 鲍文华 王一新 牛圆圆
(佳木斯大学附属第一医院,佳木斯 154003)
肺纤维化(Pulmonary fibrosis, PF)是一种慢性进行性发展的肺部疾病,临床上收入院患者少数有职业粉尘暴露史或结缔组织病病史,但大多数病因未明,临床表现以胸闷气短、呼吸困难、乏力为主,PF至今无可治愈的药物,多数此病患者的治疗效果较差,病死率高,生活质量严重下降。在整个肺纤维化的发生及发展进程中各种细胞因子在炎性细胞的聚集,刺激成纤维细胞活化和增殖,促使胶质成分的沉积等方面发挥着重要的作用[1]。IL-38属于IL-1家族第10个新成员, 它首先是2001年由 Lin等[2]使用寡核苷酸探针杂交技术和计算机序列分析、发现并鉴定的细胞因子。IL-38与IL-36Ra、IL-1Ra一样,对炎症性免疫过程有抑制作用[3]。巨噬细胞炎性蛋白-2(Macrophage inflammatory protein-2,MIP-2)属于趋化因子C-X-C亚家族成员之一,可由巨噬细胞等多种细胞产生,对中性粒细胞有很强的趋化作用[4]。目前,国内外关于IL-38生物学功能等的研究都尚处于起步阶段,关于IL-38与MIP-2在大鼠PF中的关系罕见报道,本实验通过制备PF动物模型,观察PF大鼠生理状态及肺组织病理改变,检测肺组织IL-38蛋白及MIP-2mRNA的含量,通过探讨IL-38、MIP-2在大鼠PF发生、发展过程中的作用及意义,判断其对PF临床价值,可以为临床提供一条新的抗纤维化治疗策略。
1 材料与方法
1.1材料
1.1.1主要仪器及药物 Applied Biosystems 7300Real Time PCR System(佳木斯大学实验室提供);注射用盐酸博来霉素BLM(海正辉瑞制药有限公司提供);HE染色试剂(湖北锦源医疗科技有限公司提供);Nikon eclipse50i显微镜(北京中仪光科科技发展有限公司提供);IL-38大鼠ELISA试剂盒(上海恒远生物科技有限公司提供);大鼠HYP酶联免疫分析试剂盒(上海劲马实验设备有限公司提供);RNA提取试剂盒(北京艾德莱生物科技有限公司);cDNA反转录试剂盒及PCR试剂盒(大连宝生物工程有限公司)。
1.1.2实验动物 成年清洁级Wistar大鼠(雌雄各半)45只,6~8周龄,体重(180~220)g,由哈尔滨医科大学动物实验中心提供[许可证号:SCXK(黑)2013-001],按清洁级标准饲养于佳木斯大学动物实验中心。在实验动物喂养及实验观察期间,由专人管理,环境、温度、湿度适宜。
1.2方法
1.2.1分组及模型制备 健康Wistar大鼠应用随机、对照原则分为3组(n=15):生理盐水对照组(N组)、博来霉素组(B组)和地塞米松组(D组),其中B组和D组统称为模型组(M组)。M组按照 BLM 4 mg/kg 体积气管内注射制备纤维化大鼠模型,N组气管内注射同体积的生理盐水。地塞米松治疗组:第2天开始每天腹腔注射地塞米松注射液 3 mg/kg,其余两组腹腔注射同体积的生理盐水作为对照。分别于第 7天、14天、28 天,每组处死大鼠5只,留取肺组织待检测。
1.2.2肺组织标本的采集 腹腔内注射10%水合氯醛3.5 ml/kg;开胸,肺脏经病理宏观检查后,取出两肺,切取的右肺上叶肺组织固定于10%中性福尔马林中,于24 h更换福尔马林液,48 h取出,常规石蜡包埋,苏木精-伊红(Hematoxylin-eosin,HE)染色后光学显微镜下观察各组大鼠肺组织切片病理改变情况;切取的其余右肺组织及左肺用滤纸吸干放入Eppendorf管内置于-80℃冰箱保存,分别用于大鼠肺组织羟脯氨酸、IL-38及MIP-2mRNA含量的检测。
1.2.3检测方法 ELISA检测大鼠肺组织羟脯氨酸含量及肺组织中IL-38的表达情况,严格按照大鼠酶联免疫吸附剂测定试剂盒说明书步骤。
RT-PCR法测定肺纤维化大鼠肺组织中MIP-2mRNA表达:严格按照RNA提取试剂盒说明书提取总RNA,将RNA逆转录为cDNA,以cDNA为模板,采用荧光定量RT-PCR,严格按照试剂盒说明进行PCR反应。GAPDH为内参。MIP-2、GAPDH引物由大连宝生物技术有限公司合成及验证。如下:MIP-2(191 bp):F:5′-TCATGAAGTTTGTCTCAACCCTG-AA-3′;R:5′-AGACAGCGAGGCACATCAGGTA-3′。GAPDH(307 bp):F:5′-CGGAGTCAACGGATTTG-GTCGTAT-3′;R:5′-AGCCTTCTCCATGGTGGTGA-AGAC-3′。用ABI Prism 7300 SDS Software测定光密度值CT,通过2-ΔΔCT计算MIP-2 mRNA的相对表达量。

2 结果
2.1大鼠的生理状态及肺组织肉眼观 N组大鼠口唇淡红色,活动灵敏,饮食及睡眠可,呼吸频率正常,体毛色泽佳,体重递增,大鼠肺组织外观表面光滑,为淡红色,质软,边缘锐利;B组大鼠口唇发绀,日渐萎靡,活动迟钝,饮食及睡眠差,呼吸频率增快,呼吸困难日渐加重,活动后更甚,有明显的缺氧症状,体毛色泽暗淡,在注射博来霉素14 d左右出现体毛脱落,体重逐渐减轻,早期取出大鼠肺组织有充血及出血,质硬,边缘较钝,28 d时出现大面积的体毛脱落,大鼠肺组织见散在分布的类似结节样病灶,质硬,边缘钝;D组表现介于N、B组之间,且D组大鼠生理状态和肺组织外观较B组表现好。
2.2PF大鼠肺组织病理形态学改变 为了了解地塞米松改善BLM诱导的肺纤维化的作用机制,用HE染色,光镜下(×200)选取视野观察:各期N组大鼠肺泡结构轮廓较好,肺泡间无炎性细胞浸润。与N组比较,B组第14天时肺泡间炎性细胞较多,肺泡间隔略增宽,第28天肺泡间隔明显增宽、大量炎性细胞浸润和成纤维细胞增生,大量肺泡壁断裂,肺泡腔融合,纤维化程度最重,呈现肺泡炎-肺纤维化的动态病理演变过程。与B组比较,D组第28天肺组织内炎性细胞较少、成纤维细胞增生较少、部分肺泡壁断裂及肺泡腔融合,肺纤维化程度较轻。见图1。
2.3IL-38蛋白的表达情况 博来霉素组7 d后大鼠肺组织中IL-38的表达明显降低,第28天下降最明显,与N组相比,差异具有统计学意义(P<0.05),地塞米松组腹腔注射地塞米松后,大鼠肺组织中的IL-38较B组表达水平提高,但仍低于N组。与N组及单独气管内给博来霉素组对比,差异具有统计学意义(P<0.05)。见表1。

图1 HE染色肺组织病理改变(×200)Fig.1 Pathological changes of lung tissue with HE staining(×200)Note: N.Normal lung tissue;B.Bleomycin group;D.Dexamethasone group.
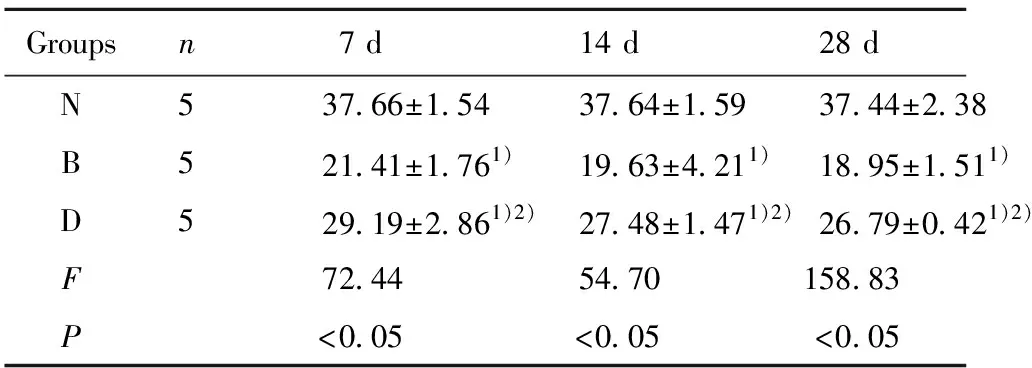
表1 不同时间大鼠肺组织IL-38表达情况(ng/L)
Note:Compared with group N,1)P<0.05;compared with group B,2)P<0.05.
2.4HYP及MIP-2的表达情况 博来霉素组7 d后大鼠肺组织中的HYP及MIP-2的含量明显增高,第28天达高峰,与N组相比,差异具有统计学意义(P<0.05),说明气管内注入博来霉素后,大鼠肺组织产生炎症反应,进而发展为肺纤维化。D组腹腔注射地塞米松后,大鼠肺组织中的HYP及MIP-2较B组下降,与单独气管内给博来霉素对比,差异具有统计学意义(P<0.05)。见表2、3及图2。

表2 不同时间大鼠肺组织HYP表达情况(μg/L)
Note:Compared with group N,1)P<0.05;compared with group B,2)P<0.05.

表3 不同时间大鼠肺组织MIP-2表达情况
Note:Compared with group N,1)P<0.05;compared with group B,2)P<0.05.

图2 MIP-2溶解曲线Fig.2 MIP-2 dissolution curve
3 讨论
PF以肺弥散功能下降为主,为一种不可逆的肺功能受损,最终导致呼吸衰竭,部分患者因长期的烟雾粉尘接触史而发病,随着环境污染的加重,PF的发病率逐年提高[5,6]。在PF早期,受损的肺组织刺激炎性细胞的产生,可导致肺组织中巨噬细胞、粒细胞和淋巴细胞等炎性细胞的浸润[7]。
HYP表达量可以用来反映PF程度,是大鼠PF造模成功的标志[8]。模型组气管内注射博来霉素后,第7天HYP的表达量明显增加,第14天时HYP仍有较高的表达量,第28天时达高峰,与对照组相比,差异具有统计学意义(P<0.05),说明博来霉素诱导大鼠PF造模成功,肺损伤程度逐渐增加。
MIP-2是肺泡巨噬细胞和气道上皮细胞分泌的蛋白质产物,它的特异靶细胞为中性粒细胞,对其起重要的趋化和激活作用[9]。当气道上皮受到吸烟、大气污染、细菌和病毒感染等因素刺激或损害时,巨噬细胞、中性粒细胞等迅速合成并释放多种细胞因子,包括TNF-α和MIP-2等[10]。部分动物实验发现MIP-2在博来霉素致肺纤维化中的作用[11]。另外有研究发现IL-38可减少IL-17、IL-22和IL-8等前炎症因子的产生,所以IL-38也可能作为一种抗炎细胞因子在炎症性疾病中发挥作用[12]。
PF尚无有效控制进展及根治方案,仍为当今研究的热点。近年来研究者主要通过三种途径探讨不同药物对促纤维化细胞因子的抑制作用:TGF-β/Smads、NF-κB途径及TNF-α途径[6]。Wanwen等[13]研究表明NF-κB的激活与多种炎性细胞因子、黏附因子、趋化因子等的基因转录表达密切相关,在细胞炎症反应及凋亡中起重要的调节作用。另有研究表明IL-38可抑制NF-κB的活性,而MIP-2的产生依赖于NF-κB的激活,NF-κB可调节MIP-2基因的转录[14-16]。
本实验研究结果提示,单纯博来霉素组大鼠肺组织中的IL-38表达明显低于N组及D组,HYP及MIP-2明显高于N组及D组,差异具有统计学意义(P<0.05),表明IL-38、MIP-2的表达在肺纤维化的形成过程中占有重要地位。本实验在博来霉素致PF模型中,腹腔内预防性地给予地塞米松,可使大鼠PF程度下降,提示地塞米松能够抑制MIP-2的表达,降低炎性反应,与Haddad等[17]研究成果相一致。地塞米松组大鼠肺组织中IL-38表达量在同一时间点均高于生理盐水组及博来霉素组,差异具有统计学意义(P<0.05)。据此推测地塞米松可通过上调IL-38及下调MIP-2改善大鼠PF,IL-38在大鼠PF中的作用可能和MIP-2有关,IL-38可能通过NF-κB通路抑制MIP-2的产生,但其具体作用机制仍待进一步考证。然而,有实验研究表明IL-38不同于传统意义上的抑制剂,在低浓度时发挥较强的抑制作用,随着浓度的升高其抑制作用反而减弱[3]。猜测与实验条件、实验材料等的差异有关,其中具体的原因与机制还需进一步探究。
本实验提示IL-38可能通过体内复杂传导通路抑制MIP-2的表达,而在大鼠PF发病中发挥抗炎、抗纤维化作用。在将来,通过对IL-38和MIP-2更全面的认知,研究促进IL-38产生及抑制MIP-2生物活性的药物,都可能是控制肺部感染的一个重要环节,可以为临床医生提供更多新的治疗方法,给PF患者带来新希望。
