NK细胞耗竭与卡控点免疫治疗①
2019-02-18毕嘉成田志刚
毕嘉成 田志刚
(中国科学院深圳先进技术研究院,深圳 518055)
免疫系统分为两大分支:固有免疫系统和适应性免疫系统。由T、B细胞构成的适应性免疫系统,通过体细胞DNA重排,生成数量巨大的抗原识别受体,用以识别多种多样的环境抗原;而固有免疫系统则通过种系编码的识别受体,识别病原体或压力相关的分子模式。天然杀伤细胞(NK细胞)属于固有免疫系统。历史上,NK细胞因其对肿瘤细胞的“天然”杀伤效应而被发现。其后,大量研究逐渐揭示出NK细胞可借助细胞表面的一系列受体识别肿瘤细胞,通过活化性受体与抑制性受体之间的动态平衡,触发自身活性,从而启动杀伤靶细胞的过程[1]。同样重要的是,研究发现NK细胞除了对肿瘤细胞的直接杀伤,还可通过一系列杀伤以外的机制实现对肿瘤的免疫监视效应[2]。然而,早期基于NK细胞的免疫疗法疗效有限,提示我们早期对NK细胞抗肿瘤免疫应答的认知十分缺乏。近年来对肿瘤相关NK细胞的研究,抗肿瘤效应功能受限的机制有了新的阐释。在此,我们应用并延伸了T细胞“免疫耗竭”的概念。NK细胞的肿瘤“免疫耗竭”被定义为在肿瘤发生发展的情况下NK细胞效应功能低下的状态,而该状态往往伴随着NK细胞一系列表型的改变[3]。通过对NK细胞抑制性受体的功能及对NK肿瘤免疫耗竭状态的研究,催生了当前NK细胞卡控点免疫治疗的研究。一系列处于临床或临床前研究阶段的“卡控点”,标志着NK细胞已紧随T细胞的脚步,踏上了“卡控点免疫治疗”的舞台。
1 NK细胞的基本效应功能
NK细胞是宿主免疫的第一道防线,广泛参与到对病原体及恶性肿瘤的免疫防御等过程中[2]。与T细胞不同,NK细胞不需要经过预先致敏即可被激活并发挥效应功能。NK细胞通过细胞表面一系列活化性和抑制性受体之间的平衡,对“自我”与“非我”细胞进行识别和区分,继而触发活性[1]。NK细胞的活化性受体通常识别“压力”诱导型的配体(如活化性受体NKG2D识别人的ULBP及MIC分子,或识别小鼠的RAE1、H60和MULT1分子)、识别因感染而诱导表达的配体(如小鼠NK细胞活化性受体Ly49H识别小鼠巨细胞病毒所编码的m157分子)或识别覆盖在靶细胞上的抗体(通过Fc受体CD16识别抗体Fc段)。而NK细胞的抑制性受体通常识别稳态条件下在自身细胞组成型表达的配体(如通过人的KIR分子或小鼠的Ly49分子识别MHCⅠ类分子),这些配体的表达在压力或其他异常情况下可能发生丢失,从而导致NK细胞接收到的抑制性信号被减弱,触发NK细胞的激活。
NK细胞激活后发生的细胞生物学事件包括与靶细胞形成免疫突触、重构细胞骨架并释放胞内储藏的裂解颗粒,后者所包含的穿孔素与颗粒酶将对靶细胞进行裂解,从而实现杀伤功能[4];NK细胞也可以通过细胞表面表达的FasL和TRAIL等分子与靶细胞上的配体结合,从而诱导靶细胞凋亡[5,6];NK细胞还可以通过分泌效应细胞因子(如IFN-γ和TNF-α),直接抑制靶细胞生长,或通过影响其他免疫效应细胞,来行使效应功能[7-12]。
2 NK细胞在肿瘤免疫应答中发挥重要作用
杀伤活性是NK细胞的特征性效应功能,NK细胞杀伤活性的低下往往与较高的癌症发生率有关[13]。NK细胞通过包括杀伤活性在内的一系列效应功能,在生理环境下对肿瘤的发生发展过程发挥重要的免疫监视作用。
首先,NK细胞公认能在控制血液系统的肿瘤和控制肿瘤发生及转移方面发挥显著作用。比如在发生肿瘤转移的淋巴结里,表征NK细胞杀伤潜能的NK细胞表面活化性受体NKp30及NKG2D的表达水平与肿瘤转移到淋巴结的水平呈现负相关的关系[14],提示NK细胞的杀伤活性在控制肿瘤转移方面发挥重要作用。而来自小鼠模型的证据表明,NK细胞控制肿瘤转移的机制主要是通过穿孔素和IFN-γ,比如在前列腺癌和乳腺癌的肺转移小鼠模型中,穿孔素或IFN-γ缺失的小鼠,其肿瘤肺转移的严重程度,与NK细胞缺失小鼠的肿瘤肺转移水平接近[15,16]。其中,NK细胞所产生的IFN-γ导致肿瘤转移减少的机制,被报道是通过诱导肿瘤细胞产生细胞外基质蛋白纤连蛋白1,对肿瘤造成结构性改变,从而发挥作用[17]。此外,NK细胞产生的IFN-γ还能控制化学物诱导肿瘤的发生[16]。除了IFN-γ和穿孔素,在肝脏中,由于肝脏特有NK细胞高表达TRAIL分子,因而NK细胞也通过TRAIL依赖的方式控制肿瘤对肝脏的转移[18]。NK细胞控制肿瘤转移的机制可能还体现在,由于发生上皮-间质转化的细胞通过诱导表达E-cadherin和CADM1分子,使自身更容易被NK细胞识别杀伤,从而使这些细胞不容易发生转移[19]。
NK细胞不仅能对血液肿瘤和肿瘤发生及转移发挥免疫监视作用,其对实体肿瘤的浸润也影响肿瘤的发生发展过程。比如,头颈癌患者肿瘤局部表征NK细胞标志NKp46分子Ncr1水平较高的患者表现出较好的预后[20];在结肠癌、胃癌、肺癌等实体肿瘤局部,NK细胞的浸润水平也与患者较好的预后相关[21-23]。
近年来,T细胞卡控点免疫治疗的临床应用对NK细胞在肿瘤免疫应答中的重要性有了新的诠释,研究表明NK细胞的抗肿瘤功能还体现在对T细胞抗肿瘤免疫应答及基于T细胞的卡控点免疫治疗的辅助效应上。首先,NK细胞的清除在黑素瘤小鼠模型中会导致荷瘤小鼠外周及肿瘤局部T-bet+CD4+T细胞的减少,肿瘤浸润CD8+T细胞产生效应分子的能力下降,而且表达更高水平的免疫耗竭分子PD-1,而纯化的NK细胞能通过IFN-γ及NKG2D依赖的方式促进Th1细胞的分化,这些证据显示出在肿瘤模型中NK细胞对抗肿瘤T细胞具有重要的辅助效应[24-25]。
这种辅助效应对于T细胞的卡控点免疫治疗具有重要意义。有研究组通过比较应答或不应答PD-1卡控点免疫治疗的肿瘤患者的肿瘤浸润免疫细胞,分析各免疫细胞群体的多少与应答卡控点免疫治疗之间的关系。他们发现应答卡控点免疫治疗的患者肿瘤局部浸润了更多的NK细胞[26]。这个现象不仅表明肿瘤局部NK细胞浸润的多少也许可以作为预测基于T细胞的卡控点治疗疗效的标志物,而且表明NK细胞的存在可以间接影响T细胞的抗肿瘤免疫应答强度。类似证据在小鼠模型中同样被观察到:研究者发现如果用抗NK-1.1单克隆抗体PK136预先注射小鼠以清除NK细胞,则当用抗PD-L1单克隆抗体治疗该荷瘤小鼠时,抗肿瘤的疗效会大打折扣,小鼠生存期显著缩短[25]。因而,NK细胞的存在及其活性,在基于T细胞的卡控点免疫治疗中具有重要的作用。
3 NK细胞免疫耗竭及其机制
尽管NK细胞对肿瘤的发生发展起重要的监控作用,但在肿瘤局部,NK细胞往往处于功能低下的免疫耗竭状态,限制着NK细胞抗肿瘤潜能的发挥。这种功能低下首先表现在NK细胞“数量”的低下。比如,在自发多发性骨髓瘤的小鼠模型中,随着肿瘤的发生发展,NK细胞的比例逐渐下降[27]。其次,NK细胞的“质量”发生下降,体现在杀伤能力与产生效应细胞因子能力的下降。在小鼠黑素瘤模型中,肿瘤局部的NK细胞,和外周NK细胞相比,产生IFN-γ和GM-CSF的水平显著降低[24]。在肝癌及肺癌等肿瘤患者的肿瘤局部也能观察到NK细胞IFN-γ产生水平降低的现象[28,29]。而在乳腺癌、胰腺癌、胃癌及结肠癌等肿瘤患者的肿瘤局部,NK细胞杀伤能力下降[30],伴随着NK细胞表达杀伤相关分子颗粒酶、穿孔素、FasL和TRAIL分子的水平发生下降[31]。在带有肿瘤的宿主体内,NK细胞效应功能的下降会伴随着NK细胞的稳态增殖而快速发生[32]。
NK细胞的肿瘤免疫耗竭还往往与肿瘤局部NK细胞异常表达的受体及其在肿瘤或肿瘤相关的其他细胞上异常表达的配体群谱有关。肿瘤浸润NK细胞会在一些免疫抑制性细胞因子等因素的诱导下,高水平地表达一系列抑制性细胞表面受体,这些受体通过与肿瘤微环境中的配体相互作用,逐渐诱导NK细胞进入效应功能低下的免疫耗竭状态。T细胞的卡控点分子PD-1和CTLA-4诱导T细胞免疫耗竭的机制已得到深入研究。但相比肿瘤浸润的T细胞,肿瘤浸润NK细胞上所表达的T细胞卡控点分子PD-1或CTLA-4的水平很低[25]。相对的肿瘤相关NK细胞特有的“NK细胞卡控点分子”研究,近年来逐渐受到关注。
TIGIT是表达在T细胞和NK细胞表面的抑制性受体,TIGIT可能通过细胞内的ITIM结构域及ITT样结构域转导抑制性信号,或与配体PVR相互作用触发其下游的信号[33],或与活化性受体CD226竞争配体削弱活化性信号,来发挥抑制性效应[33-37]。TIGIT在体外能通过与配体相互作用,抑制NK细胞的杀伤功能和分泌IFN-γ的功能[34,38,39];而在体内,通过调控NK细胞与巨噬细胞、组织细胞、肿瘤细胞等之间的相互作用,负调节NK细胞的效应功能,从而一方面在急性炎症过程中避免过度组织损伤、在损伤后修复再生的过程中使组织修复能正常进行[25,40,41],但另一方面,在抗肿瘤免疫应答过程中,TIGIT却能诱导NK细胞进入免疫耗竭状态[25]。
通过分析结肠癌患者的肿瘤局部NK细胞,研究者发现肿瘤浸润NK细胞和肿瘤旁正常组织NK细胞相比,表达更高水平的TIGIT分子;而在小鼠模型中,TIGIT分子在小鼠肿瘤浸润NK细胞上高水平表达,其表达水平与肿瘤的发生发展及荷瘤小鼠NK细胞低下的功能呈现相关性[25]。TIGIT阳性与TIGIT阴性的肿瘤浸润NK细胞群体相比,TIGIT阳性NK细胞往往伴随着NK细胞效应分子表达水平的下降、细胞表面活化性受体的降低及细胞表面抑制性受体的升高,表明与TIGIT阴性NK细胞相比,TIGIT阳性NK细胞处于功能更加低下的免疫耗竭状态[25]。因而,种种证据显示,TIGIT分子是NK细胞肿瘤免疫应答的“卡控点分子”。
CD96早期被发现介导NK细胞与肿瘤细胞之间的黏附,从而促进NK细胞对肿瘤细胞的杀伤功能[42];但后期CD96-/-小鼠模型的数据显示,CD96的缺失会导致NK细胞被激活时展现出更强的效应功能,而且CD96的缺失使小鼠以NK细胞及IFN-γ依赖的方式,对化学物诱导的癌症表现出更强的抵抗力,从而揭示出CD96是NK细胞表面一个重要的抑制性受体[43]。
肝癌患者肿瘤局部浸润的NK细胞和肿瘤外周组织NK细胞或正常人肝组织NK细胞相比,表达CD96的阳性比例、表达强度及CD96+细胞的数量均显著增加[44]。患者血清中的TGF-α可能介导了CD96表达水平的升高[44]。CD96+NK细胞呈现出功能耗竭的状态,表现为效应分子IFN-γ和TNF-α产生水平的降低,与效应功能相关的基因Tbx21、IL-15、Prf1和Gzmb表达水平下降,而免疫抑制性细胞因子IL-10和TGF-β的基因表达水平升高[44]。重要的是,肝癌患者肿瘤局部高水平的CD96或其配体CD155的表达与较差的疾病预后相关[44]。因而,CD96与NK细胞在肿瘤局部的免疫耗竭状态相关,是肿瘤相关NK细胞另一个备受关注的“卡控点分子”。
在肝癌患者的肿瘤局部,肿瘤浸润NK细胞高表达NKG2A分子,而肝癌组织同时高表达其配体HLA-E分子;肿瘤浸润NKG2A+NK细胞的功能效应分子表达呈现下降的现象,而肿瘤局部NKG2A、HLA-E分子的表达水平与肿瘤患者较差的预后呈现负相关性[29]。这显示NKG2A-HLA-E受配体之间的相互作用与肿瘤的发生发展关系密切,而且介导了肿瘤浸润NK细胞的功能耗竭。肿瘤浸润NK细胞上调表达的NKG2A可能是由肿瘤患者血清中较高水平的IL-10所诱导的,因为肿瘤组织IL-10的mRNA水平和NKG2A+肿瘤浸润NK细胞的比例呈正相关,而且如果在体外用单克隆抗体阻断IL-10,则肿瘤患者血清处理下的NK细胞所诱导的NKG2A水平会有所下降[29]。可见,NKG2A也是表征肿瘤相关NK细胞免疫耗竭状态的一个重要标志。
尽管和以上的抑制性受体相比,PD-1在NK细胞上的表达水平相对较低,仅在病毒感染的过程中在特定组织有较明显的表达[45]。但有研究表明人和小鼠的NK细胞在一些肿瘤微环境或荷瘤宿主的外周血中会上调表达PD-1分子[20]。然而和NK细胞所表达的TIGIT、CD96等抑制性受体不同,肿瘤患者外周血NK细胞PD-1的表达表征着一群效应潜能更强的NK细胞,这些细胞在体外用IL-2刺激,能产生更高水平的IFN-γ和颗粒酶B[20];但是在NK细胞与PD-L1+靶细胞接触的情况下,PD-1分子的下游信号被触发,将使这群NK细胞的功能受到抑制[20]。因而,肿瘤浸润NK细胞上调表达的PD-1分子,在PD-L1表达较高的肿瘤局部,可能呈现出功能低下的免疫耗竭状态。
除了细胞表面受体表达谱的改变,NK细胞的肿瘤免疫耗竭还与NK细胞关键信号通路的改变有关。IL-15的信号对NK细胞的发育、存活及功能具有重要的作用[46,47],而荷瘤小鼠NK细胞的IL-15受体信号通路存在受损的情况,导致NK细胞成熟水平的降低及IFN-γ产生能力的削弱;而IL-15的过表达能逆转这些缺陷[48]。这些证据显示IL-15信号通路的受损是肿瘤相关NK细胞的重要特征,并与NK细胞的免疫耗竭状态关系密切。
4 NK细胞的卡控点免疫治疗
T细胞的卡控点免疫治疗为肿瘤治疗开辟了全新的领域,然而越来越多研究表明肿瘤局部可能存在多种因素限制着T细胞肿瘤免疫疗法的效果,从而使疗效仅能惠及小部分患者[49]。因而,除了T细胞免疫疗法外,有必要研究并开发出替代的免疫治疗策略。基于这样的考虑,再加上NK细胞本身存在强大的抗肿瘤效应潜能,其识别肿瘤的机制与T细胞相比存在差异优势,而且能对T细胞的抗肿瘤应答提供辅助,因而基于NK细胞的免疫治疗在肿瘤免疫治疗研究中逐渐受到关注。其中,通过单克隆抗体靶向NK细胞表面抑制性受体的NK细胞卡控点免疫治疗,得益于相关靶点良好的成药性、单克隆抗体技术的发展及T细胞卡控点免疫治疗的成功,近年来相关研究进展迅速,并逐渐显示出治疗潜力(图1)。
对NK细胞卡控点免疫治疗的探索始于KIR分子。早期对急性髓系白血病患者进行的骨髓移植研究显示,若供体NK细胞的KIR分子与受体MHCⅠ分子匹配时,患者的五年复发率为75%,但KIR与MHCⅠ分子不匹配时患者的五年复发率却降到0[50],该证据表明NK细胞抑制性受体KIR与组成型表达的配体MHCⅠ之间识别的缺失会触发NK细胞的活性,并对该细胞进行排斥,因而有可能通过单克隆抗体阻断KIR分子与MHCⅠ分子之间的识别来调动NK细胞对抗肿瘤效应。在临床试验中,KIR的单独阻断对急性髓系白血病未能显示疗效(NCT01687387),与CTLA-4的联合阻断也未显示比CTLA-4单独阻断更好的疗效(NCT01750580),但当KIR与PD-1联合阻断时,在经化疗无效的晚期头颈癌患者中初步展现出客观缓解率上升的趋势(NCT01714739)。基于KIR的阻断,目前仍有更多的单独或联合治疗研究正在进行中。对新适应证的探索及对已有临床试验数据的进一步挖掘,有望进一步展现阻断KIR这一策略在肿瘤治疗中的潜力。
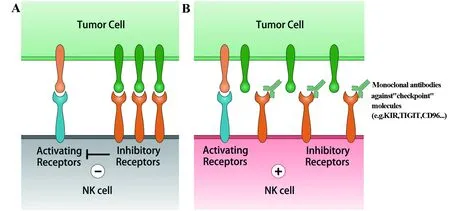
图1 NK细胞的“卡控点”免疫治疗Fig.1 NK-cell checkpoint blockade immunotherapyNote: A.In tumor microenvironment,NK cells highly express inhibitory "checkpoint" receptors. Dominating inhibitory signaling leads to the hypofunctional "exhaustion" status of NK cells,compromising the tumor immunosurveillance by NK cells;B.NK-cell checkpoint immunotherapy employs monoclonal antibodies blocking the interations between "checkpoint" receptors and their ligands,reversing the exhaustion of NK cells,and unleashing the anti-tumor effector functions of NK cells.
与KIR相比,NK细胞卡控点分子TIGIT的表达模式由于呈现出肿瘤相关性,因而阻断TIGIT分子与配体之间识别的治疗策略,有可能在肿瘤治疗中具有独特的表现。在小鼠肿瘤模型中,抗TIGIT的单克隆抗体注射能恢复肿瘤浸润NK细胞的功能指标CD107a、TNF-α和IFN-γ的产生水平,并使结肠癌在小鼠体内生长受到显著抑制,并能在化学物诱癌模型中使诱导成瘤的时间显著延缓,而且能显著抑制乳腺癌细胞的转移[25];重要的是,在缺失T细胞的SCID小鼠中,靶向TIGIT的单克隆抗体也能显著抑制肿瘤生长[25],并伴随着NK细胞产生更高水平的CD107a、TNF-α等效应分子/标志,这说明靶向TIGIT能在不依赖T细胞的情况下,单独依靠逆转NK细胞的耗竭状态激发抗肿瘤效应。
用单克隆抗体中和CD96的功能,在小鼠模型中显著地降低肿瘤的转移,其发挥效应的机制是通过NK细胞、CD226及IFN-γ[51],而不依赖于对CD96-CD155相互作用的阻断效应[52]。当与CTLA-4或PD-1的阻断、Tigit基因的缺失或化疗药物联用时,靶向CD96的治疗效应更加显著[51]。
靶向NKG2A的单克隆抗体,能同时阻断肿瘤浸润NK细胞及T细胞的NKG2A对肿瘤细胞表达的配体HLA-E分子的识别,从而同时调动NK细胞及T细胞的抗肿瘤潜能,并能与PD-L1抗体起协同作用,在小鼠模型中诱导肿瘤的消退、荷瘤小鼠生存率的显著延长[53,54]。目前靶向NKG2A的IgG4单克隆抗体与PD-L1(NCT02671435)或EGFR(NCT02643550)的单克隆抗体联用,分别用于治疗结肠癌或头颈癌的Ⅱ期临床试验正在进行中,最新的临床数据已初步展现出联合用药的协同效应[53]。
因而,通过单克隆抗体阻断NK细胞“卡控点分子”抑制性受体与其配体之间的相互作用,能逆转NK细胞的肿瘤免疫耗竭,解除肿瘤微环境中抑制性信号对NK细胞功能的限制作用,并往往能与现存的T细胞卡控点免疫疗法联合,起协同效应,同时调动NK细胞和T细胞的抗肿瘤效应,从而实现增强的疗效。
5 展望
T细胞卡控点免疫疗法在临床的应用逐步展示了免疫疗法的潜力,但在种种因素的限制下,当前T细胞卡控点免疫疗法只能使小部分患者获益。为了充分调动免疫系统的抗肿瘤潜力,有必要对同样具有强大抗肿瘤潜能的NK细胞进行深入研究。当前NK细胞卡控点免疫疗法在动物模型及临床试验中的证据已经初步揭示出该策略在解除肿瘤微环境中的抑制性信号、逆转NK细胞肿瘤免疫耗竭方面具有显著作用,但我们仍需要更多更深入的研究,才能充分揭示特定卡控点分子的作用机理、适应证及生物标志物,以指导临床用药。随着研究的深入,期待NK细胞的卡控点免疫治疗能充分展示其在肿瘤治疗中的潜力。
