应用二重PCR技术检测肉制品中的肉源性成分
2019-02-18李慧洁蒋会敏贾小同李小艳王利娜尹皓月
李慧洁,蒋会敏,贾小同,李小艳,王利娜,尹皓月,李 铀
(西北民族大学生命科学与工程学院,甘肃兰州 730124)
随着经济的发展,人们的消费水平也逐步提高,消费者对食品的安全性有了更高的要求,在国内及国际贸易中,牛、羊肉中掺杂价格便宜的鼠、猫、兔、猪等肉类,以次充好的欺骗行为屡见不鲜,严重损害了消费者的利益。在穆斯林国家和地区,肉类食品的掺假不仅仅是经济问题,更是宗教问题。在市场中,牛、羊肉中掺杂价格便宜的鼠、猫、兔、猪等肉类,以次充好获取高额利益,加之近年来疯牛病、羊瘙痒症等疾病的出现,肉源性成分的鉴定刻不容缓。随着PCR技术在掺假肉检测中的引入,PCR法、多重PCR法和实时荧光PCR以其高灵敏度和强特异性逐渐成为肉类鉴别的主要分析方法[1-2]。其中,多重PCR法具有反应体系中可扩增出多段目的DNA片段[3]的优势,Tettelin H等人[4]已成功进行了15多对引物的多重PCR。PCR技术是一种用于体外扩增DNA片段的方法,其反应原理类似于 DNA的半保留复制过程,它的特异性表现在与靶序列两端互补的核苷酸引物上。人为地给试管中的待扩增目标DNA样品提供合适的环境条件,如模板 DNA、核苷酸引物、DNA聚合酶和合适的缓冲液体系等反应所需物质,通过控制反应液温度和反应时间实现DNA变性、退火及延伸3个基本过程,然后重复3个反应过程,在若干循环后实现DNA片段呈指数倍扩增。多重PCR技术[5]就是指在单一PCR技术的基础上进行改进的一种技术,是将多条引物和多条模板混合在一个反应体系中分别特异扩增不同的目的条带,或者多条引物和单一的模板DNA混合在同一反应体系中扩增同一模板的不同片断,常用于对超长片断的扩增。和传统单一的PCR技术相比,多重PCR技术具有高效性、系统性和经济简便的特点。
PCR技术具有上述突出优点,人们将这一技术应用到不同的领域,使之迅速发展,取得了巨大的成果,如从事食品病原菌检测的研究人员将这种技术引入到食品检测领域。近年来,基于反应的基本原理,许多学者对PCR技术进行研究和改进,使之得到进一步完善,并在此基础上派生出了许多新的用途[6]。
1 材料与方法
1.1 材料
在市场上购买生鲜的牛肉、猪肉、鸡肉和羊肉,保存于-4℃冰箱中。
1.2 试剂与器材
细胞裂解液、7.8 mol/L醋酸铵,异丙醇,1X TEL,Buffer TE,70%乙醇,dNTPS(2.5 mmol/L),琼脂糖,蛋白酶K(100μg/mL),细胞裂解缓冲液,SDS 10%,胰RNA酶 20μg/mL,TE缓冲液(pH值8.0),酚,氯仿,异戊醇(25∶24∶1),冷无水乙醇,高压灭菌锅,以及PCR相关试剂(Premix Taq Version2.0,Takara,500μL)、PCR 仪 (MyGeneTML Series Peltire Thermal Cycler) 和电泳仪(琼脂糖水平电泳)。
1.3 试验步骤[7-21]
1.3.1 二重PCR反应体系建立
(1) DNA提取。运用Gentra Puregene Extraction Kit(Gentra Systems Inc.)提供的方法提取肉制品混合物DNA,提取的DNA保存在TE溶液里,作为PCR反应的模板。用紫外分分光度计测试DNA浓度。
(2) 引物设计。从文献里分别查到猪(Cytb)、牛 (Cytb)、鸡 (12S rRNA)、羊 (Cytb) 的引物序列,由Takara公司合成(Takara,中国),保存于-20℃冰箱中。
(3) 单重 PCR扩增。
单重PCR中不同动物扩增的目的基因名称与大小、扩增的引物序列、长度和退火递度详见表1,单重PCR反应体系详见表2,单重PCR反应程序详见表3。
1.3.2 二重PCR反应体系的优化
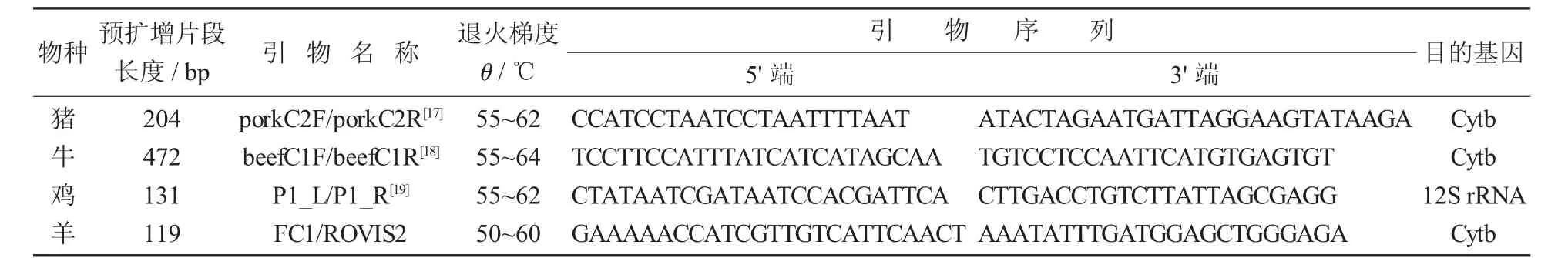
表1 引物的DNA序列、预扩增片段长度、引物名称、退火梯度

表2 单重PCR反应体系

表3 单重PCR反应程序
按照扩增的目标基因大小,将4种动物两两组合,即猪牛、牛鸡、牛羊、猪鸡,猪羊。由于鸡和羊大小近似,不容易区别,因此二重PCR不考虑鸡羊组合。
为获得最佳的二重PCR反应体系,首先尝试了不同的引物浓度、DNA浓度和Premix Taq的浓度,具体PCR反应体系如下:
(1) 2种动物的上、下游引物各为1μL,Premix Taq 12.0μL,2种模板DNA各加3.5μL,ddH2O 2μL,体系总体积为25.0μL。
(2) 2种动物的上、下游引物各为1μL,Premix Taq 12.0μL,2种模板DNA各加6.0μL,ddH2O 2μL,体系总体积为30.0μL。
(3) 2种动物的上、下游引物各为1μL,Premix Taq 12.0μL,2种模板DNA各加3.0μL,ddH2O 3μL,体系总体积为25.0μL。
(4) 2种动物的上、下游引物各为0.5μL,Premix Taq12.5μL,2种模板DNA各加3.0μL,ddH2O4.5μL,体系总体积为25.0μL。
(5) 2种动物的上、下游引物各为0.5μL,Premix Taq 12.0μL,2种模板DNA各加3.0μL,ddH2O 5μL,体系总体积为25.0μL。
同时为获得二重PCR中不同引物组合的最佳退火温度,试验中为每组引物设置55~64℃的温度梯度,因此每组动物需要10个重复,为避免加样时试剂的损失,配置Mastermix时按照12个样本量的试剂量加样。
最佳退火温度的确立——二重PCR反应体系见表2。

表2 最佳退火温度的确立——二重PCR反应体系
2 结果与分析
2.1 二重PCR反应体系建立结果
经电泳结果检测得出,猪、牛、鸡和羊的PCR扩增片段大小分别为204,472,131,119 bp。由于鸡和羊的扩增片段大小过于接近(131和119bp),电泳图上不易区分,因此试验中的二重PCR体系使用了5种动物组合,分别为牛和猪、牛和鸡、牛和羊、猪和鸡、猪和羊。最终确立的二重PCR为25μL体系,包含12.5μL的Premix Taq,每条引物0.4μmol/L,以及每种动物DNA 3~4μL。二重PCR反应条件为预变性94℃ 3 min,35个循环:94℃ 30 s,55℃30 s,72℃ 30 s;延伸72℃ 5 min。
2.2 二重PCR体系优化结果
猪羊、猪鸡二重PCR结果见图1。
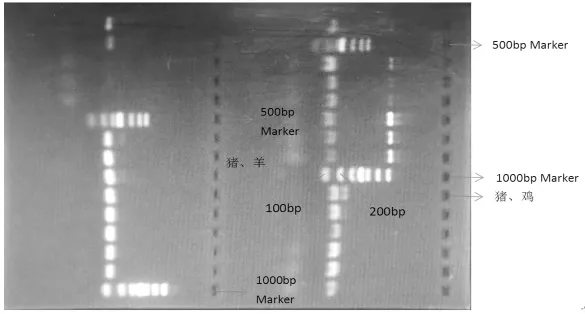
图1 猪羊、猪鸡二重PCR结果
图1 左侧中从上到下,分别是500 bp Marker、猪羊模板DNA 1~8、1 000 bp Marker。从图中清楚可见猪羊模板DNA 1~3均出现了2条不同的明亮条带,说明这3个猪羊DNA扩增较为成功。猪羊模板DNA 4~8均没有出现条带。图中扩增的8个猪羊DNA模板,有3个扩增成功,说明在上述反应体系下扩增,猪羊的二重PCR扩增成功的概率较高,该反应体系可以用于扩增猪羊DNA。
图1右下侧中从上到下,分别是1 000 bp Marker、猪鸡模板DNA 1~6。其中,猪鸡模板DNA1~2出现2条明显不同的条带,图中6个猪鸡模板,有2个扩增成功,说明该反应体系可以用于研究扩增猪鸡DNA。
鸡羊DNA二重PCR结果见图2。
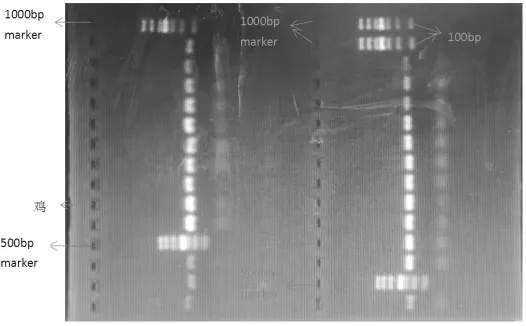
图2 鸡羊DNA二重PCR结果
图2 中所有的1 000 bp Marker与500 bp Marker跑的效果均较好,说明胶片制作效果较好。图2左侧为鸡DNA的扩增结果,DNA条带明亮位于1 000 bp Marker的 100~200 bp,位于 500 bp Marker的 100~150 bp,可以判断出鸡扩增长度为120 bp左右。图2右侧为羊DNA的扩增结果,DNA条带明亮位于1 000 bp Marker的 100~200 bp,位于 500 bp Marker的 100~150 bp,可以判断出鸡扩增长度为130 bp左右。
猪牛DNA,鸡牛DNA,牛羊DNA二重扩增结果见图3。

图3 猪牛DNA,鸡牛DNA,牛羊DNA二重扩增结果
图3 中所有的1 000 bp Marker与500 bp Marker跑得效果均较好,说明胶片制作效果较好。图3左侧为猪牛DNA扩增的DNA条带,从上到下分别为猪牛DNA 1~9,其中猪牛DNA 1~5均只有1条DNA条带,说明这5个的猪牛DNA扩增失败;猪牛DNA 6~9均有2条明亮的DNA条带,说明这4个DNA在该反应体系下扩增较为成功。图3右上为牛羊DNA扩增的条带,从上到下分别为牛羊DNA 1~4,这4个DNA均扩增出了2条明亮的DNA条带,说明在上述反应体系下扩增较为成功。图3右下为鸡牛DNA扩增条带,从上到下分别为鸡牛DNA 1~5,这5个DNA均扩增出了2条明亮的DNA条带,说明在此反应体系下扩增较为成功。
5种动物的二重PCR结果见图4。

图4 5种动物的二重PCR结果
3 结论
运用单重PCR技术扩增牛、猪、鸡、羊的DNA,并对每个样品做梯度PCR,以寻找各对引物最接近的适宜的退火温度,为后期二重PCR试验做准备。猪、牛、鸡、羊的退火温度范围接近,由于鸡羊目的条带大小十分相同,在电泳图上不易于区分,因此在二重PCR时不考虑作为模板DNA。
在二重PCR中通过对PCR反应体系的优化,尤其是针对6种不同的动物模版组合(牛猪、牛鸡、牛羊、猪鸡、猪羊、鸡羊),设置退火温度梯度55~64℃范围后,对6种二重PCR的电泳图进行了比较,最终确立了55℃为最佳退火温度。并且6种动物模版组合中,由于鸡羊组合的目标条带大小近似(119 bp和131 bp),电泳图上不宜区分,因此最终选择了5种二重PCR:牛猪、牛鸡、牛羊、猪鸡、猪羊,其反应体系均为25μL总体积,上下引物各1μL,模版DNA 3~4 μL,Premix Taq 12.5 μL。反应条件为预变性94℃3 min,35个循环:94℃30 s,55℃ 30 s,72℃ 30 s;延伸72℃ 5 min。
引物特异性和融合温度在多重PCR试验中是非常关键的,因其成功取决于在单重PCR条件下引物与其各自靶标选择性退火的能力,包括反应体系、循环次数和退火温度。故引物设计是PCR发展中十分重要的一步,需包含足够的种内保守序列和密切相关的Tm的种间多态性。
快速检测出更多肉品的种类和掺假,仍然是我国学者研究的重点对象,运用多重PCR方法似乎是最为快速的一种方式,它具有极高的准确性,为此希望通过该方法建立一种快速、高效和同时检测肉制品中多种肉源性成分的方法,为肉类掺假提供更为有利的证据。
