铅胁迫对紫藤幼苗生长、生理指标及Pb2+富集的影响
2019-02-15袁菊红陈小娇江灶发
周 敏,袁菊红,陈小娇,江灶发
(江西财经大学 园林系,南昌 330032)
当下土壤重金属污染是一个非常严峻的环境问题,过去50年里,全球排放到环境中的Pb、Zn和Cu分别达783 000 t、135 000 t和93 900 t[1],铅是土壤污染的主要元素之一。可通过食物链进入人体,严重危害到人的身体健康。重金属铅土壤污染修复是环境界研究的热点问题之一。当前的修复技术主要有稳定固化法、物理法和生物法,近年来,植物修复技术因其环保、高效和成本低廉的特点备受青睐,该技术主要注重于超富集植物的筛选。自然界中很多植物无法抵御铅的毒害及吸收铅的能力低下,因大量的铅在植物组织中的累积会引起细胞膜脂过氧化,最终影响植物的生长[2-3],所以已发现的铅超富集植物很少。当前,国内外学者对豆科植物-根瘤菌共生固氮体系的研究和将豆科植物作为先锋植物来对重金属尾矿进行土壤改良及植被恢复非常重视[4]。豆科植物利用与根瘤菌形成的共生固氮体系,具有高固氮能力,可增加土壤有机质含量,改善土壤结构[5]。紫藤是豆科木质大藤本植物,具有生物量大、生长快、寿命长、固氮、耐粗放管理及对气候土壤适应能力强等优点。目前,针对紫藤的相关研究主要集中于栽培、化学成分提取、病理及园林应用方面,在重金属抗性方面鲜见相关研究。因此,本试验以优良的观赏植物紫藤为试验材料,探究不同浓度Pb胁迫对紫藤的生长、生理及Pb富集的影响,以期为紫藤在Pb污染土壤修复中的应用提供依据。
1 材料与方法
1.1 试验材料
供试材料为紫藤。采用当年生成熟种子,播种及幼苗的培育采用Han等[6]的方法,培育于江西财经大学苗圃地。
试验栽培的基质采自江西财经大学苗圃地无污染园土。风干过筛,除去石砾及林草根系。
1.2 试验设计
Pb污染土壤处理,Pb以Pb(NO3)2形式加入,Pb浓度设定为0(CK)、100、200、400、800和1000 mg/kg(Pb浓度配制以每千克土壤中Pb含量为标准),将配制好的Pb溶液均匀倒入等量的土壤基质中,CK以等量的蒸馏水倒入,搅拌均匀,密闭1周,自然风干后备用。试验设计共6个处理,每个处理3次重复。
试验在江西财经大学植物生理实验室进行。试验用盆为12 cm×12 cm的塑料盆,盆内套入双层塑料袋以避免浇水时土壤及Pb液流出。选取生长一致的幼苗(10 cm左右),栽植于盆中,每盆4株。栽后放置在同一自然环境下培养。处理30 d后,对紫藤幼苗进行各项生理指标的测定。
1.3 测定项目与方法
1.3.1 幼苗生长指标
将试验苗剪成地上部分(茎叶)和地下部分(根系),分别称重,干重测定:植物材料于105℃杀青2 h,后于85℃烘干至恒重,称量。
1.3.2 幼苗生理生化指标
叶绿素含量的测定用丙酮提取法,超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑法,过氧化物酶(POD)活性的测定采用愈创木酚法,过氧化氢酶(CAT)活性的测定采用紫外吸收法测定[7],按Jiang 和Zhang的方法制备粗酶液以测定丙二酮(MDA)、谷胱甘肽(GSH)和抗坏血酸(AsA)的含量[8],且均在4℃下进行测量;重金属含量采用HNO3-HClO4消煮法,用火焰原子分光光度计(型号:AAS990)测定。
转运系数(TF)=地上部某重金属含量/地下部某重金属含量
1.4 数据整理与分析
数据统计与分析采用Excel和SPSS13.0统计分析软件进行,并运用邓肯氏新复极差法进行差异显著性分析。
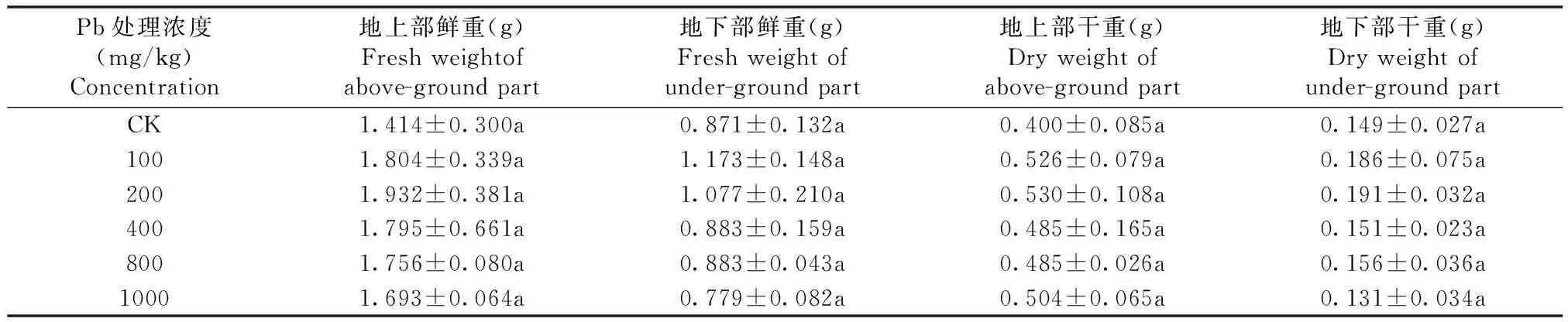
表1 不同浓度Pb胁迫对紫藤干鲜重的影响Table 1 Effects of Pb stress on the dry and fresh weights of Wisteria sinensis
注:数据为平均值±标准差;表中不同小写字母表示0.05水平上差异显著(P<0.05)。下同
2 结果与分析
2.1 不同浓度Pb胁迫对紫藤幼苗生长指标的影响
从表1可以看出,紫藤幼苗干、鲜重均随Pb浓度的升高呈先增后降趋势,差异不显著(P>0.05),地上部干、鲜重在200 mg/kg Pb处理时达最大值,分别是CK的1.37倍、1.33倍。地下部鲜重在100 mg/kg Pb达最大值,为CK的1.35倍,地下部干重在200 mg/kg Pb浓度含量最高,是CK的1.35倍。不同Pb浓度处理下,紫藤幼苗地上部干、鲜重均大于CK,1000 mg/kg Pb处理下,紫藤幼苗地下部干、鲜重均低于CK,分别比CK降低了10.65%、12.01%。说明,高浓度Pb胁迫对紫藤幼苗的根系有一定的抑制作用。
2.2 不同浓度Pb胁迫对紫藤幼苗生理指标的影响
2.2.1 不同浓度 Pb胁迫对紫藤幼苗叶绿素的影响
由图1显示,随着Pb处理浓度的升高紫藤幼苗Chla、Chlb和Cxc含量整体呈先升后降趋势,在100 mg/kg Pb处理下紫藤幼苗Chla、Chlb和Cxc含量达最大值,分别比CK增加了29.70%、14.48%和31.56%,其中Cxc差异显著(P<0.05)。1000 mg/kg Pb处理下,Chlb含量比CK显著降低34.36%(P<0.05),其他处理均高于CK。说明高浓度Pb胁迫对紫藤叶绿素b的合成有显著的负面影响。
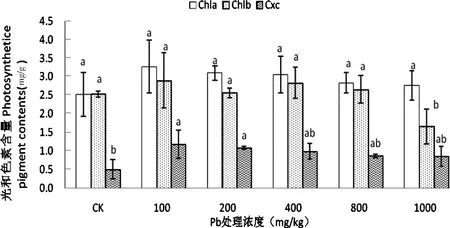
图1 不同浓度Pb胁迫对紫藤叶绿素含量的影响Figure 1 Effects of Pb stress on chlorophyll contents of Wisteria sinensis
2.2.2 不同浓度Pb胁迫对紫藤幼苗MDA含量的影响
MDA是反应脂质过氧化程度重要指标。如图2所示,紫藤幼苗地上部MDA含量随Pb处理浓度的升高呈先升高后降低趋势,差异不显著(P>0.05),在200 mg/kg Pb处理时达最大值,较CK增加8.66%;地下部则呈逐渐升高趋势,在1000 mg/kg Pb处理时达最大值,较CK显著增加36.06%(P<0.05)。说明,随Pb浓度的升高,紫藤根部的膜脂化程度逐渐升高。
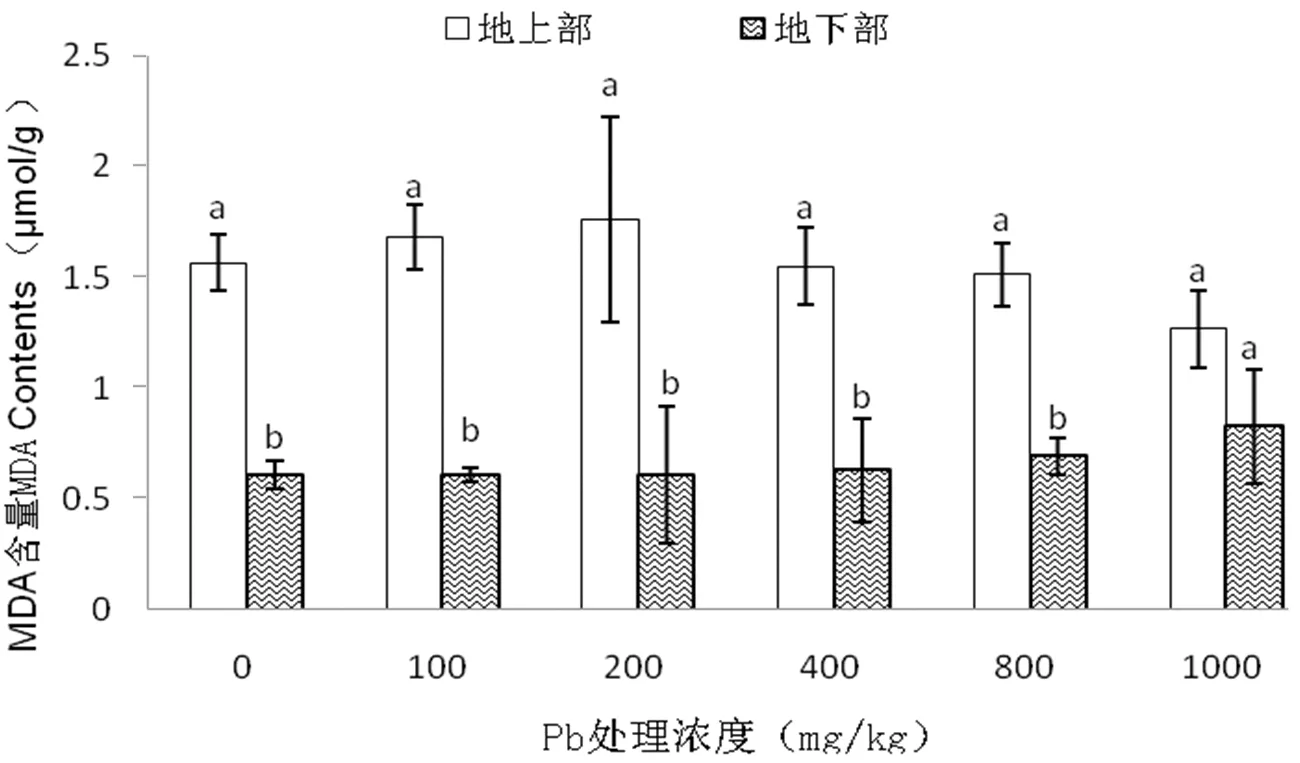
图2 不同浓度Pb胁迫对紫藤MDA含量的影响Figure 2 Effects of Pb stress on MDA of Wisteria sinensis
2.2.3 不同浓度Pb胁迫对紫藤幼苗抗氧化酶活性的影响
由图3显示,不同浓度Pb胁迫下,紫藤幼苗SOD活性均高于CK,地上部SOD活性随Pb浓度的升高而逐渐升高,在1000 mg/kg Pb胁迫下达最大值,较CK增加17.86%(P<0.05),地下部在400 mg/kg Pb处理时SOD活性最高,较CK显著增加99.75%。说明,Pb胁迫对紫藤幼苗SOD活性有诱导作用。
紫藤幼苗POD活性随Pb处理浓度的升高整体呈先升高后下降趋势,且活性均高于CK。地上部在800 mg/kg Pb胁迫下POD活性最高,较CK显著升高91.78%(P<0.05);地下部在400 mg/kg Pb胁迫下POD活性最高,较CK显著升高64.85%。说明,Pb胁迫对紫藤幼苗POD活性有诱导作用。
紫藤幼苗CAT活性随Pb浓度升高呈先升高后下降趋势,地上部CAT活性在800 mg/kg Pb处理下达最大值,是CK的1.79倍,差异显著(P<0.05),地下部CAT活性在100 mg/kg Pb处理下达最大值,是CK的2.20倍,差异显著(P<0.05),1000 mg/kg Pb处理时达最小值,比CK降低10.94%,差异不显著。说明,高浓度Pb胁迫对紫藤幼苗CAT活性有一定的抑制作用。
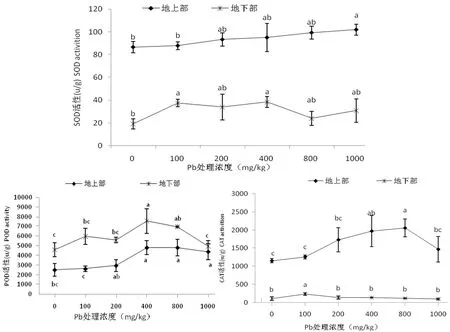
图3 不同浓度Pb胁迫对紫藤SOD、POD 和CAT活性的影响Figure 3 Effects of Pb stress on the activities of SOD,POD and CAT of Wisteria sinensis
2.2.4 不同浓度Pb胁迫对紫藤幼苗AsA、GSH含量的影响
从图4可知,紫藤幼苗地上部AsA含量随Pb处理浓度升高呈先增加后减少趋势,在400 mg/kg Pb处理时含量最大,比CK显著增加7.25%(P<0.05);地下部AsA含量仅100 mg/kg Pb处理下大于CK,比CK增加0.30%,差异不显著(P>0.05),800 mg/kg Pb处理时达最小值,较CK显著降低5.00%(P<0.05)。
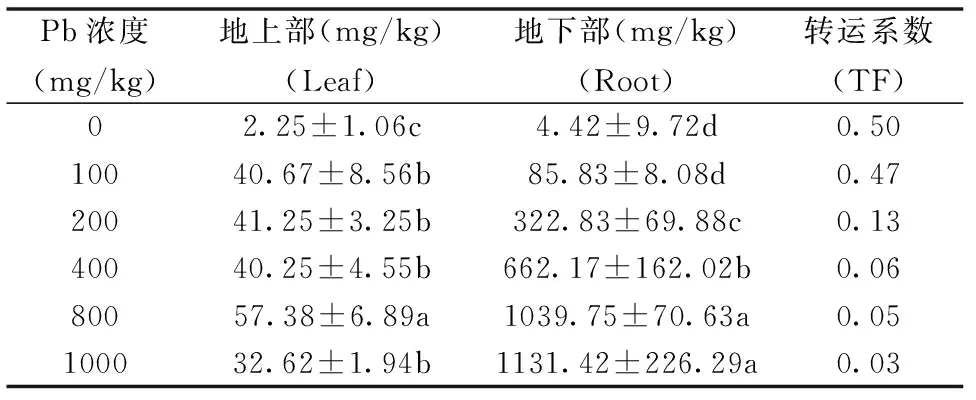
表2 不同浓度Pb胁迫对紫藤幼苗Pb富集转运的影响Table 2 Effects of Pb stress on the Pb contents in Wisteria sinensis
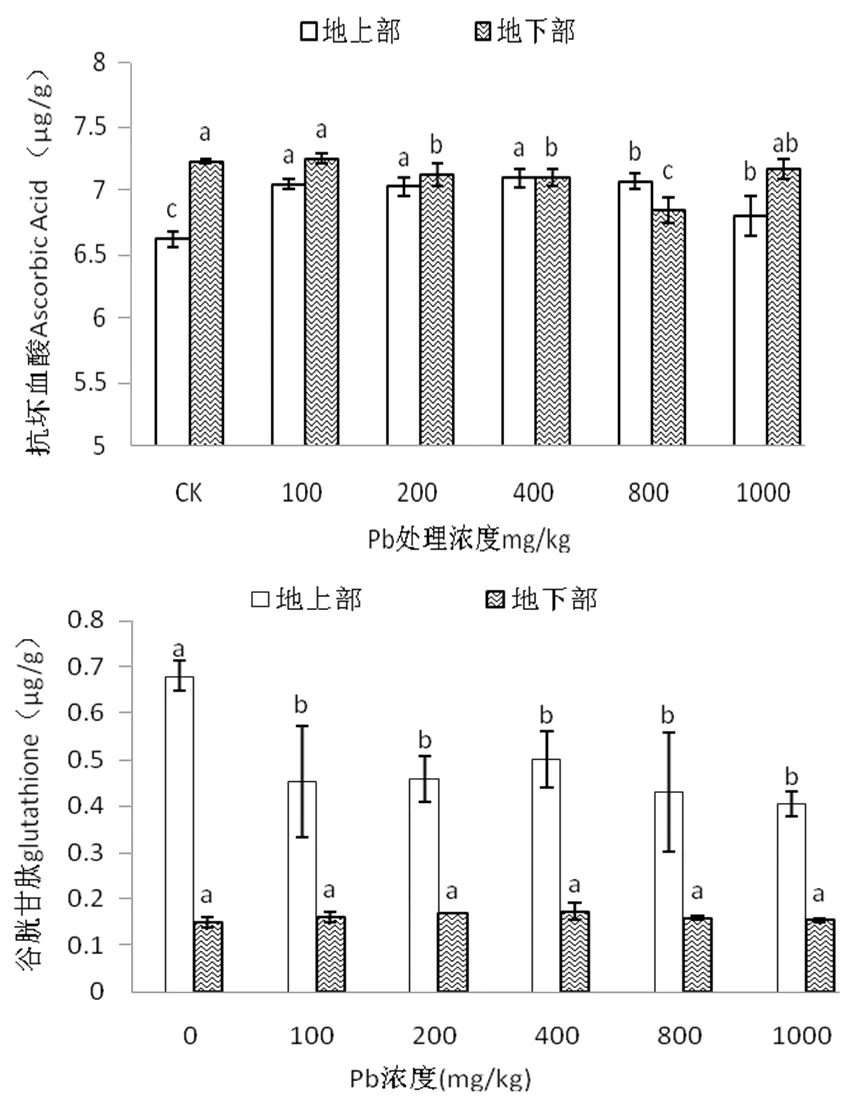
图4不同浓度Pb胁迫对紫藤幼苗AsA、GSH含量的影响
Figure 4 Effects of Pb stress on the contents of ascorbic acid and glutathione inWisteriasinensis
不同Pb浓度处理下,紫藤幼苗地上部GSH含量显著低于CK,且显著高于地下部,地下部GSH随Pb处理浓度的升高呈先增加后减少趋势,在400 mg/kg Pb处理时含量最大,比CK增加15.44%,差异不显著(P>0.05)。说明,外源Pb胁迫显著抑制了紫藤叶片GSH的合成。
2.3 不同浓度Pb胁迫对紫藤Pb富集转运的影响
由表2可知,随Pb处理浓度升高紫藤地上部Pb2+含量呈先升高后降低趋势,在800 mg/kg Pb胁迫下达最大值,是CK的28.50倍,差异显著(P<0.05)。地下部Pb2+含量随Pb浓度升高而逐渐升高,1000 mg/kg Pb处理时达最大值,是CK的256.15倍,差异显著(P<0.05)。紫藤对Pb离子的转运系数随Pb浓度升高而逐渐降低,1000 mg/kg Pb处理下,紫藤的转运系数仅为CK的6.00%。表明Pb2+大量富集于紫藤幼苗地下部,仅少量运转到地上部。
3 讨论与结论
植物体内的Pb含量超过一定阈值,可影响植物的正常代谢和生长,甚至导致死亡。侯晓龙等人研究表明,百喜草能在土壤2500 mg/kg Pb浓度条件下生长[9]。本试验设定的Pb浓度并未对紫藤幼苗正常生长造成明显的影响。Pb浓度低于800 mg/kg对紫藤的生长有一定的促进作用,在1000 mg/kg Pb处理时,对地下部分的生长有一定的抑制作用,但不显著。表明紫藤对Pb胁迫有一定的抗性。
叶绿素作为植物进行光合作用的主要色素,其含量的多少是反映植物叶片光合能力的一个重要指标。夏建国等研究发现,100 mg/kg Pb处理时茶树叶绿素含量有所增加,但在高浓度时显著降低,外观上表现为叶片变黄[10]。俞珊等人研究发现,低浓度Pb胁迫对苦草叶绿素含量有所促进,高浓度Pb胁迫时则呈下降趋势[11]。本试验中,紫藤仅1000 mg/kg Pb处理时,Chlb含量显著低于CK,在100 mg/kg Pb处理下叶绿素含量达最大值。说明,外源Pb浓度低于800 mg/kg对紫藤幼苗叶绿素的合成有一定的促进作用,Pb浓度大于800 mg/kg时显著抑制Chlb的合成。
MDA含量是评价植物在逆境胁迫时受伤害程度的指标。本试验中,紫藤幼苗地上部MDA含量变化不显著,表明本试验设定的Pb浓度并未导致紫藤幼苗叶片细胞发生明显的膜脂过氧化反应,细胞未受到明显伤害,地下部MDA含量随Pb浓度升高而逐渐增加,Pb浓低于800 mg/kg时差异不显著,Pb浓度达1000 mg/kg时,比CK显著增加36.06%。说明,紫藤对Pb的胁迫有较强的抗性,但Pb浓度在达1000 mg/kg时紫藤幼苗根部细胞膜脂化加剧。
生物体自身的保护酶系统能清除自由基、维持细胞膜结构的功能和完整性,进而减轻危害[12]。SOD、POD 和CAT是植物体内生物防御活性氧伤害的重要保护酶类,其活性直接影响活性氧的新陈代谢[13]。高活性抗氧化酶有利于植物受外界胁迫的耐受性提高[14]。本研究中,紫藤地上部CAT和POD活性均随Pb浓度的升高呈先升后降趋势,在800 mg/kg Pb活性最高,地上部SOD活性随Pb浓度的升高而升高,不同浓度Pb处理,紫藤幼苗SOD、POD活性均高于CK,仅地下部CAT活性在1000 mg/kg Pb处理时低于CK。说明,外源Pb胁迫可激发紫藤幼苗SOD、POD、CAT活性,减轻紫藤幼苗受Pb的毒害。
AsA和GSH属于非酶性自由基清除剂,在植物体内代谢过程中起着重要作用,尤其是能抵御活性氧的伤害[15]。本试验中,地上部AsA含量随Pb处理浓度升高呈先增加后减少趋势,且均大于CK,地下部仅100 mg/kg Pb处理时大于CK;地上部GSH含量均显著小于CK,地下部随Pb浓度的升高呈先增加后降低趋势,400 mg/kg Pb处理时达最大值。Pb胁迫下地上部AsA和GSH在变化趋势不同,其原因可能是AsA-GSH循环系统作用的结果。
Han等人研究表明:植物体内重金属大部分都滞留在地下部根中,仅少量运输到地上部,为降低地上部重金属毒害提供良好的屏障[16]。沙文沛等人对香樟幼苗的研究表明,香樟幼苗对Pb的吸收大量累积在根部,只有少量Pb被运转到地上部[17]。本试验结果与之相符,随Pb处理浓度升高紫藤叶片中Pb2+含量先增加后减少,最高达57.38 mg/kg,是CK的28.50倍,地下部Pb2+含量随Pb浓度升高而增加,最高达1131.42 mg/kg,是CK的256.15倍。紫藤幼苗对Pb2+的转运系数在0.03~0.50之间,且随Pb处理浓度升高而逐渐降低。试验表明,紫藤对Pb有一定的富集能力,且大量积累在根部,仅少量运转到地上部。
综合而言,紫藤能在Pb污染浓度达1000 mg/kg的土壤环境中正常生长,且对Pb有较强的耐性和一定的富集能力,因此,紫藤在Pb污染土壤区的实地生态修复值得进一步研究。
