葡萄糖3-脱氢酶工程菌的构建、表达及其合成3-酮对硝基苯井冈霉胺
2019-02-15张建芬
张建芬,柯 薇,陈 虹
(浙江树人大学 生物与环境工程学院,浙江 杭州 310015)
3-酮糖类化合物含有特殊羰基基团,是一种重要的合成砌块,可作为先导化合物,用于选择性合成氨基糖抗体、去垢剂、糖聚合体、食品添加剂和抗氧化剂等,具有广泛的应用前景[1]。糖分子含有多个功能相近的羟基,以此为原料,通过化学反应选择性合成3-酮糖类化合物难度较大,涉及多步的基团保护和去保护反应,而且污染大、能耗高。葡萄糖3-脱氢酶(glucoside 3-dehydrogenase,G3DH,EC.1.1.99.13)是1种以黄素腺嘌呤二核苷酸(FAD)为辅酶的新型氧化还原酶,能氧化吡喃糖上的C-3羟基为酮基[2]。G3DH在3-酮糖类化合物的生物合成中起着重要的作用。目前报道的能生产G3DH的微生物较少,主要有Agrobacteriumtumefaciens[3]、Flavobacteriumsaccharophilum[4]、Halomonas(Deleya)sp.A-15[5]、Cytophagemarinoflava[6]、Agaricusbisporus[7]、Stenotrophomonasmaltrophi-lia[8]和Sphingobacteriumfaecium[9]等,而且,已筛选到的G3DH的酶活性普遍不高,离满足工业生产的实际需求还有一段距离。开发经济高效的基因工程菌株,可解决自然进化的酶催化效率低、副产物多等问题,可以有效地提高生物催化剂的性能。目前,有关基因克隆G3DH的研究报道较少,仅有来自A.tumefaciens[10]和Halomonas[11]的G3DHs实现了在E.coli中的表达,而且活力较低或者表达量不高。自然界中蕴藏着丰富的未被发掘的新型酶资源,随着DNA测序技术的发展和成本的降低,大量微生物基因组信息先后被测定和公开。基因挖掘技术可以从基因组数据库快速发现新的有价值的酶,进一步丰富可被利用或改造的酶资源[12],已吸引了广大科研工作者的关注。因此,基因挖掘新的G3DH酶资源,对于提高G3DH的催化反应效率、拓宽G3DH的应用范围具有重要意义。
3-酮对硝基苯井冈霉胺是3-酮井冈羟胺A C-N裂解酶的酶反应底物,3-酮井冈羟胺A C-N裂解酶是酶解井冈霉素制备井冈胺等糖苷酶抑制剂的关键酶之一,具有重要的研究应用价值。3-酮对硝基苯井冈霉胺可通过G3DH生物转化来制备。Takeuchi等[4]利用F.saccharophilum提取的粗酶液膜蛋白部分转化,得到了3-酮对硝基苯井冈霉胺,作为C-N裂解酶的底物。但是用酶液转化生产存在着酶液制备费时费力,收率低等缺点。项目组前期用S.maltrophilia细胞转化制备3-酮对硝基苯井冈霉胺[13],由于野生菌株同时含有3-酮对硝基苯井冈霉胺裂解酶,会有副产物对硝基苯胺产生,使3-酮对硝基苯井冈霉胺产率下降,也会导致后续产物分离麻烦。随后,项目组克隆了来自Sphingobacteriumfaecium的G3DH,并用于3-酮对硝基苯井冈霉胺的细胞转化法生产[14]。尽管G3DH在合成中的应用前景不可忽视,目前所报道的G3DH酶种类非常有限,基因组挖掘这一方法可以快速发现新的有价值的G3DH。
本研究中,笔者通过基因挖掘的方法表达1种来自Glaciecolapolaris的G3DH,并优化其表达条件,并且用此重组G3DH工程菌细胞转化法生产3-酮对硝基苯井冈霉胺。
1 材料与方法
1.1 菌株、质粒及引物
大肠杆菌(E.coli)DH5α和E.coliBL21(DE3),Novagen公司,克隆质粒pMD19-T、表达质粒pET-28(b),Takara公司。所需引物均由上海生工生物工程有限公司合成。
1.2 主要试剂和仪器
PCR所用试剂,TaKaRa公司;限制性内切酶、T4 DNA连接酶,Fermentas公司;低分子质量标准蛋白、感受态细胞制备试剂盒,上海生工生物工程有限公司;质粒提取试剂盒、PCR产物回收试剂盒、胶回收试剂盒、细菌基因组提取试剂盒,Axygen公司。Bradford蛋白浓度试剂盒,南京建成公司。蛋白胨和酵母粉,OXOID公司。对硝基苯井冈霉胺为实验室合成,参照文献[13]的方法。其他试剂均为市售分析纯。
酶标仪、蛋白纯化仪和镍离子亲和层析柱,美国Bio-Rad公司。
1.3 基因挖掘
在NCBI的“protein”数据库中,以“glucose 3-dehydrogenase”或“glucoside 3-dehydrogenase”为检索词,得到多条不同来源的G3DH序列。采用Clustal W进行G3DH的多序列比对,分析G3DH的保守序列。在ExPASy的ProtParam上,计算G3DH的理论理化特性,排除预测可溶性低的,确定1种来自Glaciecolapolaris的G3DH(命名为GpG3DH)为研究对象。通过jcat对GpG3DH的基因序列进行了在E.coli中表达的密码子优化。在GpG3DH基因两端加上NcoⅠ和XhoⅠ的限制酶识别位点后,由上海生工生物工程有限公司合成。
1.4 工程菌的构建
用NcoⅠ和XhoⅠ酶切处理质粒pET-28(b)和GpG3DH,胶回收载体和GpG3DH基因酶切产物,在16 ℃下,T4 DNA连接酶连接过夜,转化到E.coliBL21(DE3)中,转化子经菌落PCR验证和测序验证后,获得阳性重组菌株E.coliBL21/pET28b-GpG3DH。
1.5 重组酶的表达纯化
将工程菌接种于5 mL含50 μg/mL卡那霉素的LB液体培养基中,于37 ℃、180 r/min振荡培养过夜。取1 mL培养液转接于100 mL含50 μg/mL卡那霉素的LB液体培养基中,于37 ℃、180 r/min振荡培养至OD600为0.8时,向培养物中加IPTG至终浓度为0.1 mmol/L,于16 ℃诱导表达12 h,4 ℃、4 000g离心10 min,收集菌体,并用生理盐水洗涤2次。称取10 g湿菌体,加入20 mL 0.1 mol/L Tris-HCl(pH 8.0)缓冲液悬浮细胞,于冰浴中进行超声波细胞破碎(工作2 s,间隔5 s,工作时间20 min)。4 ℃、8 000g离心30 min,收集上清液作为粗酶液。粗酶液用0.22 μm的滤膜过滤后,利用镍离子层析柱(Bio-Rad,20 mL)对粗酶液进行一步纯化,纯化的酶液经超滤脱盐后用于酶活力测定。
1.6 酶活力测定
在比色皿中加入2.6 mL pH 6.0的0.1 mmol/L的磷酸盐缓冲液,0.1 mL 0.1 mol/L的葡萄糖溶液,0.2 mL 0.4 mmol/L的2,6-二氯酚靛酚溶液,0.1 mL适当稀释的酶液,混匀。以蒸馏水做空白调零,在600 nm下测吸光度减少值。每隔30 s测定,直至3 min。
G3DH酶活力单位定义:1个酶活力单位(U)相当于在上述条件下,于25 ℃、pH 6.0条件下,1 min还原1 μmol 2,6-二氯酚靛酚所需的酶量。
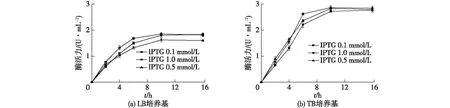
图2 重组酶的表达条件优化Fig.2 Optimization of expression conditions of recombinant enzyme
1.7 3-酮对硝基苯井冈霉胺的细胞转化法生产
在50 mL的小三角瓶中,加入25 mg干质量的菌体,10 mL 50 mmol/L的磷酸盐缓冲液(pH 7.0),充分混合后,加入2 mL 50 mmol/L对硝基苯井冈霉胺,在30 ℃、100 r/min水浴摇床中开始反应。每隔一段时间,取出0.5 mL用于检测3-酮对硝基苯井冈霉胺的含量。
1.8 底物和产物的分析方法
对硝基苯井冈霉胺、3-酮对硝基苯井冈霉胺和对硝基苯胺的浓度用高效液相色谱法(HPLC)分析。细胞转化液经12 000 r/min离心10 min后,上清液用0.22 μm的滤膜过滤后,经高效液相色谱分析,采用的是C18反相柱,25%的乙腈水溶液作为流动相,流速为1 mL/min,在398 nm下紫外检测分析。
2 结果与讨论
2.1 表达质粒pET28b-GpG3DH的构建
构建所得重组质粒pET28b-GpG3DH,经NcoⅠ和XhoⅠ酶切后,结果见图1。由图1可知,重组质粒中含有目的条带,约1.68 kb,与预测一致。质粒测序验证正确,说明重组质粒构建成功。
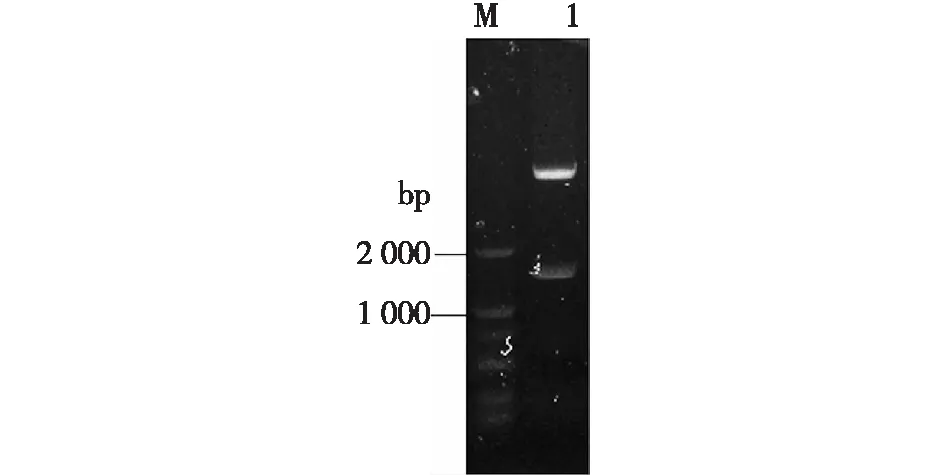
M—标准DNA; 1—酶切质粒DNA图1 重组质粒pET28b-GpG3DH双酶切电泳图Fig.1 Electrophoresis of double digests of recombinantplasmid pET28b-GpG3DH
2.2 重组酶的表达条件优化
在不同的培养基(LB培养基和TB培养基)下,分别加入终浓度为0.10、0.50和1.00 mmol/L的IPTG,16 ℃下诱导表达16 h。每隔2 h取样分析,结果如图2所示。由图2可知,相对于LB培养基,在TB培养基下培养,重组酶的活力更高。此外,IPTG的用量为0.1~1.0 mmol/L时,重组酶的活力影响不大。因此,确定最佳的GpG3DH表达条件:37 ℃培养至OD600为0.8时,加入IPTG至终浓度为0.5 mmol/L,16 ℃诱导表达10 h。在此条件下,GpG3DH的酶活力达到2.83×10-2U/mL。酶活力比已发现的G3DH略低[3-9],后续可以通过定向进化等分子改造手段提高GpG3DH酶活力。
2.3 基因GpG3DH的表达结果
葡萄糖3-脱氢酶基因GpG3DH的表达情况不好,优化表达条件并没有大幅度增加GpG3DH的可溶表达,表达结果如图3所示。由图3可知,G3DH的分子量为5.5×104。据报道,已发现的G3DH的分子量在5.5×104~6.8×104[3-9],GpG3DH的分子量与文献[3-9]报道一致。于是GpG3DH的催化反应采用E.coilBL21/pET28b-GpG3DH全细胞反应体系。

1,4—对照实验(不加IPTG诱导);2—菌体破碎液的上清;3—菌体破碎液的沉淀;M为标准蛋白图3 GpG3DH的SDS-PAGE电泳Fig.3 SDS-PAGE electrophoresis of GpG3DH expression
2.4 3-酮对硝基苯井冈霉胺的细胞转化法生产
采用重组菌细胞转化法生产3-酮对硝基苯井冈霉胺。3-酮对硝基苯井冈霉胺的产率Y3-KpNPV用式(1)定义。
Y3-KpNPV=C3-KpNPV/CpNPV,0
(1)
式中:C3-KpNPV表示表示任一时段3-酮对硝基苯井冈霉胺的浓度。
将菌体在不同浓度EDTA(1、5、10、15、20和40 mmol/L)的细胞转化体系下反应。24 h后检测对硝基苯井冈霉胺以及3-酮对硝基苯井冈霉胺的含量,结果如图4所示。
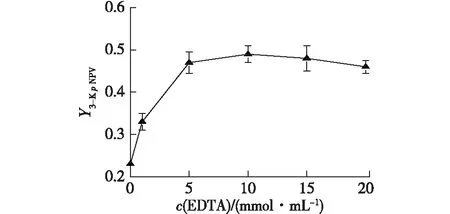
图4 EDTA浓度对3-酮对硝基苯井冈霉胺生成的影响Fig.4 Effect of EDTA concentration onN-p-nitrophenyl-3-ketovalidamine
从图4可以看出,随着EDTA浓度的增加,3-酮对硝基苯井冈霉胺的产率逐渐增加。可见,用EDTA处理细胞,能使目标产物3-酮对硝基苯井冈霉胺的产率大大增加。据文献[13-14]报道及前期的研究结果,用EDTA处理细胞,能提高G3DH催化糖及其衍生物的转化率,降低副产物的产率。对于天然酶,EDTA还能抑制Ca2+依赖的3-酮对硝基苯井冈霉胺降解酶活性。本文的研究结果与前期研究结果[13]一致。重组菌E.coilBL21/pET28b-GpG3DH虽不含3-酮对硝基苯井冈霉胺降解酶,但是,EDTA能够去除外膜蛋白的脂多糖,使得细胞膜的通透性增加[4]。细胞经EDTA处理后,生成的中间产物3-酮对硝基苯井冈霉胺容易及时地到达外环境,这样就使得被裂解为对硝基苯胺的几率大大降低。当EDTA浓度大于10 mmol/L时,3-酮对硝基苯井冈霉胺的产率有所下降,其原因可能是高浓度的EDTA存在对酶有抑制作用。因此,确定细胞转化体系中,最佳的EDTA用量为10 mmol/L。
考察不同的pH条件下,对硝基苯井冈霉胺转化为3-酮对硝基苯井冈霉胺的产率。菌体先用10 mmol/L EDTA 处理,在30 ℃、100 r/min条件下转化 24 h,结果见图5。

图5 pH对3-酮对硝基苯井冈霉胺合成的影响Fig.5 Effect of pH on N-p-nitrophenyl-3-ketovalidamine
从图5可以看出,在pH 7.5时,3-酮对硝基苯井冈霉胺的产率最高。因此,确定细胞转化体系中,pH为7.5。
考察不同的温度(20、25、30 ℃)下,对硝基苯井冈霉胺转化为3-酮对硝基苯井冈霉胺的产率。以对硝基苯井冈霉胺和3-酮对硝基苯井冈霉胺的浓度对转化时间作图,结果如图6所示。
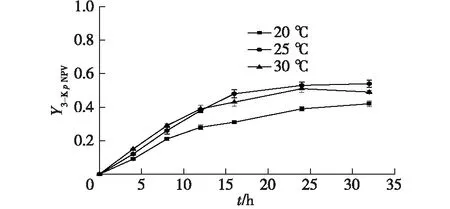
图6 温度对3-酮对硝基苯井冈霉胺的合成影响Fig.6 Effects of temperature on N-p-nitrophenyl-3-ketovalidamine
从图6可以看出,在不同温度下的曲线形状大致相同。在转化初期,随着温度的上升,转化速率呈上升的趋势,其可能的原因是随着温度的升高,细胞膜的通透性增加,使得化学物质容易进入细胞质。因此,对硝基苯井冈霉胺容易通过细胞膜,产物容易通过到达细胞外。转化12 h后,在30 ℃下,3-酮对硝基苯井冈霉胺的产量增加较缓慢。因此,笔者选择25 ℃为最佳的3-酮对硝基苯井冈霉胺转化温度。在25 ℃、 pH为7.5的反应条件下转化32 h,3-酮对硝基苯井冈霉胺的产率(Y3-KpNPV)可以达到0.54。在前期研究中[14],S.faecium菌的G3DH的最佳转化条件为30 ℃、 pH为7.6,与本文的结果相近。
3 结论
采用基因挖掘技术,一种来自于Glaciecolapolaris的葡萄糖3-脱氢酶基因被发现,并进行了GpG3DH基因工程菌的构建和表达。表达质粒pET28b-GpG3DH被成功构建,并在E.coliBL21(DE3)中实现部分可溶表达。经镍柱纯化和电泳检测,G3DH的分子量为5.5×104。随后,优化了GpG3DH的表达条件,结果表明,相对于LB培养基,TB培养基能显著提高G3DH酶活力。重组菌在37 ℃培养至OD600为0.8时,加入IPTG至终浓度为0.5 mmol/L,16 ℃诱导表达10 h,GpG3DH的酶活力达到2.83×10-2U/mL。最后,将重组菌细胞用于转化对硝基苯井冈霉胺生产3-酮对硝基苯井冈霉胺的研究,最佳的转化体系为EDTA 10 mmol/L、pH为7.5、25 ℃,转化32 h,3-酮对硝基苯井冈霉胺的产率(Y3-KpNPV)为0.54。相比较于来自Sphingobacteriumfaecium的重组菌,本实验3-酮对硝基苯井冈霉胺的产率略低。后续可以通过酶定向进化、定点突变等分子改造手段提高GpG3DH酶活力。
