CYP116B家族单加氧酶的发现、表征及分子改造研究进展
2019-02-15李仁结许建和郁惠蕾
李仁结,张 龑,许建和,郁惠蕾
(华东理工大学 生物反应器工程国家重点实验室,上海 200237)
单加氧酶利用一些有机辅因子将电子传递给O2分子实现O2分子的激活,从而在底物中引入单个氧原子。单加氧酶需要的主要辅因子包括金属离子、亚铁血红素(hemes)、黄素(flavins)和吡咯喹啉醌(pyrroloquinolinequinone,PQQ)[1-2]。亚铁血红素依赖的单加氧酶也被称为细胞色素P450单加氧酶(cytochrome P450 monooxygenases,CYPs)或P450s(EC 1.14.13-15.x),在许多生物体中都存在,包括真核生物(哺乳类动物、植物和真菌)和原核生物(蓝细菌、细菌、放线菌、螺旋体和支原体)[3]。它们的命名源于还原态亚铁血红素和CO结合后在450 nm处产生强烈的吸收。这一特殊的强吸收峰也被用来测定CYPs的浓度[4]。P450单加氧酶可以催化多种氧化反应,包括未活化C—H键的羟化、硫醚的氧化、烯烃环氧化和O-脱烷基化,并具有较高的化学、区域及立体选择性。这类酶通常具有还原酶结构域和氧化酶结构域,并呈现不同的拓扑特征。典型的代表就是单一组分的P450BM3,而CYP116B亚家族中的单加氧酶,其氧化还原伴侣与氧化酶结构域也融合在单一肽链上,依据新颖的还原伴侣可以实现电子的自给自足。目前,通过蛋白质进化这类酶已经可以有效催化特殊的反应,例如反马氏加成反应。本文中,笔者主要从CYP116B家族单加氧酶的发现、表征、分子改造及结构功能关系等方面综述了CYP116B在生物催化领域的研究进展,以期为相关研究者提供参考。
1 P450单加氧酶的分类
CYPs被发现以来得到了广泛关注和深入研究,而其分类方法也有许多种。目前,被广泛认可的1种分类方法是基于其电子传递系统的不同,将CYPs分为典型的5类[5],如图1所示。
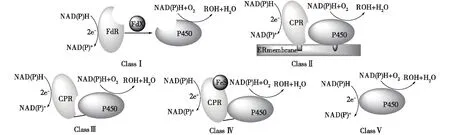
图1 P450单加氧酶基于氧化还原配体的分类[5]Fig.1 Classification of P450 monooxygenases based on the redox parters[5]
ClassⅠ为三组分体系,存在于大部分细菌和线粒体中。3个组分包括含有Fe-S簇的铁氧还蛋白(ferredoxin,Fdx)、含有FAD的铁氧还蛋白还原酶(ferredoxin reductase,FdR)和含有亚铁血红素(heme)的P450氧化酶。其中,在Fdx中的Fe-S簇种类繁多,包括[2Fe-2S]、[3Fe-4S]和[4Fe-4S]等。在反应过程中,由FdR将电子从NAD(P)H传递给Fdx,Fdx再将电子传递给P450氧化酶。ClassⅠ家族CYPs的典型代表为来自恶臭假单胞菌(Pseudomonasputida)的P450cam-Pdx-PdR[6-7]。
ClassⅡ和ClassⅢ存在于大部分真核生物微粒体和某些细菌中。以含有辅因子黄素腺嘌呤二核苷酸(FAD)和黄素单核苷酸(FMN)的NAD(P)H细胞色素P450还原酶(NAD(P)H cytochrome P450 reductase,CPR)作为电子传递蛋白。其中,ClassⅡ存在于真核生物中,该电子传递蛋白结合在细胞膜上,在反应过程中,由CPR将电子从NAD(P)H传递给P450氧化酶[8]。ClassⅢ存在于细菌中,只有1条融合的可溶性多肽链,该多肽链含有双功能结构域,即含有血红素辅基heme的P450酶结构域和含有辅因子FAD和FMN的双黄素还原酶结构域,2个结构域之间由一段短的蛋白质连接肽(linker)连接。在反应过程中,不需外加辅助的电子传递蛋白,电子即可在分子内部传递,是1种电子自给自足的催化体系。这一特征也使得ClassⅢ家族的CYPs电子传递效率更加高效,从而促进了反应的进行。其典型代表为来自巨大芽孢杆菌(Bacillusmegaterium)的P450BM3[9]。
Class Ⅳ是一种单组分的CYPs体系,该家族的CYPs含有和ClassⅠ相同的组分,但区别在于该家族CYPs中的3个组分和ClassⅢ家族一样在1条融合的多肽链上。最初发现于红球菌Rhodococcussp.NCIMB 9784(CYP116B2或P450Rhf),笔者所在实验室前期从土壤中筛选到的红球菌(Rhodococcussp.)ECU0066[10]中克隆得到1个硫醚单加氧酶P450SMO[11],它和P450Rhf的序列一致性为73%,并且对一系列硫醚底物具有良好的催化活力及立体选择性。
ClassⅤ是一种不常见的CYPs,存在于一些真菌中,一氧化氮还原酶(P450nor)参与反硝化反应[12]。
2 CYP116B家族酶的特征和发掘
2.1 CYP116B家族单加氧酶的特征
CYP116B家族单加氧酶属于第 Ⅳ 类单加氧酶,含有和第 Ⅰ 类相同的组分,即包括含有Fe-S簇的铁氧还蛋白(Fdx),含有FAD的铁氧还蛋白还原酶(FdR)和含有亚铁血红素(heme)的P450氧化酶,但区别在于该家族的CYPs中3个组分和第 Ⅲ 家族一样在1条融合的多肽链上。在此体系中,N端的P450功能域与含辅因子FMN的还原酶功能域相连,再与C端的铁硫蛋白相连,其电子传递路径与第 Ⅲ 类酶类似,也是在蛋白分子内部完成。首先,NADPH和还原酶结构域结合,并将电子传递给辅因子FMN,然后还原态的FMN将电子转移给Fe2S2中心,Fe2S2中心最后将电子转移给heme结构域的卟啉环。但是由于直至目前尚无该家族CYPs的蛋白结构报道,所以其不同结构域之间电子传递过程的细节尚未知。
2.2 CYP116B单加氧酶的发掘
由于新颖的氧化还原伴侣与氧化酶结构域融合在单一肽链上,所以CYP116B亚家族中的单加氧酶可以实现电子的自给自足,其氧还伴侣包含特殊的FMN和Fe2S2,为整个P450系统提供相应的还原力,如图2所示。
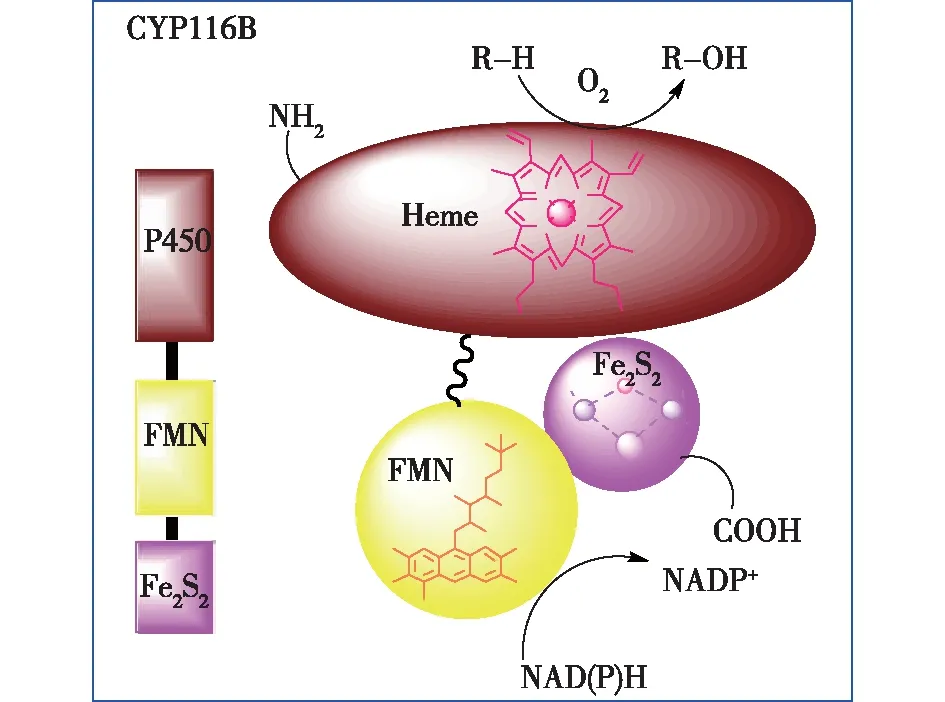
图2 细胞色素P450116B亚家族成员酶的拓扑结构Fig.2 The topology structure of CYP116B monooxygenase
目前,已经报道的该家族成员包括:CYP116B1[13]、CYP116B2(P450RhF)[14]、P450SMO[11]、CYP116B3[15]、CYP116B4(P450Lamo)[16]、CYP116B5[17]、P450RpMO、P450ArMO、P450CtMO[18],CYP116B62[19]以及耐热成员CYP116B29、CYP116B46、CYP116B63、CYP116B64和CYP116B65[20],如表1所示。

表1 已报道的CYP116B单加氧酶举例
笔者所在课题组从2009年起开展了对CYP116B家族单加氧酶的发现及合成应用方面的研究工作,发现了包括P450SMO和P450LaMO在内的多个酶。最早是针对小分子硫醚类底物,从土壤中筛选到了1株红球菌Rhodococcussp.ECU0066,它不仅能够高对映选择性地将硫醚氧化成手性亚砜,而且还可以对外消旋的手性亚砜进行对映体拆分[10]。从红球菌Rhodococcussp.ECU0066中通过染色体步移技术克隆得到起催化作用的关键酶P450SMO[11]。以P450SMO为模板,从基因组文库中挖掘得到了一系列CYP116B家族单加氧酶成员,其中来自LabrenziaaggregataIAM 12614的P450LaMO展现出优异的催化特性,底物谱研究表明P450LaMO不仅表现出羟化和环氧化活力,而且具有脱烷基和不对称亚砜化活力[16]。通过指纹图谱分析发现P450LaMO对以1,2,3,4-四氢萘为核心结构的衍生物具有较高的催化活性[18]。
3 CYP116B单加氧酶催化的反应
目前为止,CYP116B亚家族成员酶可以催化反应的类型主要包括羟化[14,16]、硫醚氧化[11]、O-脱烷基[13]、N-脱烷基[13]和环氧化[14,16]等,如图3所示。催化的底物也主要是苯衍生物以及烷烃类化合物。对于单萜类、多萜类以及甾体类底物并没有表现出比较好的活力。目前还没有报道这类酶的天然底物。典型代表来源于红球菌(Rhodococcussp.)的P450RhF和来源于团聚拉布伦茨氏菌(Labrenziaaggregata)的P450LaMO可以催化多种苯衍生物的氧化功能化,表现出比较好的底物特异性。特别是P450LaMO可以催化多个氧化反应,包括羟化反应、烯烃环氧化、脱烷基化和硫醚氧化反应。

图3 CYP116B 亚家族成员酶催化反应的类型Fig.3 Biocatalytic reactions types of CYP116Bmonoxygenases
3.1 羟化反应
P450LaMO催化苯基烷类底物的羟化反应(图4),产物多为S-构型的醇,但是对映选择性88%~99%,转化率24%~40%。同时,反应过程中会有过氧化副产物酮生成。反应过程中存在的问题是转化效率不高,对映选择性也没有高至99%[16],所以需要通过分子进化进一步提高其活力和对映选择性。

图4 P450LaMO催化苯基烷类底物的羟化反应[16]Fig.4 Hydroxylation of alkylbenzenescatalyzedby P450LaMO[16]
3.2 脱烷基反应
这类酶中多数成员酶可以催化O-脱烷基反应。P450LaMO对于对硝基苯甲醚具有很好的催化活力,相比于7-甲氧基香豆素,P450LaMO对7-乙氧基香豆素的催化活力更高。当引入杂原子时,脱烷基活力下降明显。说明脱烷基活力受到非烷基部位电负性的影响,具体如图5所示。脱烷基活力常常可以作为其他氧化反应的指示反应。
3.3 烯烃环氧化反应
P450LaMO催化烯烃环氧化的同时也有反马氏加成的产物生成。转化率40%~77%,化学选择性均小于20%,具体如图6所示。该反应是自然界不存在的反应,美国Arnold课题组的Hammer等[22]利用随机突变与迭代饱和的突变方式使其化学选择性明显提高(图7),这是之前的天然酶所不能实现的,同时也说明定向进化可以让化学上难以实现的反应成为可能,这也进一步拓宽了P450单加氧酶应用的范围。

图5 P450LaMO催化醚类底物的O-脱烷基反应[16]Fig.5 O-dealkylation of etherscatalyzed by P450LaMO[16]

图6 P450LaMO催化的烯烃环氧化反应[16]Fig.6 Alkene epoxidation catalyzed by P450LaMO[16]
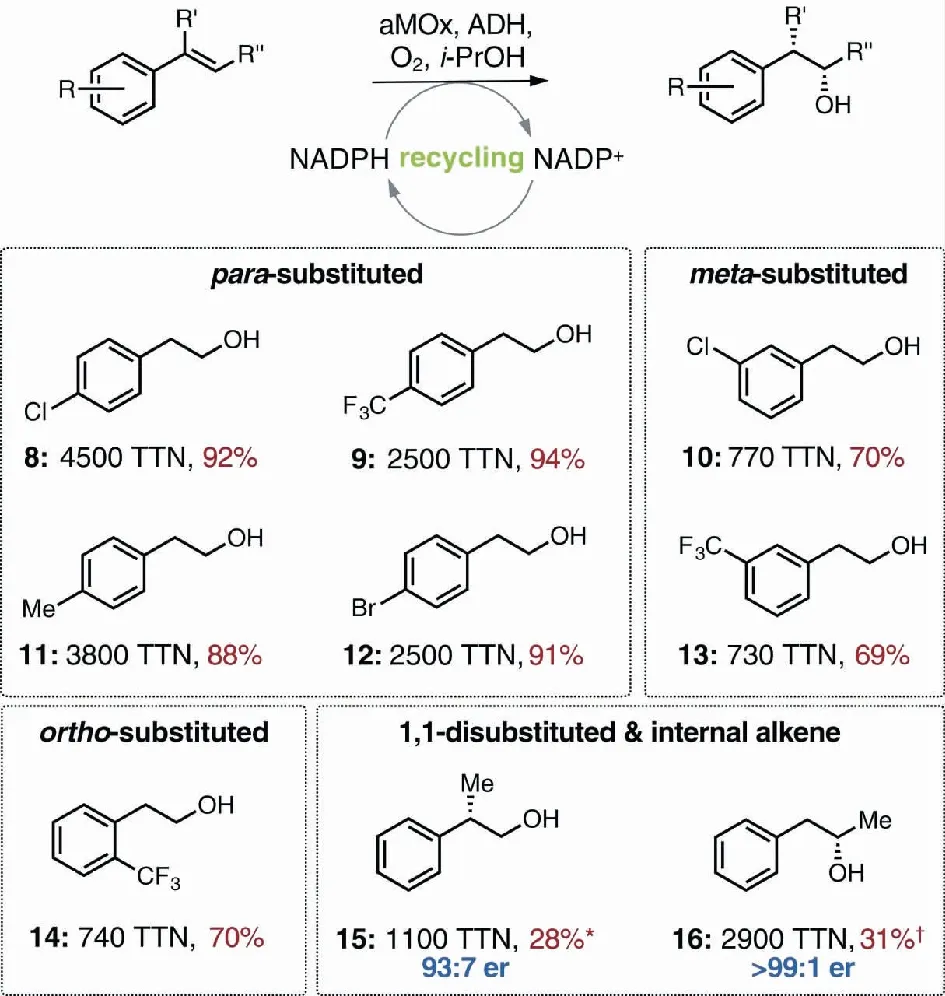
图中各百分数是反马加成产物的比例; *代表其主产物是环氧化物,有少量烯丙位氧化副产物(<8%);†代表其主产物是环氧化物,有少量烯丙位氧化副产物(<1%)图7 P450LaMO催化的烯烃反马氏加成反应[16]Fig.7 Anti-Markovnikov addition catalyzed by P450LaMO[16]
3.4 硫醚氧化反应
P450LaMO催化这类底物的反应相对于另外几类反应有较高的转化活力。对映选择性70%~99%,转化率58%~98%,并且反应产物的构型均为S-构型,如图8所示。手性产物受到基团电负性的影响,当基团为供电子基团时,其转化率要低于吸电子基团的化合物。当基团为噻吩基时,转化率下降为70%。

图8 P450LaMO催化的硫醚氧化反应[16]Fig.8 Sulfoxidation catalyzed by P450LaMO[16]
在这个酶表征的过程中发现,P50LaMO展现出一定的催化多样性,也为后续的分子改造提供了非常好的模板,通过分子进化可以使酶的性能朝着设计需要的方向进行。
4 CYP116B单加氧酶的分子改造
在蛋白结构未知的情况下,进行理性的分子改造显得比较困难。同时由于这类酶对于非天然底物的活力不高,所以这使得建立针对活力低突变库的高通量筛选方法变得不是很容易。目前关于CYP116B亚家族成员酶蛋白质改造的报道还较少。2010年,Urlacher课题组的Liu等[23]对CYP116B3脱烷基的活力进行改造,因为需要提高的是对7-乙氧基香豆素的脱乙基活力,可以直接利用荧光方法进行高通量筛选。主要是在heme部分进行随机突变,筛选的结果是脱乙基活力提高了240倍,效果非常明显。2017年,Arnold课题组的Hammer等[22]报道了定向进化P450LaMO高选择性地实现反马氏加成反应,产物是苯基环氧乙烷和苯乙醛。利用Purpald染料与苯乙醛特征性的显色进行高通量筛选,筛选的最终结果是活力提高了38倍,化学选择性也提高至82%。笔者所在课题组的Li等[24]以P450LaMO为模型采用跨域重组(transdomain combination mutation,TDCM)策略提高其催化四氢萘衍生物的电子偶合效率和比活力,如图9所示。通过将全长蛋白近似均分为2个部分,分别为氧化酶结构域和还原酶结构域,引入突变到对2个结构域并分别建立NBT-PMS的显色高通量筛选方法和7-乙氧基香豆素的荧光方法进行筛选。最终,通过重叠延伸将2个部分的点引入到突变体中实现催化性能的改善,最终电子偶合效率提高9.1倍左右,转化频率提高10倍。
为了提高P450LaMO的对映选择性,我们设计针对底物性质的改造策略,即以苯丙氨酸扫描为基础的迭代饱和突变实现四氢萘醇对映选择性的提高和产物选择性的提高[25]。利用相应的选择性筛选方法(图10)以提高其选择性,最终的突变体对映体选择比为98∶ 2,产物选择性为99∶ 1,说明这一策略可以用于选择性的提高。

图9 跨域重组分子改造P450LaMO[25]Fig.9 Protein engineering P450LaMO based on transdomain combination mutagenesis[25]

CPCR为来源于Candida parapsilosis的脱氢酶;SCO2为来源于Streptomyces coelicolor的脱氢酶图10 P450LaMO对映选择性的筛选方法[25]Fig.10 Enantioselectivity screening assay of P450LaMO[25]
5 总结及展望
这类酶的催化混乱性为其定向进化提供了良好的模板[21],甚至可以作为除P450BM3之外的又一代表性P450单加氧酶。随着基因工程的快速发展,多个CYP116B家族成员被克隆表达,酶的获得已不再是限制其应用的主要因素。将CYP116B进一步应用于工业生产的限制性因素主要还是其稳定性和催化活力。基于晶体结构的底物谱拓展以及操作稳定性的分子改造,都将会为今后CYP116B的深入研究提供有力的支撑。同时,这类酶具有催化非天然反马氏加成反应的潜能,因此可以作为探索更多新反应的重要研究对象。
