miR-16通过靶向调控YAP1基因表达影响肺癌细胞的增殖
2019-02-15周芸张筠楼玉凤方力争
周芸 张筠 楼玉凤 方力争
(1浙江大学医学院全科医学科,浙江 宁波 310058;2宁波大学医学院附属医院呼吸内科;3浙江大学医学院附属邵逸夫医院全科医学科)
虽然随着治疗技术手段的不断发展,但肺癌的远期生存率仍没有显著提高。因此,提高肺癌的早期诊断、早期治疗具有重要意义〔1,2〕。miRNA能够通过负性调控靶基因转录,进而参与细胞的增殖、分化、凋亡等多种生物学过程。大量学者通过miRNA芯片技术、微阵列技术、荧光定量PCR等技术手段证实了肺癌肿瘤组织、血浆中存在着多种miRNA的差异性表达,并提示miRNA是肺癌早期诊断的有效指标〔3,4〕。miR-16是较早发现的一种抑癌miRNA,在包括肺癌在内的多种肿瘤组织中低表达,但在肺癌发生发展过程中的具体机制尚未明确〔5,6〕。同时,miRNA在细胞生物学中的作用几乎都是通过调控靶基因表达来实现的。因此,本研究将探讨miR-16对肺癌细胞增殖、凋亡的影响及对相关靶基因的调控作用。
1 材料和方法
1.1细胞株 肺腺癌细胞A549、H1050、H1299,肺鳞癌细胞NCI-H520、NCI H596及人胚肺细胞MIRC-5均购于中国科学院上海细胞库。
1.2主要试剂和仪器 兔抗人Yes相关蛋白(YAP)1及磷酸甘油醛脱氢酶(GAPDH)单克隆抗体均购于美国Cell Signal Technology公司;二喹啉甲酸(BCA)蛋白测定试剂盒,Hoechst33258染色试剂盒均购于南京凯基生物技术有限公司;Trizol总RNA提取试剂盒,LipofectamineTM3000脂质体,反转录试剂盒(第一链cDNA合成试剂盒)均购于大连宝生物技术有限公司;miR-16 mimics和miR-16 NC均购于上海吉马生物技术有限公司;重组质粒pGL3 YAP1 3′UTR-Wt及pGL3 YAP1 3′UTR-Mut购于广州锐博生物技术有限公司。DYCZ-40D型转印电泳仪,DYCZ-425D型双垂直电泳仪均购于北京六一仪器厂;168-1000XC型酶标仪,FACSCalibur型流式细胞仪购于美国BD公司;GelDoc 2000型凝胶成像系统购于美国伯乐公司;IX51倒置显微镜购于日本OLIMPUS公司。
1.3细胞转染 当A549细胞密度达到50%时,利用LipofectamineTM3000脂质体将稀释好的miR-16 mimics和miR-16 NC转染到A549细胞中,6 h 后细胞换液并继续培养48 h,采用RT-PCR法检测细胞中miR-16的表达。
1.4RT-PCR法检测细胞中miR-16及YAP1表达 根据Trizol试剂盒说明书提取总RNA,当检测出的RNA纯度良好时候,根据逆转录试剂盒将RNA逆转录成cDNA,最后进行琼脂糖凝胶电泳。
1.5MTT法检测细胞活力 将5×103个A549细胞接种到96孔板,培养24 h,按“1.4”转染48 h后,加入MTT试剂孵育4 h,后舍去上清液,加入二甲基亚砜,微量振荡器震荡使结晶物溶解,利用酶标仪检测OD570 nm值,所测OD值即细胞活力。
1.6软琼脂糖克隆形成实验 将8×103个A549细胞接种到6孔板,培养24 h后,按“1.4”转染48 h后,消化细胞并制成单细胞悬液。制作1.2%及0.7%的琼脂糖液,首先将1.2%琼脂糖与两倍体积的DMEM培养基混匀,倒于6 cm培养皿,室温下冷却。接着0.7%琼脂糖液与两倍体积的DMEM培养基混匀后,加入单细胞悬液继续混匀,后倒于铺有1.2%琼脂糖的平皿中,在37℃、5%CO2培养箱中培养,并于显微镜下观察计数。
1.7Hoechst法检测细胞凋亡情况 将8×103个A549细胞接种到6孔板,培养24 h后,按“1.4”转染48 h后,用甲醇∶乙酸混合液固定细胞30 min,磷酸盐缓冲液(PBS)洗涤后,加入Hoechst33258染色液染色10 min,于倒置显微镜下观察,细胞核皱缩,浓染并呈碎片说明细胞凋亡,最后用Image J软件进行统计分析。
1.8流式细胞术检测细胞周期 将8×103个A549细胞接种到6孔板,培养24 h后,按“1.4”转染48 h后,每组收集1×105/ml个细胞,再加入5 μl的Rnase吹打混匀后于室温下孵育1 h,接着加入PI染液在室温下避光孵育30 min,最后进行流式检测,并对细胞周期进行分析。
1.9Western印迹检测细胞中YAP1表达 收集细胞并裂解,离心收获上清液获得总蛋白,BCA试剂盒测定蛋白浓度,蛋白煮沸变性,制作浓缩胶及分离胶,上样,进行十二烷基苯磺酸钠凝胶电泳,聚偏氟乙烯(PVDF)膜湿法转膜。2%的牛血清白蛋白(BSA)室温下孵育1 h,一抗溶液(兔YAP1及GAPDH单克隆抗体,稀释度为1∶100) 4℃过夜孵育,第二天在室温条件下,与二抗溶液孵育1~2 h,在凝胶成像系统中曝光。最后用Quantity one软件进行统计分析。
1.10荧光素酶报告基因表达分析 将miR-16 mimics+pGL3 YAP1 3′UTR-Wt,miR-16 NC+ pGL3 YAP1 3′UTR-Wt,miR-16 mimics+pGL3 YAP1 3′UTR-Mut,miR-16 NC+ pGL3 YAP1 3′UTR-Mut四组miR-16与YAP1的重组载体转入SW480细胞中,并根据双荧光素酶检测系统检测每组细胞的荧光素酶活性,计算公式:相对荧光值=萤火虫荧光素酶荧光值/海肾荧光素酶荧光值。
1.11统计学分析 采用SPSS17.0软件行t检验。
2 结 果
2.1miR-16在肺癌细胞株及正常胚肺细胞中的表达 miR-16在A549、H1050、H1299、NCI-H520、NCI H596及MIRC-5中的表达分别为(0.38±0.03)、(1.35±0.01)、(1.10±0.11)、(1.43±0.14)、(1.56±0.15)、(2.38±0.25)。与MIRC-5比较,肺癌细胞中miR-16表达量下调(P<0.01),且在A549细胞中下调程度最高,因此选为后续实验研究对象。
2.2miR-16 mimics转染效果的检测 miR-16 mimics和miR-16 NC转染48 h后,与miR-16 NC组(0.36±0.03)比较,miR-16 mimics组中miR-16表达量(1.89±0.12)显著上调 (P<0.01)。
2.3miR-16 mimics对A549细胞活力及细胞克隆能力的影响 miR-16 mimics和miR-16 NC转染A549细胞24、48、72 h后,与miR-16 NC组比较,不同转染时间点miR-16 mimics组细胞活力均显著降低(P<0.01)。在转染48 h后,与miR-16 NC组(120.52±12.29)比较,miR-16 mimics组(32.46±3.28)细胞克隆形成数目显著减少(P<0.01)。见图1,图2。

与miR-16 NC比较:1)P<0.01图1 miR-16 mimics对A549细胞活力的影响
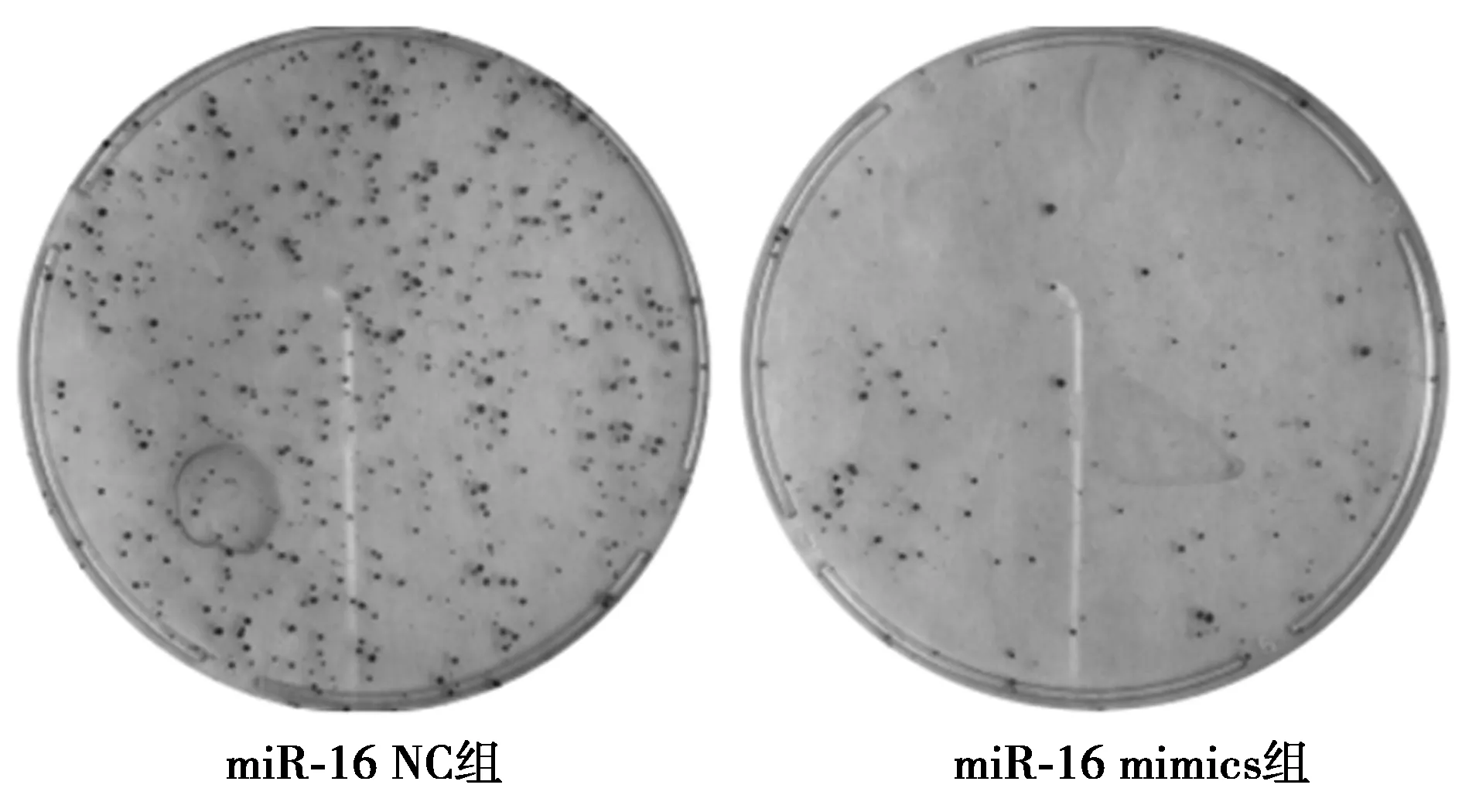
图2 miR-16 mimics对A549细胞克隆形成能力的影响
2.4miR-16 mimics对A549细胞凋亡及细胞周期的影响 miR-16 mimics和miR-16 NC转染A549细胞48 h后,与miR-16 NC组比较,miR-16 mimics组细胞凋亡率显著提高(P<0.01),且细胞周期阻滞于G1期 (P<0.01)。见图3,表1。

图3 miR-16 mimics对A549细胞凋亡的影响(×200)

组别细胞凋亡率细胞周期G1期S期G2期miR-16 NC组5.48±0.5548.21±4.8232.84±3.6818.95±1.90miR-16 mimics组39.63±3.961)62.35±6.231)16.10±1.611)21.55±2.151)
与miR-16 NC组比较:1)P<0.01
2.5荧光素酶报告基因分析 miR-16 mimics+pGL3 YAP1 3′UTR-Wt组的荧光强度低于其他转染组(P<0.01),且另外三组间荧光强度差异无统计学意义(P>0.05)。
2.6miR-16 mimics对A549细胞中YAP1蛋白及mRNA表达量的影响 miR-16 mimics和miR-16 NC转染A549细胞48 h后,与miR-16 NC组(0.98±0.08,0.95±0.05)比较,miR-16 mimics组YAP1蛋白(0.14±0.01)及mRNA(0.10±0.01)表达量显著下调(P<0.01)。见图4。
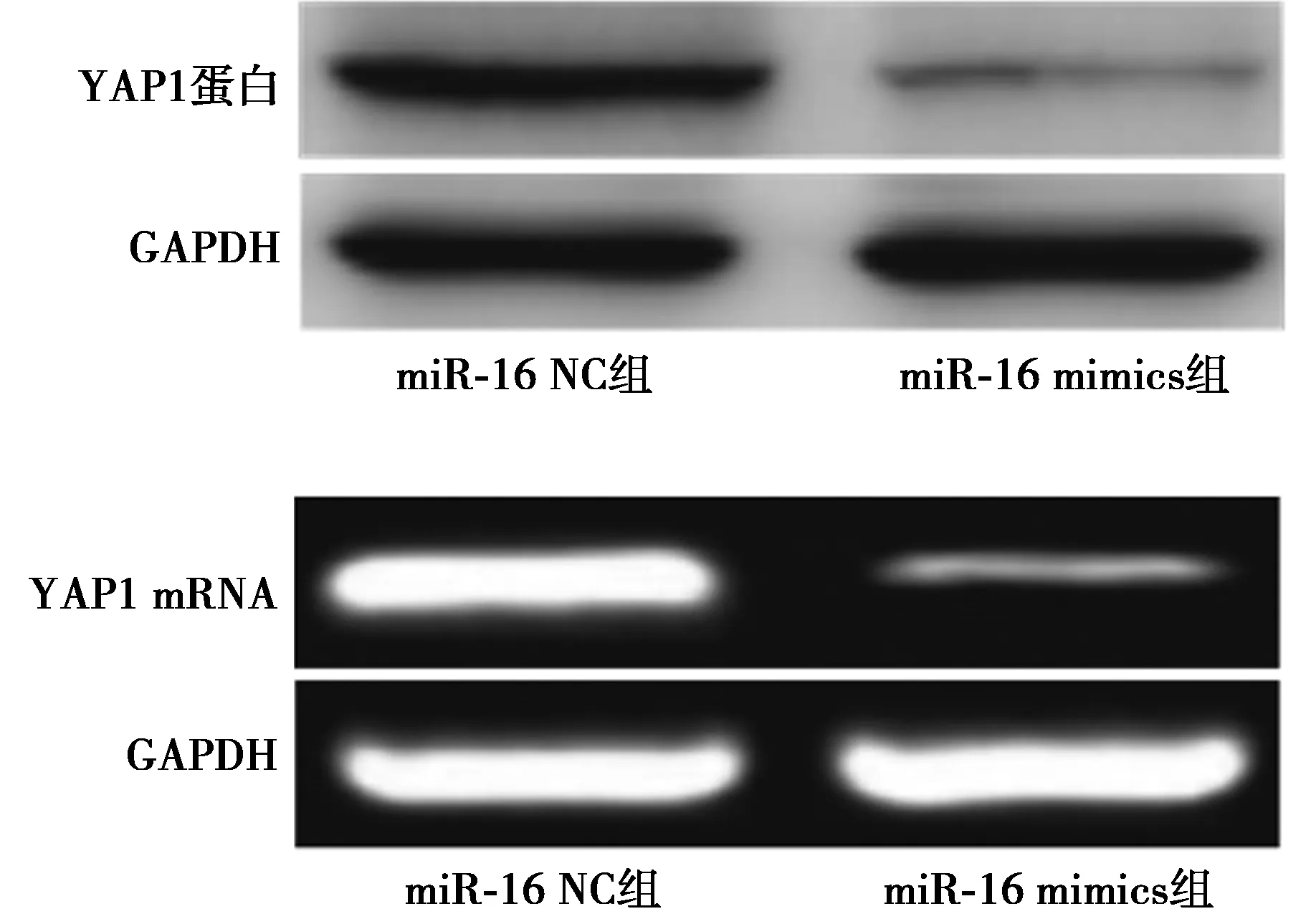
图4 miR-16 mimics对A549细胞中YAP1 mRNA及 蛋白表达的影响
3 讨 论
miRNA是一类高度保守的与靶基因3′UTR区域特异性结合的小RNA分子,其基因组常处于肿瘤基因的脆性区,因此常作为促癌miRNA或者抑癌miRNA参与肿瘤的发生发展〔3,4〕。miR-16基因组定位于13q14.3,是首个被发现与肿瘤密切相关的miRNA。miR-16在血液系统肿瘤、肺癌、乳腺癌、肝癌等肿瘤组织或血液中低表达,并成为上述癌症早期诊断的有效指标〔6,7〕。但miR-16在肺癌中的具体作用尚不明确。
本研究结果表明肺腺癌细胞株A549、H1050、H1299,肺鳞癌细胞株NCI-H520、NCI H596中miR-16表达量均显著低于MIRC-5,此结果与miR-16在肺癌中的表达趋势一致〔5〕,也与miR-16在其他肿瘤细胞株中的表达趋势类似〔8~10〕,提示miR-16在肺癌中起抑癌作用。同时,本研究结果表明miR-16 mimics能显著诱导A549细胞凋亡,与miR-16 mimics在胶质瘤细胞、胃癌细胞中作用效果一致〔8,10〕,从而说明miR-16 mimics能显著抑制A549细胞增殖,并诱导细胞凋亡。肿瘤细胞的无限增殖源自于细胞周期的紊乱与不可控制,特别是细胞周期调控点G1、S、G2,已经成为众多抗癌药物的作用靶点之一〔11,12〕。本研究结果也表明miR-16 mimics能显著阻滞A549细胞周期于G1期。
miRNA在肿瘤细胞中主要通过调控下游靶基因的转录发挥其生物学效应〔8,9〕。本研究前期通过靶基因预测软件miRanda发现了YAP1可能是miR-16的靶基因之一,miR-16与YAP1的3′UTR区域可能互补,因此本研究对此展开了进一步的验证。YAP1蛋白是YAP1基因的编码产物,是一种富含脯氨酸的磷蛋白,含有8种异构体,是Hippo信号通路中的关键一员,在包括肺癌在内的多种肿瘤组织中高表达。YAP1通过Hippo信号通路参与细胞的生长、分化与凋亡等生物学过程〔13〕。YAP1在正常生理条件下不表达或者低表达,在被上游信号激活后,能够极大加速细胞的增殖及恶性转化。目前对YAP1的了解还有限制,已报道YAP1能与miRNA相互作用进而发挥功能〔14〕。本研究利用荧光素酶报告基因证实了miR-16能够特异性结合于YAP1的3′UTR区域,使荧光强度降低;同时,RT-PCR及Western印迹结果也说明miR-16能够负性调控YAP1表达,二者存在靶向调控关系。有研究表明沉默YAP1表达能显著抑制A549细胞增殖〔15〕,进而说明上调miR-16表达负性调控YAP1表达能够显著抑制A549细胞增殖。
综上所述,miR-16在肺癌细胞株中低表达,上调miR-16表达能显著降低A549细胞活力及细胞克隆数目,诱导细胞凋亡,阻滞细胞周期于G1期,是通过靶向下调YAP1表达实现的。
