外源性雄激素通过诱导自噬促大鼠睾丸萎缩
2019-02-15单光明聂黎虹郭凤英朱亚洲秦凯悦杜丹丹田国林赵瑞宁
单光明 聂黎虹 郭凤英 朱亚洲 秦凯悦 杜丹丹 田国林 赵瑞宁
(宁夏医科大学 1总医院泌尿外科,宁夏 银川 750004;2研究生学院;3基础医学院;4 2015级本科生)
睾丸是男性生殖器官的一部分,具有分泌雄性激素、产生精子、维持正常男性生育功能和性功能的作用〔1〕。由于雄激素特殊的生理功能,部分人群选择外源性给予雄激素以达到提高性欲、提高运动成绩、男性药物避孕等目的〔2,3〕。但外源性雄激素的不合理应用,可能致使睾丸萎缩,进而影响其正常生理功能〔2〕。目前外源性雄激素致睾丸萎缩的机制尚未阐明。自噬是真核生物细胞调节自身生长、死亡、能量代谢的重要机制,其在增生、衰老、退行性变、炎症变等病理生理过程中发挥重要的作用〔4,5〕。研究表明,雄激素可以调控细胞自噬的水平〔6〕;而精索静脉曲张可致睾丸生精小管上皮细胞自噬水平上调〔4〕。关于外源性雄激素是否通过调节细胞自噬水平参与睾丸萎缩病理过程的发生未见报道。本研究通过外源性给予雄激素丙酸睾丸酮(TP)及自噬抑制剂,采用分子生物学及形态学等技术,探讨外源性雄激素是否通过调节细胞自噬水平变化参与睾丸萎缩病理过程的发生。
1 材料与方法
1.1动物与主要试剂 雄性SD大鼠,体重250~270 g,购于宁夏医科大学实验动物中心。TP(北京Solarbio公司,中国);氯喹(CQ,Sigma公司,美国);甘草甜素(Gly,东京化成工业株式会社,日本);全蛋白提取试剂盒、电化学发光(ECL)检测试剂盒;二喹啉甲酸(BCA)蛋白浓度测定试剂盒(江苏凯基生物,中国);兔抗Beclin-1;兔抗p62(Proteintech公司,美国);兔抗LC3B(Sigma公司,美国);兔抗HMGB1(Abcam公司,英国);鼠抗β-actin和辣根过氧化物酶(HRP)标记的二抗和HE染料(北京中杉金桥公司,中国)。
1.2动物分组与模型建立 48只SD大鼠随机分为6组:对照(control)组、TP组、TP+CQ组、TP+Gly组、CQ组、Gly组,每组8只。TP组皮下注射TP(3 mg·kg-1·d-1);TP+CQ组皮下注射TP(3 mg·kg-1·d-1)加腹腔注射CQ(50 mg·kg-1·d-1);TP+Gly组皮下注射TP(3 mg·kg-1·d-1)加腹腔注射Gly(10 mg·kg-1·d-1);CQ组仅腹腔注射CQ(50 mg·kg-1·d-1);Gly组仅腹腔注射Gly(10 mg·kg-1·d-1);control组腹腔注射生理盐水(2.5 ml·kg-1·d-1)。每组处理时间均为21 d。
1.3标本收集与睾丸指数计算 各组称重后麻醉(10%水合氯醛,0.3 ml/100 g),摘取睾丸组织,迅速测量睾丸湿重,计算睾丸指数。大鼠睾丸指数=睾丸湿重(g)/体重(kg)。测量后两侧睾丸分别进行病理学和Western印迹法蛋白检测。
1.4HE染色观察睾丸组织形态学改变 取一侧睾丸用冷生理盐水冲洗后,置于4%多聚甲醛中固定,24 h后将其修剪后置于包埋盒中脱水过夜;次日进行浸蜡、包埋,冷凝后进行组织切片、烤片;将切片进行脱蜡水化并染色,流水冲洗,梯度酒精脱水,二甲苯透明,中性树胶封片;在光学显微镜下观察睾丸组织病理学变化。
1.5Western印迹法检测自噬相关蛋白表达水平 取另一侧大鼠睾丸,全蛋白提取试剂盒提取蛋白,BCA法检测蛋白浓度后定量。将每组蛋白60 μg加入不同泳道中行电泳70 min后,采用半干转方式进行转膜。5%牛奶室温封闭1.5 h,磷酸盐吐温缓冲液(PBST)洗膜3次,加一抗4℃孵育过夜后,PBST洗膜3次,二抗室温孵育1.5 h,PBST洗膜3次,ECL化学发光液显色,于凝胶成像仪拍照。
1.6统计学处理 采用SPSS22.0软件进行析因设计的方差分析。
2 结 果
2.1各组体重、睾丸湿重及睾丸指数的比较 与control组比较,TP组睾丸湿重、指数均显著下降(P<0.01);与TP组比较,TP+CQ和TP+Gly组睾丸指数均显著上升(P<0.05);TP+CQ和TP+Gly组与control组比较,睾丸湿重显著减轻(P<0.05),但睾丸指数无明显变化(P>0.05);CQ和Gly组与control组比较,睾丸湿重和指数均无明显差异(P>0.05);见表1 。
2.2各组睾丸组织形态学分析 control组睾丸生精小管形态规则,各级生精细胞层次分明、有序排列;管腔内可见大量成熟的精子,旋涡状表现。TP组生精小管形态不规则;生精细胞层数明显减少、排列紊乱;管腔内成熟的精子稀少,部分管腔内出现脱落的生精细胞团块。TP+CQ组和TP+Gly组生精小管管腔稍不规则,与TP组比较生精细胞层数和排列状况均明显改善;管腔内可见成熟的精子,未见脱落的生精细胞团块。CQ组和Gly组睾丸生精小管形态、结构与control组类似,见图1。

表1 各组体重、睾丸湿重和睾丸指数的比较
与 control组比较:1)P<0.05,2)P<0.01;与TP组比较:3)P<0.05,4)P<0.01
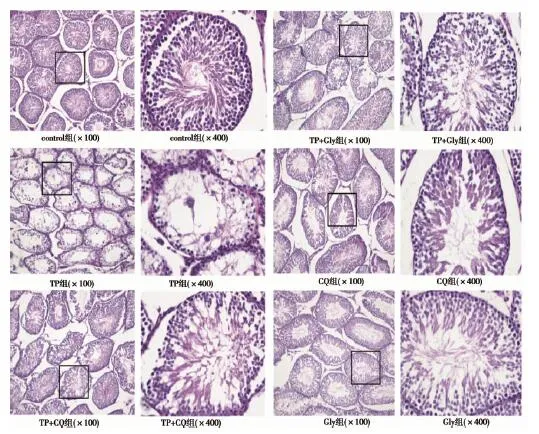
图1 各组睾丸组织染色
2.3各组睾丸组织相关蛋白的表达 与control组(0.66±0.06,0.69±0.10,0.77±0.07)比较,TP组睾丸组织Beclin-1、LC3B-Ⅱ和HMGB1蛋白表达水平(0.91±0.09,1.05±0.08,1.07±0.15)均显著上调(P<0.05),p62蛋白表达无统计学差异(0.50±0.04,0.46±0.10,P>0.05)。与TP组比较,TP+CQ组睾丸组织Beclin-1、LC3B-Ⅱ和HMGB1蛋白表达水平(0.65±0.06,0.71±0.04,0.74±0.08)均显著下调(P<0.05),p62蛋白表达仍无统计学差异(0.53±0.06,P>0.05);TP+Gly组上述各蛋白表达(0.58±0.05,0.74±0.04,0.82±0.06,0.50±0.09)与TP+CQ组结果类似,两组各蛋白表达均无统计学差异(P>0.05)。CQ组上述各蛋白表达(0.58±0.07,0.61±0.04,0.84±0.08,0.48±0.04)和Gly组(0.65±0.13,0.61±0.05,0.80±0.11,0.46±0.07)与control组无统计学差异(P>0.05),见图2。

1~6:control组、TP组、TP+CQ组、TP+Gly组、CQ组、Gly组图2 各组睾丸组织相关蛋白的表达
3 讨 论
雄激素主要由睾丸间质细胞合成、分泌,可发挥促男性性器官成熟、第二性征出现、维持正常性欲和生殖等作用。在睾丸内,雄激素通过受体介导影响睾丸支持细胞、间质细胞、血管平滑肌细胞及内皮细胞的发育,进而促进各级生精细胞的分化及精子的成熟。体内雄激素水平异常变化会影响睾丸结构与功能。外源性雄激素可通过影响生精细胞的分化,致使成熟精子数量明显减少以达到男性避孕的目的〔3〕。研究表明,雄激素可以调控细胞自噬的水平;其可通过增加细胞自噬和自噬流发挥促前列腺癌细胞代谢和增殖的作用〔6〕;雄激素受体可以通过转录调控自噬核心基因和溶酶体基因促进前列腺癌的发展〔7〕。且在精索静脉曲张等疾病发生过程中,睾丸细胞自噬水平也发生改变〔4〕。这些现象提示雄激素可能通过调控细胞自噬参与睾丸萎缩的病理过程。
本研究表明外源性雄激素可致睾丸萎缩。LC3是自噬启动的特异性标记蛋白,LC3B-Ⅱ的蛋白水平是反映自噬最基本的指标。Beclin-1是首个被鉴定介导哺乳动物自噬的蛋白,在自噬体形成过程中是不可或缺的条件〔8〕。本文结果提示雄激素致睾丸萎缩过程中可能上调了细胞自噬水平。HMGB1
是重要的自噬调控因子〔9,10〕,细胞内不同空间定位的HMGB1均可通过相应机制调控自噬发生。那么表达增多的HMGB1是否参与了雄激素致睾丸萎缩过程中自噬水平上调呢?本文提示细胞自噬水平的上调参与了雄激素致睾丸萎缩的病理过程。睾丸萎缩过程中表达增多的HMGB1参与了睾丸细胞自噬水平的上调。
综上,外源性雄激素可能通过上调自噬水平引发大鼠睾丸萎缩病理过程的发生,HMGB1可能在此过程中调节自噬水平改变。但在睾丸萎缩病理过程中,雄激素通过何种方式调控自噬,HMGB1在此过程中如何发挥促自噬的作用及雄激素和HMGB1是否具有协同调控自噬的作用均需进一步探讨。
