S22053不锈钢在6% FeCl3溶液中的点蚀行为
2019-02-14,,
,,
(1. 合肥通用机械研究院有限公司,合肥 230031; 2. 合肥通用机械研究院特种设备检验站有限公司,合肥 230031;3. 国家压力容器与管道安全工程技术研究中心,合肥 230031)
电化学阻抗技术是一种以小振幅正弦波电位(或电流)为扰动信号的电化学测量方法。该方法的扰动信号小,不仅对体系的影响小,还能使扰动与体系响应之间近似呈线性关系,测量结果的数学处理过程简单,能比其他电化学技术获得更多的动力学信息及电极界面的结构信息[1-3]。因该技术有众多的优点,后续又发展了动电位电化学阻抗谱技术(不同电位下测量材料的阻抗谱)和时间扫描模式下的电化学阻抗谱技术(随时间的推移测量,不同时间段测量材料的阻抗谱)。
点蚀是一种典型的局部腐蚀,具有很大的隐蔽性和破坏性,通常发生在易钝化金属或合金中。其重要特征之一是在某一给定的金属-介质体系中,存在特定的阳极极化电位门槛值,低于此电位时,不会发生点蚀,高于此电位则发生点蚀[4-5]。
结合点蚀特点和动电位阻抗谱的优点,可以用动电位电化学阻抗谱技术研究钝化金属或合金的点腐蚀行为,从而研究材料从钝化态到亚稳态点蚀,再到稳态点蚀的连续变化过程。杜楠等[6-7]采用动电位电化学阻抗谱和时间扫描模式下的电化学阻抗谱研究了304不锈钢在3.5% NaCl溶液中的点蚀行为,揭示了点蚀发展过程中双电层和钝化膜结构的变化特点;张胜寒等[8]采用动电位电化学阻抗谱技术研究了304不锈钢在0.1 mol/L NaCl溶液中的点蚀行为,指出点蚀对钝化膜外层的破坏作用重于对内层的。
S22053不锈钢常用于含氯离子的腐蚀性环境中,有必要对其点蚀敏感性进行评估。工程中常用6%(质量分数,下同)FeCl3溶液评定不锈钢的耐点蚀性能[9-11],因此,本工作采用动电位电化学阻抗谱技术研究了S22053不锈钢在6% FeCl3溶液中的点蚀行为,通过其在不同电位下的电化学阻抗谱变化,分析点蚀行为特征,以期为S22053不锈钢在含氯离子腐蚀环境中的工程应用提供参考。
1 试验
1.1 试样
试验材料为S22053不锈钢,其化学成分见表1。试样尺寸为φ14 mm×6 mm,将试样置于丙酮溶液中进行超声波清洗除油后,表面用砂纸(200~1 000号)逐级打磨,随后再次浸入丙酮溶液中清洗,吹干后放入干燥皿中备用。试验前,将试样放入特制的小容器中,其外部为聚四氟乙烯,内部有金属导线,小容器一端面开有φ11.29 mm的圆孔,面积约为1 cm2,试样有1 cm2工作面露出并能浸入介质,试样背面采用螺纹盖压紧。
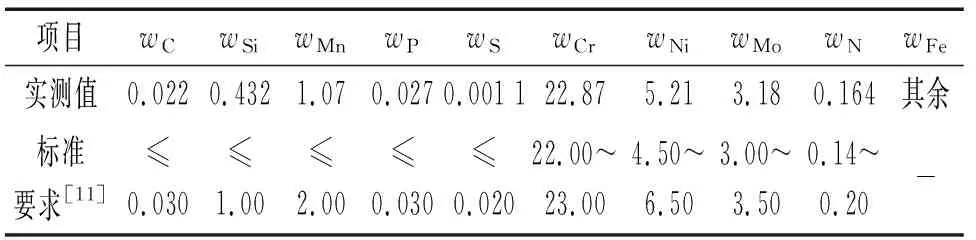
表1 S22053不锈钢的化学成分Tab. 1 Chemical composition of S22053 stainless steel %
1.2 试验方法
电化学试验在德国Zahner公司生产的Zennium E型电化学工作站上完成,采用三电极体系,试样为工作电极,铂电极为辅助电极,饱和甘汞电极(SCE)为参比电极。文中电位若无特指,均相对于SCE。试验溶液为6% FeCl3水溶液,试验温度为(25±1) ℃。电化学阻抗谱测试结果采用ZsimpWin软件进行拟合。
试验开始前先对试样进行极化曲线测试,扫描速率为1 mV/s,至电流密度达到10 mA/cm2后停止。根据极化曲线测试结果,确定动电位电化学阻抗谱的电位区间,电位阶跃幅度为0.1 V,施加的正弦波电位阶跃信号为10 mV,频率扫描范围为50 mHz~100 kHz。电化学测试前试样需先在-0.8 V下阴极极化5 min,以去除试样表面的氧化膜,随后在试验溶液中浸泡1 h,使电化学体系保持稳定。
2 结果与讨论
2.1 极化曲线
由图1可见:试样在6% FeCl3溶液中的自腐蚀电位为248 mV,在阳极极化区存在明显的钝化区(300~850 mV),在钝化区的腐蚀电流密度约为15 μA/cm2。根据GB/T 17899-1999《不锈钢点蚀电位测量方法》标准,阳极极化曲线上电流密度达到100 μA/cm2时对应的最正电位为点蚀电位Eb100,故试样在6% FeCl3溶液中的点蚀电位Eb100为915 mV,根据极化曲线的阳极区间确定动电位电化学阻抗谱的动电位区间为0.3~1.4 V。
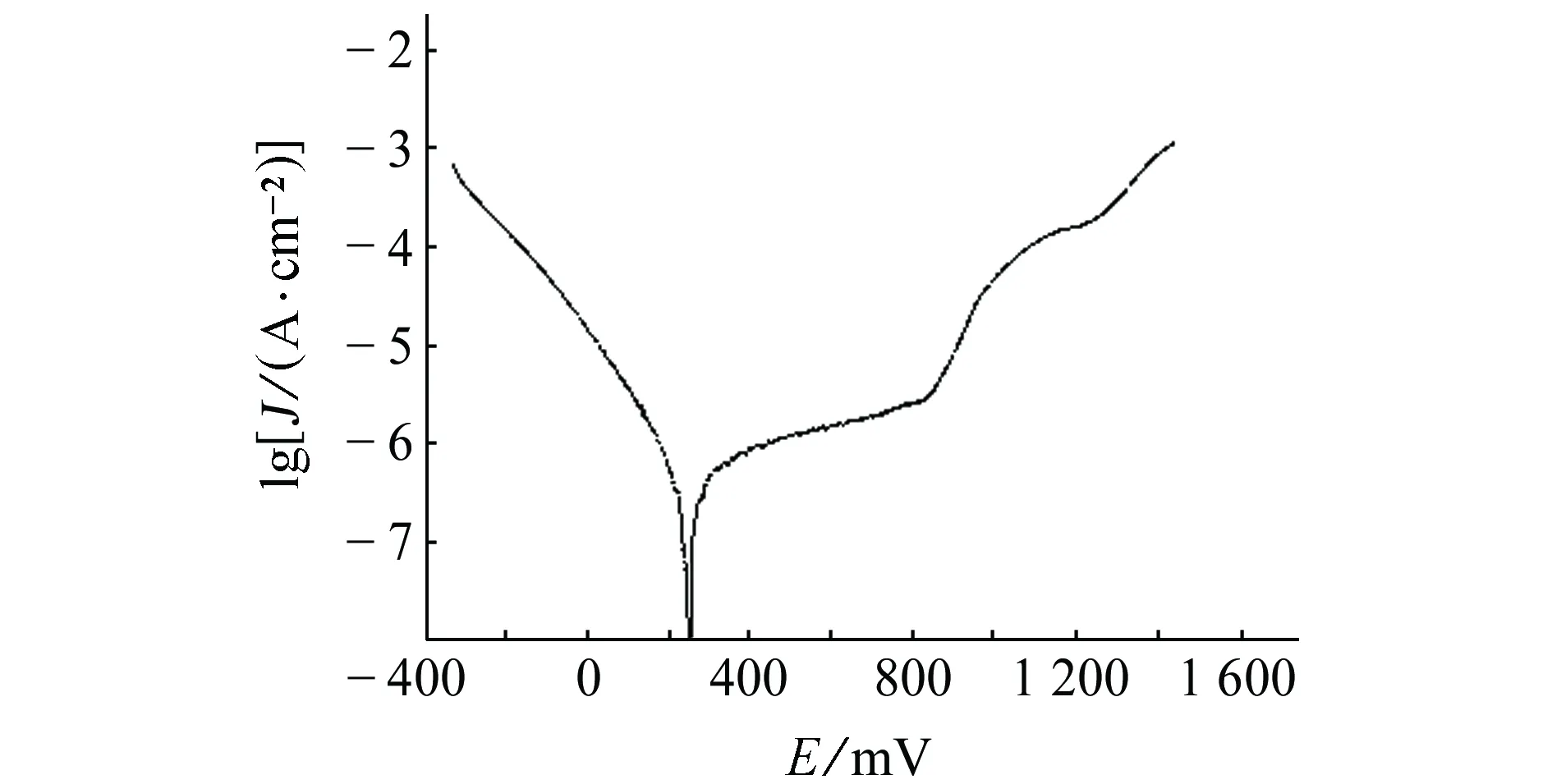
图1 试样在6% FeCl3溶液中极化曲线Fig. 1 Polarization curve of sample in 6% FeCl3 solution
2.2 电化学阻抗谱
由图2(a)可见:在0.3~0.9 V电位区间,Nyquist图均呈圆弧状,由一个高-中频容抗弧组成,低频区不存在Warburg阻抗,说明在此电位区间,活化控制占主导;在0.3~0.6 V电位区间,阻抗谱半径随电位的升高逐渐增大;在0.6~0.9 V电位区间,阻抗谱半径随电位的升高逐渐减小,且在0.9 V时尤为明显。由图2(b)可见:电位为1.0 V时,阻抗谱由一个高-中频容抗弧组成,低频区出现明显的感抗弧;在1.1~1.2 V电位区间,阻抗谱高-中频区表现为一个容抗弧特征,低频区也为一个容抗弧特征;在1.3~1.4 V电位区间,阻抗谱在高频区表现为容抗弧特征,中频区表现为另一个容抗弧特征,低频区表现为一个感抗弧。且在1.0~1.4 V电位区间,容抗弧和感抗弧半径都随电位的升高而减小。
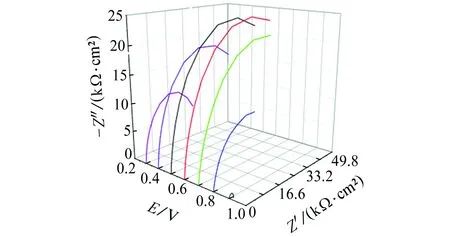
(a) 0.3~0.9 V
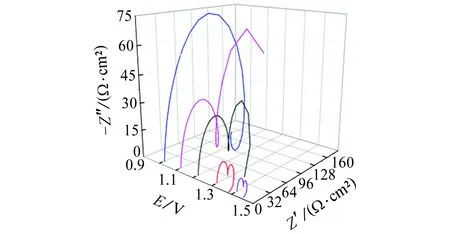
(b) 1.0~1.4 V图2 试样在不同电位下的Nyquist图Fig. 2 Nyquist polts of samples at different potentials
由于在0.3~0.8 V电位区间,试样Nyquist图的形状近似,故对0.8 V时试样的Bode图进行分析,结果见图3。由图3可见:相频图上只有一个峰,故体系中有1个时间常数,0.3~0.8 V电位区间的电化学阻抗谱等效电路见图4。其中,Rs1是溶液电阻,Qm1是与界面电容相关的常相位角元件,表征试样表面的钝化膜,Rt1是电荷转移电阻。0.9 V时,试样的Nyquist图呈半圆状,低频区刚进第四象限,初步展现感抗特性,由图1可知,当电位为0.9 V时,腐蚀电流低于100 μA/cm2,未达到点蚀电位,且Nyquist图中还没有明显的感抗特征,故其等效电路也如图4所示。
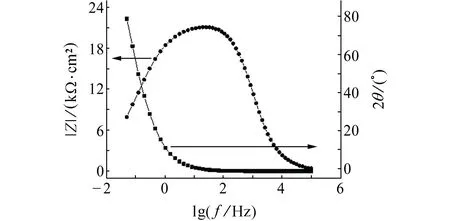
图3 0.8 V时试样的Bode图Fig. 3 Bode plots of sample at 0.8 V

图4 0.3~0.9 V电位区间,试样的电化学阻抗谱的等效电路Fig. 4 Equivalent circuit of EIS for samples under the condition of 0.3~0.9 V
曹楚南[2]指出,在钝化区间,金属表面同时进行钝化膜的生成(使钝化膜增厚)和溶解(使钝化膜减薄)。由表2可见:在0.3~0.6 V电位区间,常相位角元件Qm1的电容值随电位的升高而减小,电荷转移电阻Rt1随电位的升高而增大,这是因为该区间电位较低,钝化膜生成占主导,其厚度随电位的升高而增加,且随着电位的升高,Qm1和Rt1减小和增加的趋势减缓,说明随电位的升高,钝化膜生成的主导作用削弱。在0.6~0.9 V电位区间,常相位角元件Qm1的电容值和电荷转移电阻Rt1的变化趋势正好与在0.3~0.6 V电位区间的相反,这是因为该区间电位稍高,钝化膜溶解占主导,其厚度随电位的升高而减小,且随着电位的升高,Qm1和Rt1分别增大和减小的趋势加剧,说明随电位的升高,钝化膜溶解的主导作用增强。常相位角元件系数nm1在较低电位区间(0.3~0.5 V)基本保持不变,在较高电位区间(0.6~0.9 V),随电位的升高逐渐降低(越来越偏离1),主要是因为电位较低时,钝化膜溶解速率低,钝化膜结构完整,随着电位的升高,钝化膜溶解速率高,且不均匀减薄,尤其是薄弱区域,导致nm1越来越偏离1。
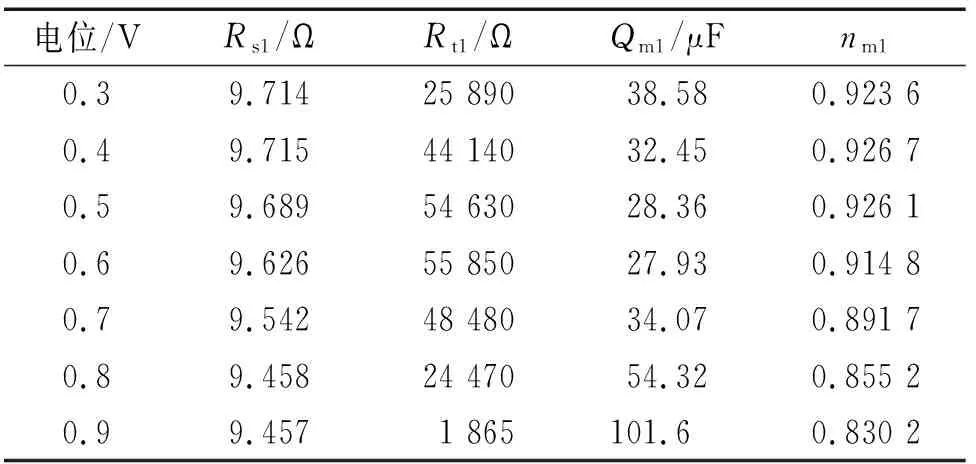
表2 电化学阻抗谱拟合结果(0.3~0.9 V)Tab. 2 Fitting results of EIS under the condition of 0.3~0.9 V
由图2(b)可见:电位为1.0 V时,Nyquist图在高-中频为容抗弧特征,低频部分出现明显的感抗弧,曹楚南等[2-3,6]认为,当电极表面有点蚀形成,进入点蚀诱导期时,Nyquist图中的低频部分会出现感抗弧。感抗响应主要由于点蚀诱导期膜厚的变化或吸附膜覆盖率的变化[2,12]。采用图5所示等效电路进行拟合,其中Rs2为溶液电阻,Rt2为电荷转移电阻,Rf1为点蚀发生处与膜的生长溶解相关的电阻,Qm2为与界面电容相关的常相位角元件,L1为点蚀形核处与钝化膜厚度变化相关的等效电感,拟合结果如表3所示。
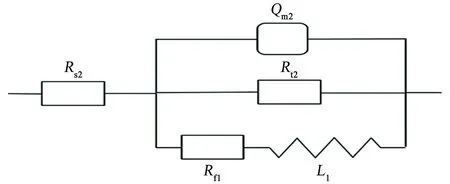
图5 1.0 V条件下,试样的电化学阻抗谱的等效电路Fig. 5 Equivalent circuit of EIS of sample under the condition of 1.0 V
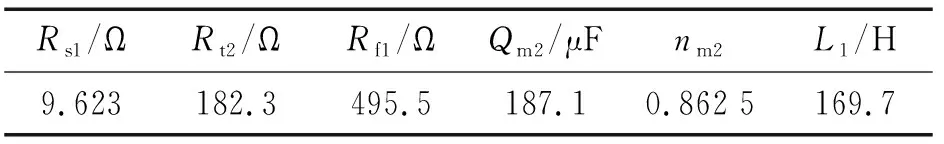
Rs1/ΩRt2/ΩRf1/ΩQm2/μFnm2L1/H9.623182.3495.5187.10.862 5169.7
对比0.9和1.0 V条件下试样的EIS拟合结果可知,随着电位的升高,亚稳态点蚀坑内钝化膜继续溶解,因点蚀形核处的面积比钝化膜完好区域的面积小很多,且点蚀形核处的法拉第导纳比钝化膜完好区域的大很多[2],故形核处阳极电流密度很大,加速了诱导处的溶解,故点蚀形核区域的电化学行为是点蚀诱导期电化学阻抗谱的主要特征。
电位为1.1 V时,Nyquist图出现两个容抗弧,低频区未出现感抗特征;电位为1.2 V时,Nyquist图同样出现两个容抗弧,低频区最后一个数据点进入第四象限,但没有明显的感抗特征。这说明随着电位进一步升高(1.1~1.2 V),诱导处进一步腐蚀发展为稳态点蚀,此时点蚀处的钝化膜完全消失,点蚀进入发展期,曹楚南等[2,13]的研究结果也证明了这一点。因蚀坑处无钝化膜保护,“裸露”金属直接与介质接触,与有钝化膜的区域相比,蚀坑处金属更易腐蚀,且点蚀处的面积远小于钝化膜覆盖区域的,再加上这两个区域的短路耦合作用,蚀坑内阳极电流密度很大,蚀坑内的溶液电阻不能忽略。1.1~1.2 V时的EIS等效电路见图6,其中Rs3为溶液电阻,Qm3为与界面电容相关的常相位角元件,Rt3为蚀坑内的溶液电阻,Qk1为点蚀坑内与界面电容相关的常相位角元件,Rf2为点蚀坑内电荷转移电阻,其拟合结果如表4所示。
对比表3和表4可见:随着电位的升高,点蚀坑内电荷转移电阻减小,蚀坑内的溶液电阻减小,说明随着电位的升高,蚀坑内裸露金属腐蚀溶解使坑内的离子浓度增加,点蚀进一步加剧。Qm3相对于Qm2减小,nm3相对于nm2增大,蚀坑内的界面电容常相位元件Qk1减小,说明腐蚀更偏向发生在点蚀坑内,且腐蚀加剧的趋势出现短暂的减缓,与图1中的极化曲线上出现二次钝化平台一致。
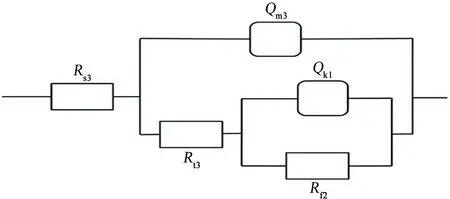
图6 1.1~1.2 V条件下,试样的电化学阻抗谱的等效电路Fig. 6 Equivalent circuit of EIS f under the condition of 1.1~1.2 V

电位/VRs3/ΩRt3/ΩRf2/ΩQm3/μFnm3Qk1/μFnk11.19.71471.26126.898.710.916 218 45011.29.68157.9846.3654.160.930 113 2901
点蚀过程是一个自催化过程[2,4,14-15],蚀坑内部金属腐蚀溶解产生的阳离子会引起坑内离子浓度的增加,且蚀坑口由于残余盖[16-20]和腐蚀产物的存在,阻碍了蚀坑内外溶液的交换,加速点蚀。当点蚀发展到一定程度,蚀坑口的金属部分残余盖脱落,加速了蚀坑内外溶液的交换,蚀坑口附近离子浓度降低而出现钝化,蚀坑深处由于离子浓度高仍快速溶解,且坑内离子存在浓度梯度,越靠近坑口浓度越低,越远离坑口,离子浓度越高,腐蚀主要体现在远离坑口的部位,故此电位区间点蚀坑发展长大。
在高电位(1.3~1.4 V)条件下,Nyquist图中高、中频区分别出现容抗弧,低频区出现感抗特征。对应的等效电路如图7所示。其中,Rs4为溶液电阻,Qm4为与界面电容相关的常相位角元件,Rt4为蚀坑内的溶液电阻,Qk2为点蚀坑内界面电容相关的常相位角元件,Rf3为点坑内电荷转移电阻,L2为新点蚀形核处与膜厚变化相关的等效电感,其拟合结果见表5所示。
由表5可见:随着电位进一步升高,蚀坑内的溶液电阻Rt4、点坑内电荷转移电阻Rf3减小,常相位角元件Qm4减小,这与1.1~1.2 V时的趋势一致;常相位角元件Qk2随电位升高而增大,且出现了新电感L2,说明随着电位的升高,蚀坑深处腐蚀加速,且在高电位下,钝化膜破裂区的再钝化受到抑制,钝化膜覆盖区的钝化膜快速溶解,新的点蚀在钝化部位诱导产生。

图7 1.3~1.4 V条件下,试样的电化学阻抗谱的等效电路Fig. 7 Equivalent circuit of EIS under the condition of 1.3~1.4 V

电位/VRs4/ΩRt4/ΩRf3/ΩQm4/μFnm4Qk2/μFnk2L2/H1.39.64419.7312.1535.470.956 114 0900.991 722.371.49.60411.627.19429.850.963 324 2200.921 212.63
综上所述,S22053不锈钢在6% FeCl3溶液中,当电位为0.3~0.9 V时,基本处于稳定的钝化状态,阻抗谱主要表征钝化膜的电化学行为特征;1.0 V下钝化膜上诱导点蚀;1.1~1.2 V区间,蚀坑腐蚀扩展,由于金属残余盖脱落,蚀坑内坑口附近由于离子浓度降低而钝化,以蚀坑深处腐蚀为主;1.3~1.4 V区间,由于电位高,试样表面钝化膜快速溶解,新的点蚀在钝化部位诱导产生。
3 结论
(1) S22053不锈钢在6% FeCl3溶液中的点蚀电位为915 mV,自腐蚀电位为248 mV。
(2) 电位为0.3~0.9 V时,S22053不锈钢表面处于稳定钝化状态;电位为1.0 V时钝化膜上诱导点蚀;电位为1.1~1.2 V时,以蚀坑深处腐蚀为主;电位为1.3~1.4 V时,因电位高,新的点蚀在钝化部位诱导产生。
(3) 点蚀诱导及发生后,电化学阻抗谱主要表征蚀坑处的特征。
