水曲柳2个PLT转录因子基因的克隆及表达分析
2019-02-14丁一巍詹亚光张佳薇何利明
丁一巍 詹亚光* 张佳薇 何利明
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040; 2.东北林业大学生命科学学院,哈尔滨 150040)
PLT(Plethora)为AP2/ERF型转录因子,其在根发育过程中起到了建成根尖分生组织细胞的作用[1~2],在拟南芥根发育过程中通过响应生长素的累积而转录,同时其活性又能调控生长素的极性运输和生物合成,以直接控制生长素水平,形成一个反馈调节环来维持稳定的生长素浓度和根尖干细胞龛的位置[3~5]。
近些年,随着模式植物根发育研究的深入,发现有两个遗传途径调控拟南芥根尖分生组织干细胞龛,并共同决定干细胞的命运:一个是依赖生长素和PLT浓度梯度的途径[1];另一个是调控根尖皮层和内皮层的SCR(SCARECROW)-SHR(SHORT-ROOT)途径[6~7]。有研究表明,在PLT途径中有两条通路影响着PLT转录因子基因的表达:一条是由酪氨酸磺基转移酶TPST(tyrosylprotein sulfotransferase)[6]和根分生生长因子RGFs(root meristem growth factor)共同介导的调控通路[8],另一条是由生长素响应因子ARFs(auxin response factors)介导的根发育通路[9~10]。这两条独立的通路都是通过PINs(pin-formed)家族蛋白介导生长素极性运输来实现的,它们转运生长素,使其形成一定的浓度梯度,作用于下游的PLT基因。最终实现PLT途径与SCR途径协同调控根尖分生组织中的静止中心QC(quiescent center),进而决定根尖分生组织细胞的命运[11~12]。有研究报道发现,PLT蛋白存在剂量效应,生长素的梯度分布能够引起PLT表达的差异:高水平的PLT活性维持干细胞特性,低水平PLT活性诱导干细胞子细胞的有丝分裂活动,更低水平的PLT活性才可促使细胞分化[1~2,13]。在PLT转录因子当中,PLT1和PLT2通过在根尖干细胞龛周边形成的浓度梯度来维持根尖分生组织细胞的形态[1~2]。而PLT3、PLT5和PLT7不但能冗余地调节侧根原基的启动,还保障了对称生长轴中基因表达程序的正确建立[8,14]。
水曲柳(Fraxinusmandshurica)属于木犀科(Oleaceae)白蜡属(Fraxinus)阔叶经济木材树种,广泛分布于中国东北部和西北部,俄罗斯远东地区,朝鲜半岛北部及日本北部[15]。因其良好的质量与质地而被用于家具和特殊建筑材料。但由于长期过度开采,中国现存的水曲柳纯林极少,已被列为国家濒危保护树种[16]。目前,在水曲柳根系研究中,大多数都是生态学与林学的宏观分析[17~19],还有部分为建立植株再生体系而进行的离体根系的组织培养和抗逆境的研究[20~22]。
根系作为植物之本,其发育的好坏直接影响植物体的生长状况,与林业生产息息相关[23]。所以,本研究以RNA-Seq测序技术得到的水曲柳转录组数据库为基础,克隆获得了2个PLT转录因子FmPLT2和FmPLT3基因,进行了生物信息学分析以及组织特异性表达分析,并通过植物激素对组培苗的生根处理来分析这两个基因在生根过程中的表达情况,以期为水曲柳PLT转录因子基因功能和根发育的研究提供参考[24]。
1 材料与方法
1.1 植物材料
以水曲柳组培苗、两月生实生苗和二十年生水曲柳雄花为试验材料,于液氮冷冻处理后,置-80℃超低温冰箱备用(上述材料取于东北林业大学生命科学学院培养温室和实验林场)。
1.2 实验试剂
CTAB提取RNA的所有试剂均购于上海沪试公司;DNA胶回收试剂盒购于Omega Bio-tek公司;LA-taq聚合酶购于Takara生物公司;pEASY®-T5 Zero Cloning Kit、TranScript® One-Step gDNA Removal and cDNA Synthesis SuperMix、TransStart® Tip Green qPCR SuperMix均购于北京全世金生物公司。
1.3 总RNA提取及cDNA合成
利用CTAB法提取水曲柳两月生整株实生苗的总RNA,并分别提取实生苗根、茎、叶、芽和二十年生水曲柳雄花的总RNA,以及生根处理后第0、7、14和21天这4个时间的整株组培苗的总RNA。按照反转录试剂盒说明书方法,将总RNA反转录为cDNA。
1.4 FmPLT2和FmPLT3全长基因克隆
以水曲柳转录组数据为基础,参照拟南芥基因组序列,对FmPLT2和FmPLT3基因分别设计特异性引物(表1),以水曲柳整株苗cDNA为模板分别进行PCR扩增。PCR的反应体系为:94℃预变性5 min,94℃变性30 s,54℃退火45 s,72℃延伸2 min,30个循环,72℃延伸10 min,4℃保持。应用胶回收试剂盒将扩增产物回收纯化,纯化产物与pEASY-T5载体连接,转化进入Trans-T1感受态,送生工生物工程(上海)公司测序。
表1水曲柳FmPLT2和FmPLT3基因克隆及Real-timePCR分析所用引物
Table1PrimersusedinFmPLT2andFmPLT3genescloningandReal-timePCRanalysisinF.mandshurica
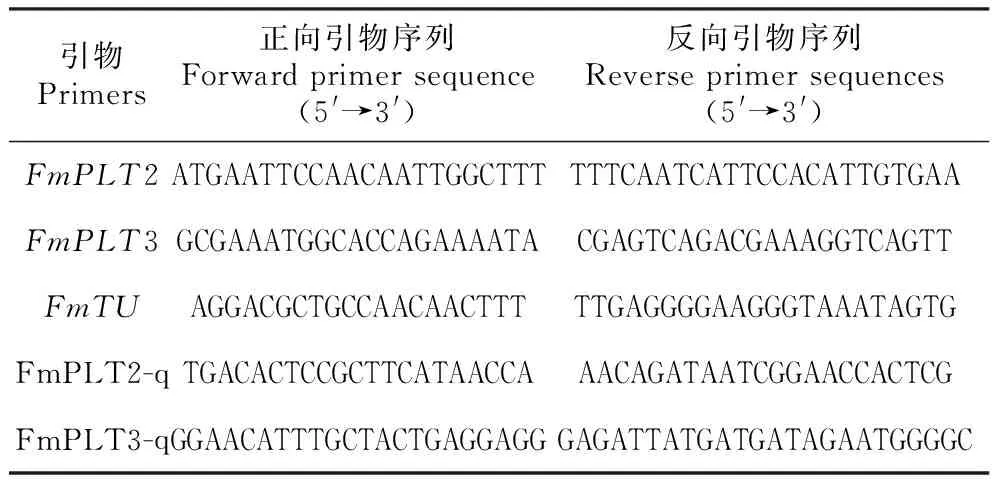
引物Primers正向引物序列Forward primer sequence(5'→3')反向引物序列Reverse primer sequences(5'→3')FmPLT2ATGAATTCCAACAATTGGCTTTTTTCAATCATTCCACATTGTGAAFmPLT3GCGAAATGGCACCAGAAAATACGAGTCAGACGAAAGGTCAGTTFmTUAGGACGCTGCCAACAACTTTTTGAGGGGAAGGGTAAATAGTGFmPLT2-qTGACACTCCGCTTCATAACCAAACAGATAATCGGAACCACTCGFmPLT3-qGGAACATTTGCTACTGAGGAGGGAGATTATGATGATAGAATGGGGC
1.5 FmPLT2和FmPLT3基因序列分析
用NCBI在线工具中的ORF Finder预测目的基因的ORF。通过ExPASy-ProParam、SMART、SignalP4.1等在线软件对目的基因编码的氨基酸序列、相对分子质量、理论pI值、亲水性/疏水性等理化性质进行基础分析。利用SOPMA、ExPASy中的SWISS-MODEL、Psort等在线软件分别对水曲柳PLT转录因子蛋白的二级结构、三级结构及亚细胞定位情况进行预测分析。从NCBI数据库中获得同源性较高的其他物种的PLT基因编码的氨基酸及核苷酸序列,整理后导入MEGA5.0软件构建系统进化树。用ClustalX1.8软件对不同物种的PLT转录因子结构域进行多重序列比对。
1.6 FmPLT2和FmPLT3基因的表达分析
将制备的各组织部位与各生根时间的cDNA样品作为模板,根据测序的水曲柳FmPLT2和FmPLT3基因的全长序列,设计Real-time PCR引物(FmPLT2-q和FmPLT3-q,表1),并以水曲柳TU基因作为内参,引物为FmTU(表1)[25]。按照TransStart® Tip Green qPCR SuperMix试剂盒中20 μL反应体系的说明加样,在ABI-7500荧光定量PCR仪上进行Real-time PCR反应。每个样品技术重复3次,分析数据采用2-ΔΔCt法(ΔΔCt=(CT目的基因-CT内参基因)实验组-(CT目的基因-CT内参基因)对照组)[26]。
2 结果与分析
2.1 FmPLT2和FmPLT3基因全长基因的获得
以水曲柳两月生实生苗的cDNA为模板进行克隆,分别获得了两条1 500 bp左右的片段(图1)。经测序,FmPLT2和FmPLT3基因的开放阅读框长度分别为1 599和1 494 bp,分别编码了532和497个氨基酸(图2)。利用在线软件SMART分别对其保守结构域进行预测,FmPLT2在168-240和270-334含有AP2结构域,FmPLT3在224-296和326-390含有AP2结构域。AP2是PLT转录因子家族的特征结构域,进一步确认它们编码了PLT转录因子,将所得序列命名为FmPLT2和FmPLT3。
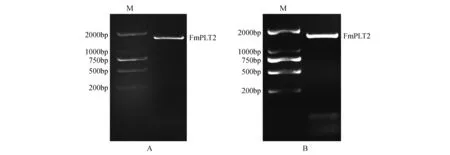
图1 FmPLT2(A)和FmPLT3(B)基因克隆Fig.1 PCR product of FmPLT2 and FmPLT3

图2 FmPLT2(A)和FmPLT3(B)基因核苷酸序列及其编码氨基酸序列 灰色阴影区域为AP2结构域;“*”代表终止密码子Fig.2 The nucleotide and encoded amino acid sequence of FmPLT2(A) and FmPLT3(B) Gray shaded area is the AP2 domain;“*” represents the stop codon
2.2 FmPLT2和FmPLT3蛋白生物信息学分析
2.2.1 FmPLT2和FmPLT3蛋白质理化性质
利用在线软件预测了FmPLT2和FmPLT3基因编码蛋白的理化性质,相对分子量分别为59和55 kDa左右,等电点分别为5.98和5.79,脂肪系数分别为61.65和59.76,半衰期都是30 h,不稳定系数分别为46.09和52.11,均为不稳定蛋白。两种蛋白中丝氨酸含量均最高,分别占总氨基酸含量的11.7%和10.9%。
利用Protscal在线软件预测了水曲柳FmPLT2和FmPLT3蛋白的亲水性和疏水性,FmPLT2平均亲水系数为-0.712,FmPLT3平均亲水系数为-0.600。通过亲水性分布图看到FmPLT2多肽链第280位的氨基酸最低分为-3.022,亲水性最强,第454位氨基酸最高分为1.367,疏水性最强。而FmPLT3多肽链的第62位氨基酸最低分为-3.511,亲水性最强,第434位氨基酸最高分为1.456,疏水性最强。根据氨基酸分值越低亲水性越强的规律,推测FmPLT2和FmPLT3这两个蛋白都为亲水性蛋白。经SignalP 4.1 Server预测FmPLT2和FmPLT3均无信号肽,且通过TMHMM Server.2.0预测两种蛋白均无跨膜区域,全部位于膜外。
2.2.2 FmPLT2和FmPLT3蛋白二级结构预测
利用在线软件对FmPLT2和FmPLT3的二级结构进行预测,FmPLT2蛋白由α螺旋(23.31%)、β折叠(16.17%)、β转角(3.95%)、无规则卷曲(56.58%)组成,FmPLT3蛋白由α螺旋(25.35%)、β折叠(13.08%)、β转角(4.83%)、无规则卷曲(56.74%)组成,说明这两个蛋白的二级结构都以无规则卷曲为主。
2.2.3 FmPLT2和FmPLT3蛋白三级结构预测
利用在线软件预测FmPLT2和FmPLT3的三级结构模型(图3)。可以从模型中看出FmPLT2蛋白三级结构预测与二级结构预测相似,都以α螺旋和β折叠为主要组成部分,而FmPLT3蛋白的三级结构则是以β折叠为主,α螺旋相对较少。
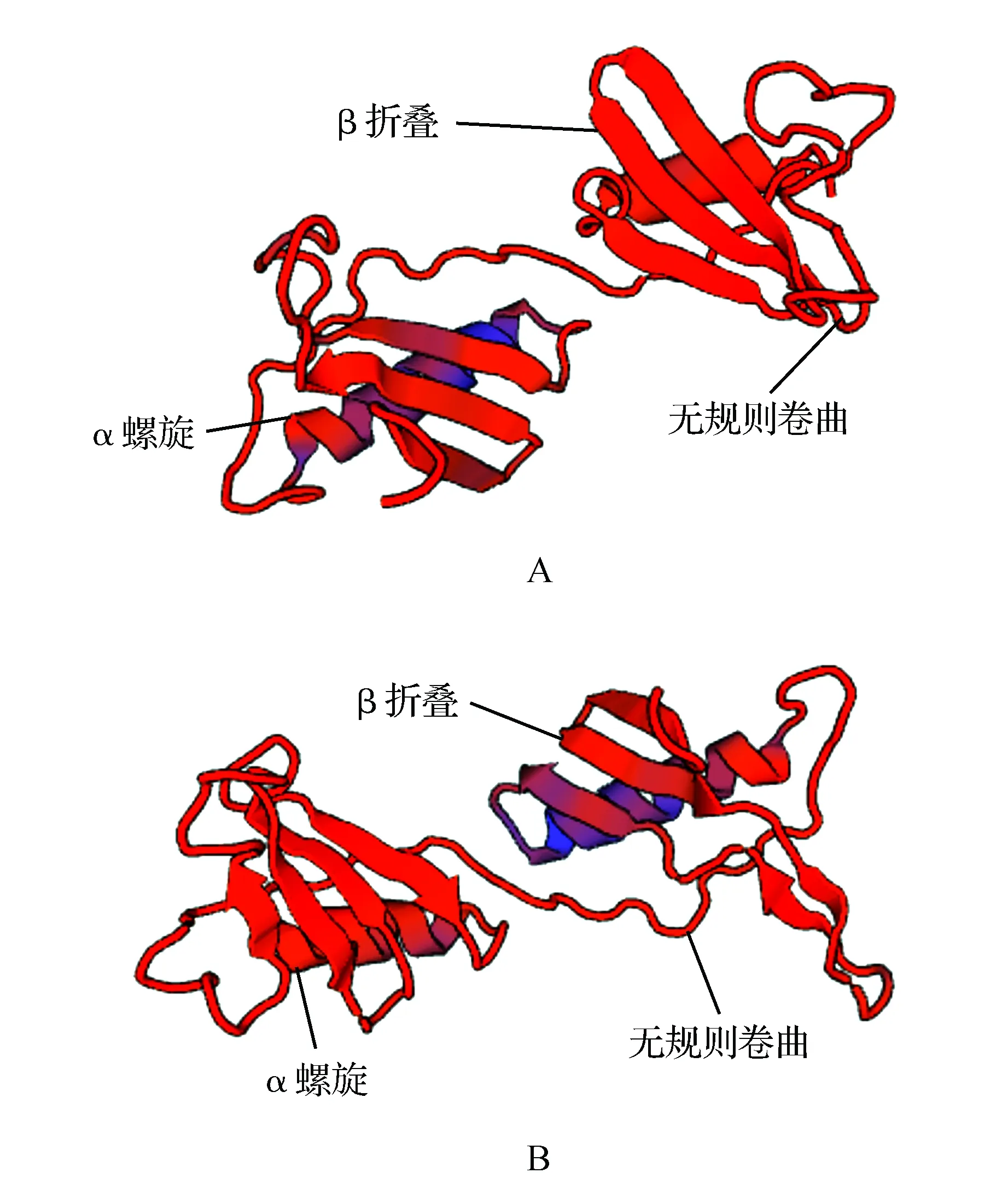
图3 FmPLT2(A)和FmPLT3(B)三级结构预测模型Fig.3 Predicted three-dimensional configuration of FmPLT2 and FmPLT3
2.2.4 FmPLT2和FmPLT3蛋白亚细胞定位预测
利用在线软件对FmPLT2和FmPLT3蛋白进行亚细胞定位,预测结果显示FmPLT2在细胞核中的概率是82.6%,在细胞质和线粒体中的概率都为8.7%;FmPLT3在细胞核中的概率为69.6%,在细胞质中为17.4%,在线粒体中为8.7%,在过氧化物酶体中为4.3%。利用NetPhos 2.0 Server预测蛋白的磷酸化位点,结果显示FmPLT2蛋白含有24个丝氨酸位点、5个苏氨酸位点和8个酪氨酸位点,FmPLT3蛋白含有27个丝氨酸位点、8个苏氨酸位点和5个酪氨酸位点。
2.3 FmPLT2和FmPLT3蛋白保守结构域及系统进化分析
分别以FmPLT2和FmPLT3蛋白的氨基酸序列为基础,在NCBI数据库中检索与水曲柳FmPLT2和FmPLT3蛋白同源性较高的其他物种的氨基酸序列进行比对。包括油橄榄(Oleaeuropaea)、毛果杨(Populustrichocarpa)、可可(Theobromacacao)、巴西橡胶树(Heveabrasiliensis)、木薯(Manihotesculenta)、榴莲(Duriozibethinus)、胡桃(Juglansregia)、烟草(Nicotianatabacum)的PLT2氨基酸序列和油橄榄(Oleaeuropaea)、毛果杨(Populustrichocarpa)、芝麻(Sesamumindicum)、葡萄(Vitisvinifera)、绒毛烟草(Nicotianatomentosiformis)、野生烟草(Nicotianaattenuata)、番木瓜(Caricapapaya)、番茄(Solanumlycopersicum)的PLT3氨基酸序列。利用MEGA7.0软件通过邻近法(Neighbour-Joining,NJ)构建系统发育进化树(图4)。从图4中能够看出水曲柳PLT转录因子与同属木犀科的油橄榄亲缘关系最为紧密,其次是PLT3与芝麻的关系较为亲近。
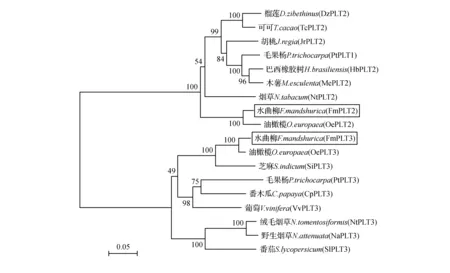
图4 FmPLT2和FmPLT3蛋白与部分植物PLT蛋白的同源性比较Fig.4 Homologous comparison of FmPLT2 and FmPLT3 protein with PLT protein from other species
图5 FmPLT2和FmPLT3蛋白同源序列比对 底部小写字母表示保守氨基酸;“·”表示缺失;黑色、粉色、绿色、黄色分别表示保守性为100%、≥75%、≥50%、≥33%的氨基酸;A和B为PLT转录因子的AP2结构域。Fig.5 Homologous alignments of FmPLT2 and FmPLT3 protein Lowercase letters at the bottom indicate conservative amino acids; “·” represents missing; The shadow of the black, pink, green, yellow represent conservative amino acids were 100%,≥75%,≥50%,≥33%; A and B are the AP2 domains of the PLT transcription factor.
利用Clustal X1.8将水曲柳、油橄榄、毛果杨等不同物种的PLT2和PLT3蛋白进行保守结构域多重比对分析(图5)。结果显示水曲柳FmPLT2蛋白与油橄榄OePLT2(XP_022874541.1)蛋白一致性最高,为70.30%,与毛果杨PLT1(XP_024453004.1)的一致性次之,为58.42%,与可可(XP_017982598.1)、巴西橡胶树(XP_021645779.1)、榴莲(XP_022756268.1)、烟草(XP_018807472.1)、木薯(XP_021634694.1)、胡桃(XP_018807472.1)PLT2蛋白一致性近似,分别为57.57%、57.00%、57.00%、56.86%、56.44%和56.29%。FmPLT3蛋白与油橄榄OePLT3(XP_022893842.1)一致性最高,为67.19%,与芝麻PLT3(XP_011097469.1)的一致性次之,为56.39%,与番木瓜(XP_021897531.1)、葡萄(XP_003635541.1)PLT3的一致性近似,分别为47.81%和47.52%,与番茄(XP_004250153.2)、绒毛烟草(XP_009603183.1)、野生烟草(XP_019245429.1)及毛果杨(XP_024460943.1)PLT3的一致性最差,分别为45.54%、45.50%、45.40%和44.13%。
2.4 FmPLT2和FmPLT3基因的表达分析
分别取水曲柳两月生实生苗的根、茎、叶、芽及水曲柳二十年生雄花,通过荧光定量检测FmPLT2和FmPLT3在不同组织中的表达情况(图6A)。从图6中可以看出,FmPLT2和FmPLT3在根中的表达量都高于在其他组织中的表达量,且在叶中的表达量均为最低。特别是FmPLT2在根中的表达量是叶中表达量的27.5倍之多。
通过不同组织的表达分析发现,FmPLT2和FmPLT3在根中的表达量均高于其他组织,所以想利用水曲柳组培苗生根过程来进一步探究这两个基因在生根过程中的表达情况(图6B)。本研究将生根处理前视为第0天,生根处理后第7、14和21 d视为生根第7、14和21 d。结果表明,FmPLT2在生根7天时的表达量显著升高,而FmPLT3在7天时与0天(未生根)时的表达量相比变化不明显。且FmPLT3的表达量在生根14天时达到高峰,是0天时表达量的3.8倍,随后下调;而FmPLT2的表达量却在7天后逐渐增长,随后进入缓慢上升状态,并在21天时达到高峰,是0天时表达量的32倍。
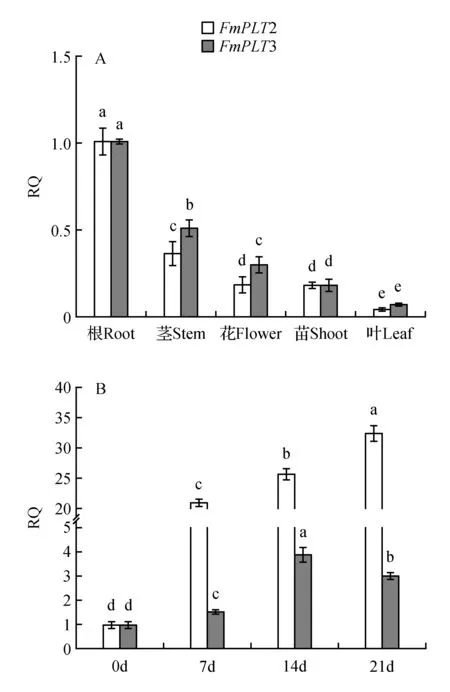
图6 水曲柳PLT基因的表达分析 A.不同组织中两个基因的表达量;B.不同生根天数时两个基因的表达量Fig.6 F.mandshurica PLT genes expression analysisA. Expression levels of two genes in different tissues; B. Expression levels of two genes in different rooting days
3 结论与讨论
近年来,植物根系发育的研究取得了显著的成果,其中PLT转录因子在根尖分生组织生长素遗传调控网络中起到了非常重要的作用,且实现了对PLT转录因子调控通路的初步探究[3]。其中还包括PLT基因在根——芽转化体系中的研究,研究表明由于PLT基因与控制茎尖分生组织发育的关键基因CUC2(CUPSHAPED-COTYLEDON)之间的调控关系,致使其在拟南芥芽再生通路中也发挥重要作用[27]。由于PLT基因与生长素的互作关系,使之成为叶原基发育与花发育通路的关键一环[9,28~29]。
目前,对PLT转录因子进行研究主要集中在拟南芥、小立碗藓和水稻等草本植物中[30~32]。水曲柳是“东北三大硬阔”之一,提高其繁殖规模对人工造林有着重大意义,但目前对水曲柳根系发育的研究报道甚少。本研究克隆了两个水曲柳PLT转录因子基因FmPLT2和FmPLT3。通过对核苷酸序列及编码产物生物信息学的分析发现,这两个基因各含有2个AP2特征结构域,且蛋白都为亲水性蛋白。同源序列比对及系统进化树分析表明,它们与同属木犀科的油橄榄OePLT2和OePLT3蛋白的同源性最高,与毛果杨PtPLT1和PtPLT3蛋白也有较高的一致性,可预测FmPLT2和FmPLT3转录因子在水曲柳根系发育过程中起到调控根尖分生组织规模的基点作用。通过亚细胞定位发现FmPLT3蛋白有一定概率存在于过氧化物酶体中,且过氧化物酶在细胞中参与植物细胞内吲哚乙酸的氧化分解和木质素的形成,从而起调节细胞的伸长和次生壁木质化的作用,也可作为组织老化的一种生理指标[33~34]。可进一步推测FmPLT3在根系发育时发挥作用。另外,也有研究者通过毛果杨PtPLT1(与FmPLT2同源)的表达来分析根系发育情况的报道[35]。可进一步推测FmPLT2在水曲柳根原基发生起重要作用。
同时,表达分析表明FmPLT2和FmPLT3基因在根中的表达量均高于其他组织,且利用植物激素对无根组培苗进行生根处理前后,两个基因都具有差异性的变化(图6B)。在处理后第7天,组培苗并没有根的发生,但FmPLT2基因表达却发生明显变化;而第14天时根系逐渐发生,此时FmPLT3基因才发生显著变化;在第21天时根生长处于最旺盛阶段,FmPLT2始终活跃的调控植株的生长发育,而FmPLT3在根发生后开始下调。虽然整个生根过程中FmPLT3的表达量变异幅度没有FmPLT2的表达量显著,但以往的都是将拟南芥AtPLT3、AtPLT5和AtPLT7这三个基因结合研究它们在根发育中的冗余作用[14]。所以对PLT3基因功能的研究还需更深层次的推进。而FmPLT2的显著变化可能与其参与细胞增殖和生长等多个发育途径有关[36]。但是上述推测有待进一步深入研究和验证,而本研究将作为后续水曲柳根系发育遗传网络调控的初步探索。
