干旱胁迫下拟南芥中H2S与ABA信号关系研究
2019-02-14王玥萱徐运飞赵启安
赵 敏 王玥萱 徐运飞 赵启安 刘 博 杨 宁*
(1.西北师范大学生命科学学院,兰州 730070; 2.信阳农林学院农学院,信阳 464000)
干旱已成为世界范围内严重限制农作物生产的主要因素之一,干旱对其各个生长发育阶段具有广泛的影响,包括种子萌发、营养生长、开花结实等。在干旱条件下,所有植物,无论它们的耐受性水平如何,都会激活相似的基本反应,如控制离子转运、特定渗透物质的积累或激活抗氧化系统。同时干旱对光合作用、呼吸代谢、水分和营养的吸收转运、有机物质的转化、运输、积累等都有着重要的影响[1]。有研究表明,干旱造成的作物减产超过所有自然灾害的总和,并且由于干旱缺水造成地表水源补给不足,只能依靠大量超采地下水来维持居民生活和工农业发展,进而导致植被严重退化、地下水位下降等一系列问题,使生态环境日益恶化[2]。因此,研究植物抗旱机制以提高作物的耐受性,将会为现代农业发展提供一定的理论基础。
H2S是一种无色易燃有臭鸡蛋气味的气体,长期以来,人们对H2S的认识仅局限于其毒性和环境污染等方面[3]。直到30年前,有研究证实,在大鼠脑中以及人脑中检测到有内源H2S含量的存在,推测H2S可能存在一定的生理作用[4]。近年来对H2S的研究成为医学领域的热点之一,研究表明H2S在调控神经系统和心血管系统方面具有重要的生理功能,被确认为是继一氧化氮(NO)和一氧化碳(CO)之后的第三种气体信号分子[5]。相对而言,H2S在植物中的研究较少。植物体内源H2S的产生主要是以L/D-半胱氨酸脱巯基酶(L/D-CDes)催化分解L/D-半胱氨酸(L/D-Cys)产生,L-CDes与D-CDes相比,L-CDes的催化活力更高[6]。外界的胁迫信号通过植物体内自身的信号传导途径传递到细胞内会激活抗逆基因的表达,使植物响应外界环境条件的变化,H2S的信号转导途径会参与这一复杂的应答机制[7]。硫氢化钠(NaHS)作为H2S的外源供体,参与植物种子发芽、根的形态建成[8~9]、提高多种植物抵御非生物胁迫,如干旱[10]、重金属胁迫[11]等。
植物激素是调节非生物胁迫下植物生长的关键因子,它们参与植物对环境胁迫的响应,其中脱落酸(ABA)是调节植物非生物胁迫耐受性中最关键的激素[12]。ABA属于类异戊二烯基团,是由质体2-甲基-赤藓糖醇-4-磷酸途径形成的副产物。ABA影响不同的生理过程,特别是在发育阶段如气孔开放、种子休眠、胚胎形态发生、贮藏蛋白质和脂质的合成[13]。ABA参与多种非生物胁迫,并触发各种信号传导途径。有研究证实,土壤干旱时,失水的根系首先会产生根源信号ABA,随木质部蒸腾流到达叶片的保卫细胞,从而抑制K+内流通道的活性,苹果酸渗出,保卫细胞膨压下降,最终促进气孔关闭[14]。在缺氮和干旱胁迫的情况下,ABA使植物产生各种适应性变化,例如促进根的生长[15]。除此之外,ABA还参与种子萌发、影响抗氧化酶和其他渗透调节物质的合成来提高其对干旱的耐受性[16]。干旱胁迫下ABA对植物耐受性的作用是显著的,但是ABA影响植物抗旱性的机制目前还不是特别清楚,有待进一步研究。
有研究表明H2S诱导气孔关闭具有浓度依赖性(<100 μmol·L-1),浓度太高(≥500 μmol·L-1)时气孔孔径反而会变大,并影响细胞的生活力;并且H2S也会影响ABA诱导气孔关闭的能力,影响ABA受体的表达,从而证实了H2S与ABA共同作用调节气孔,增强植物应对环境胁迫的能力[17]。有关信号分子H2S与ABA响应干旱胁迫中的信号关系鲜有报道。本文以野生型拟南芥WT、H2S合成酶缺失型突变体lcd和ABA1缺失突变体aba1为材料,以0.3 mol·L-1甘露醇模拟干旱胁迫,结合外源添加H2S、ABA供体NaHS、ABA,利用生理指标结合分子手段的方法,探讨ABA与H2S在拟南芥耐旱性中作用和关系,旨在揭示干旱胁迫下ABA和信号分子H2S的相互作用及信号关系,为进一步研究植物的抗旱机制提供一定的科学依据。
1 材料与方法
1.1 拟南芥的培养
本试验以WT、lcd(SALK_082099)和aba1(SALK_059469)突变体为研究材料。其中,WT种子由本课题组提供,lcd和aba1T-DNA插入突变体种子均购自美国俄亥俄州立大学拟南芥生物资源中心(ABRC)。
将拟南芥种子用无菌水浸泡后,放置于4℃冰箱中春化3 d。将种子用无菌水冲洗30 s,75%乙醇吹打30 s,无菌水冲洗30 s,随后用0.5%次氯酸钠溶液清洗2 min,无菌水冲洗3次。接种于MS+30 g·L-1蔗糖、pH5.8的琼脂培养基中,在温度23℃、光照2 000 lux、光周期为16/8 h的培养箱中培养16 d。土培苗按照土∶蛭石=2∶1的栽培方法,光周期为16/8 h,每周浇两次营养液,待生长至4周进行实验处理。
选择生长一致的拟南芥植株以0.3 mol·L-1的甘露醇进行干旱处理,处理时间为:6、12、24、48、72 h。实验以0 h作为空白对照,未添加甘露醇处理的作为阴性对照组,添加甘露醇处理为实验组。
1.2 突变体鉴定
1.2.1 拟南芥DNA提取
取生长4周的拟南芥新鲜叶片,按照Easy Pure® Plant Genomic DNA Kit提取总DNA。
1.2.2 突变体鉴定引物
根据http://signal.salk.edu/tdnaprimers.2.html设计,设计特异性引物分别如下(表1)。
表1突变体鉴定引物
Table1IdentificationofmutantprimersforPCRinthemanuscription
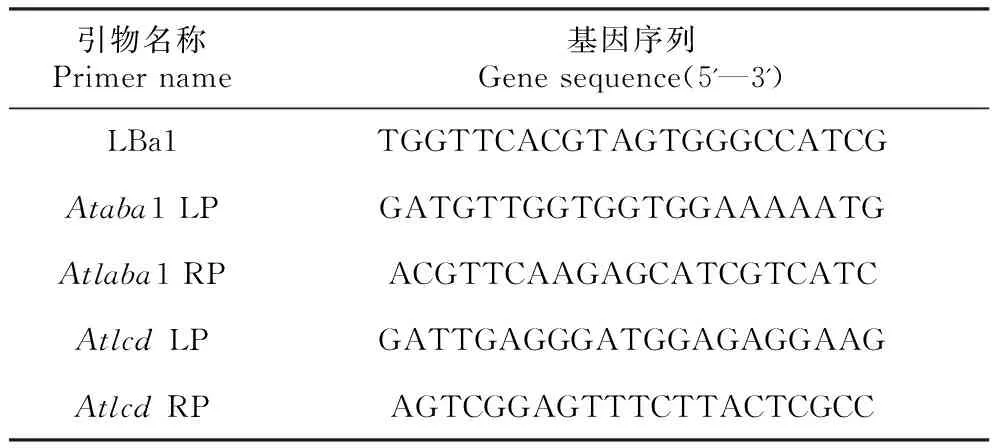
引物名称Primer name基因序列Gene sequence(5'—3')LBa1TGGTTCACGTAGTGGGCCATCGAtaba1 LPGATGTTGGTGGTGGAAAAATGAtlaba1 RPACGTTCAAGAGCATCGTCATCAtlcd LPGATTGAGGGATGGAGAGGAAGAtlcd RPAGTCGGAGTTTCTTACTCGCC
PCR采用20 μL体系:1 μLlcd、aba1上游引物(LP),1 μL下游引物(RP),WT、lcd、aba1 DNA模板1 μL,2×Taq PCR Star Mix with Loading Dye 10 μL,ddH2O 7 μL。PCR循环条件为:
lcd程序设定为:94℃ 10 min,30个循环(94℃ 30 s,54℃ 30 s,72℃ 30 s),72℃ 1 min。
aba1程序设定为:94℃ 10 min,30个循环(94℃ 30 s,60℃ 30 s,72℃ 30 s),72℃ 1 min。
采用1%的琼脂糖凝胶电泳,溴化乙锭(EB)染色,UVI凝胶图像分析系统观察照相。
1.3 拟南芥总RNA提取
使用TaKaRa公司的Trizol试剂盒进行提取,所有提取用品在121℃高压灭菌25 min,试验过程均在超净工作台进行,提取出的RNA用TaKaRa公司的Primer ScriptTMRT reagent Kit With gCDNA Eraser(Perfect Real Time)反转录试剂盒反转录成为cDNA。
1.4 RT-qPCR反应
定量引物用DNAstar软件PrimerSelect模块,设计特异性引物(表2)。
RT-qPCR反应体系:按照TAKARA公司的SYBR Premix Ex TaqTMⅡ(Tli RNaseH Plus)操作说明书于25 μL反应体系中进行PCR扩增(表3)。

表2 基因特异性引物

表3 qRT-PCR反应体系
1.5 L/D-CDes酶活、H2S含量以及ABA含量测定
H2S含量、ABA含量由上海酶联生物公司的试剂盒测定,具体操作按照说明书进行。L/D-CDes酶活性测定采用亚甲基蓝法[18],略有改动。具体方法如下:称取不同处理的拟南芥莲座叶0.2 g,加入2 mL 20 mmol·L-1Tris-HCl缓冲液研磨(pH7.4),离心后取上清。1 mL的反应体系为:0.8 mmol·L-1L/D-Cys,2.5 mmol·L-1DTT,100 mmol·L-1Tris-HCl pH9.0/pH8.0和100 μL上清液。将装有醋酸锌(ZnAc)的1.5 mL EP管装有含上述混合液的小三角瓶内,迅速将小三角瓶封严,于37℃摇床孵育15 min后,在EP管加入30 mmol·L-1FeCl3与20 mmol·L-1N,N-二甲基对苯二胺各100 μL摇匀终止反应。室温避光反应15 min后,在波长为670 nm的紫外可见分光光度计UNICO(UV-2102)中测定OD值,通过标准曲线计算L/D-CDes酶活性。
1.6 种子萌发率测定
选择均匀饱满的种子,每个处理设3个重复,每个重复有50颗种子,从开始光照培养时起,观察并统计萌发的种子数目,以胚根突破种皮1 mm即视为萌发,计算萌发百分率。
萌发率=第10天已萌发种子数/供试种子数×100%
(1)
1.7 数据统计
数据采用SPSS17.0对组间随时间变化的差异性多重比较采用LSD法分析,作图在Origin pro 9.0中进行。每次试验至少进行3次独立重复试验。
2 结果与分析
2.1 lcd与aba1纯合突变体的筛选
以WT为对照,通过三引物鉴定法对T-DNA插入突变体进行纯合突变体鉴定,其中纯合突变体中用基因特异性引物无法扩增出条带,用T-DNA特异性引物可以扩增出目的带,结果如图1所示,其中M为Marker,1泳道WT可用LP+RP引物扩增出片段,lcd和aba1突变株系用基因特异性引物LP+RP无法扩增出条带,而用T-DNA特异性引物LBb1+RP可以扩增出目的条带,证明T-DNA成功插入两条链中,从而筛选出lcd与aba1纯合突变体,扩繁并用于后续实验。
2.2 干旱胁迫对拟南芥种子萌发的影响
由图2可知,萌发10 d后,我们发现干旱胁迫下WT、lcd和aba1种子萌发明显滞后于其正常培养基中的萌发,且干旱对其生长也有一定的抑制作用。lcd和aba1的种子萌发率在胁迫处理第3 d明显低于WT,且WT、lcd和aba1在干旱胁迫下,种子萌发率分别降低14%,22%,48.65%,干旱胁迫对aba1的抑制效果要比lcd更为显著,说明LCD,ABA1基因均参与调控干旱胁迫下拟南芥的种子萌发过程,且lcd,aba1突变体对干旱胁迫更加敏感。
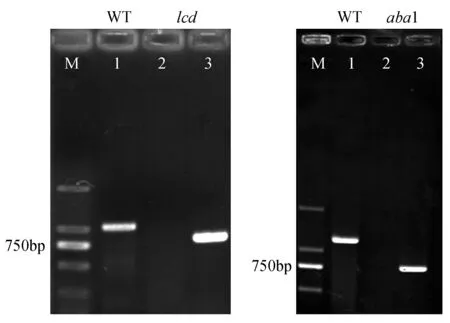
图1 lcd、aba1纯合突变体的PCR鉴定 A:1.WT,LP+RP;2.lcd,LP+RP;3.lcd,LB+RP B:1.WT,LP+RP;2.aba1,LP+RP;3.aba1,LB+RPFig.1 Identification of omozygous strains by PCR A:1.WT with LP+RP; 2.lcd with LP+RP; 3.lcd with LB+RPB:1.WT with LP+RP; 2.aba1 with LP+RP; 3.aba1 with LB+RP
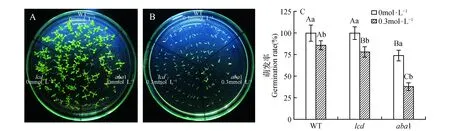
图2 干旱胁迫对WT、lcd、aba1拟南芥生长(A)、种子萌发率(B)的影响 图中小写字母表示同一株系不同浓度在P<0.05时的显著性差异,大写字母表示不同株系同一浓度在P<0.05时的显著性差异,下同。Fig.2 Effects of drought stress on growth(A) and seed germination rate(B) of WT,lcd and aba1 The lowercase letters in the figure indicate the significant differences in the different concentrations of the same strain at P<0.05,and the uppercase letters indicate the significant difference in the same concentration of different strains at P<0.05,the same as below.
2.3 干旱胁迫对野生型拟南芥H2S含量、L/D-CDes酶活性及ABA含量的影响
由图3A可知,干旱胁迫下,野生型拟南芥內源H2S含量增加,从图3中可以看出,在不同的干旱胁迫时间处理下,H2S含量均显著高于空白对照组。与对照组相比,0.3 mol·L-1甘露醇处理下,H2S含量分别在24 h最低,72 h达到最大值。同时干旱胁迫显著提高了拟南芥叶片中L/D-CDes活性(图3B),且L/D-CDes酶活性的变化变化趋势相似,但L-CDes>D-CDes。由此得出H2S响应干旱胁迫,且L-CDes与干旱诱导的H2S合成紧密相关。
图3C表示干旱胁迫下ABA含量随甘露醇处理时间的变化,干旱胁迫下,ABA含量显著提高,在处理时间范围內,ABA含量变化呈波动趋势,其中在12 h达到最大值,说明ABA响应干旱胁迫。
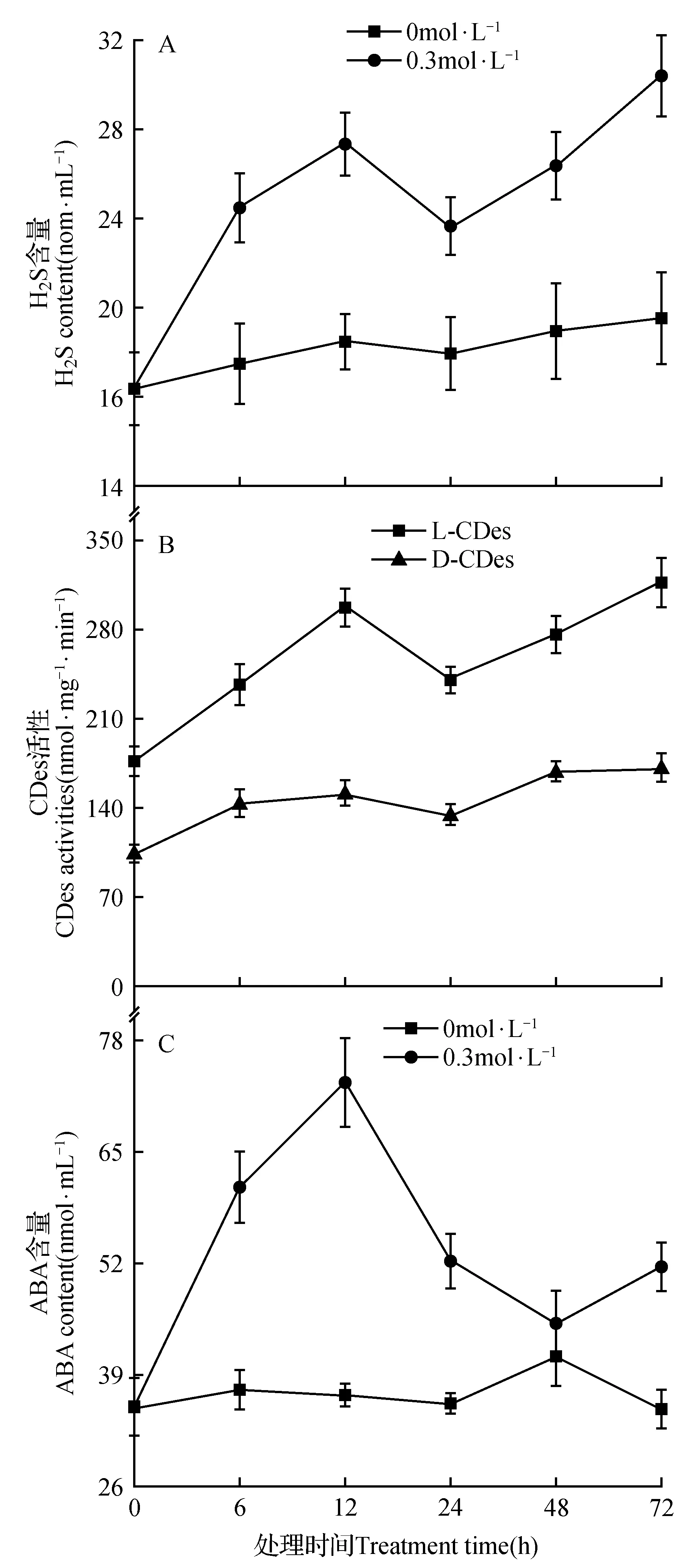
图3 干旱胁迫对野生型拟南芥H2S含量(A)、L/D-CDes活性(B)、ABA含量(C)的影响Fig.3 Effects of H2S content (A),L/D-CDes activities (B) and ABA content (C) under drought stress in Wild-type Arabidopsis
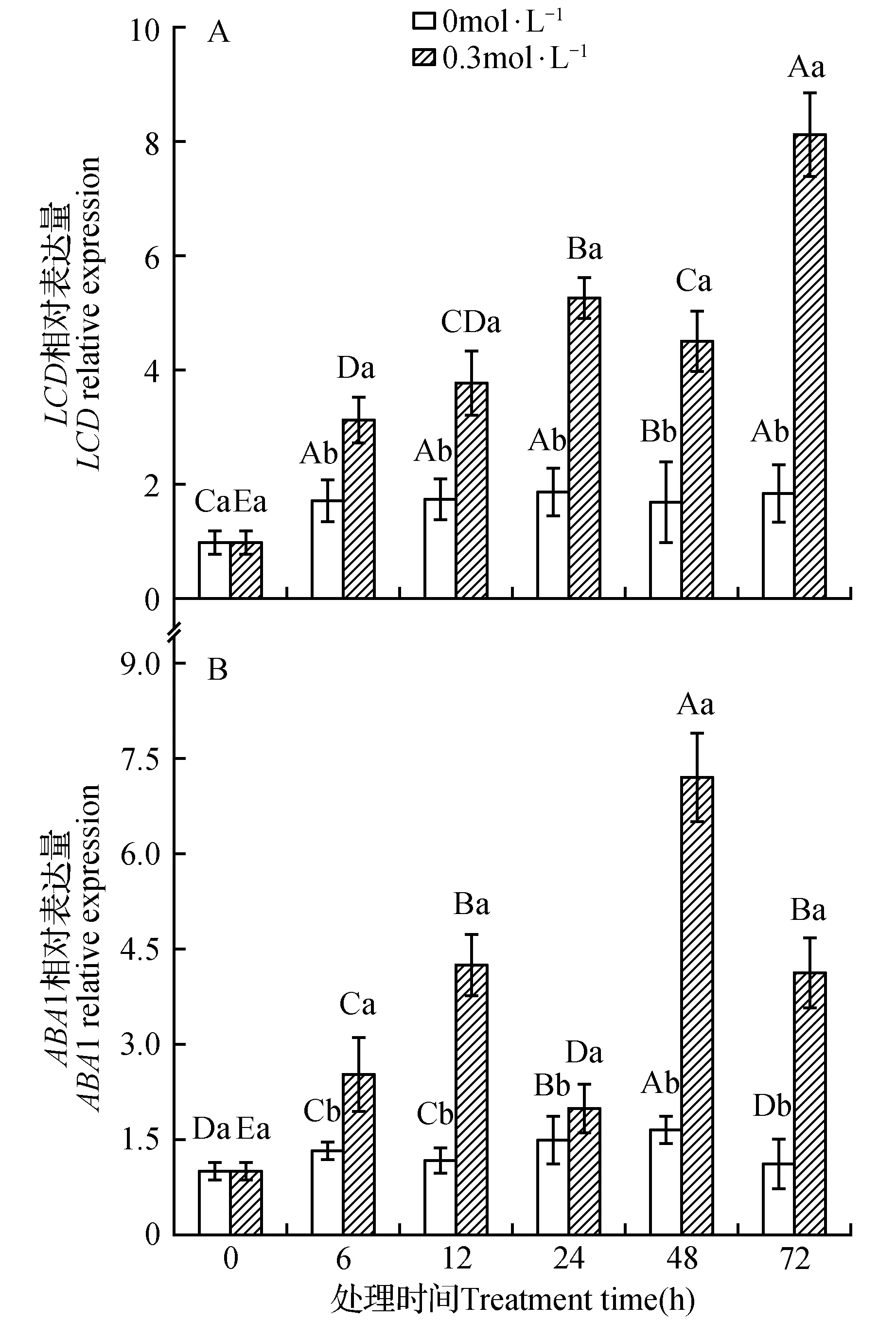
图4 干旱胁迫对野生型拟南芥中LCD(A)、ABA1(B)基因相对表达的影响 图中小写字母表示同一时间不同浓度在P<0.05时的显著性差异,大写字母表示不同时间同一浓度在P<0.05时的显著性差异,下同。Fig.4 Effects of drought stress on the gene relative expressions of LCD(A) and ABA1(B) in wild-type Arabidopsis The lower case letters indicate the same time different concentrations at P<0.05 when the significant difference between the capital letters that the same concentrations at the different time in the P<0.05 significant difference,the same as below.
2.4 干旱胁迫对野生型拟南芥LCD、ABA1相对基因表达量的影响
在干旱胁迫下,合成L-CDes和ABA的基因LCD、ABA1基因相对表达的变化如图4所示。图4A表明,LCD基因相对表达总体表现逐渐增加的趋势,且变化趋势与L-CDes酶活性基本保持一致,在72 h达到峰值。图4B表示ABA1基因相对表达随干旱胁迫时间的变化情况,在6~72 h的处理时间内,其基因相对表达随干旱胁迫时间的延长进一步增加,总体呈波动趋势,分别在24 h达到最小和在48 h达到最大值。转录水平分析表明,干旱胁迫通过改变LCD,ABA1基因的表达从而使L-CDes酶活性及ABA含量发生变化。
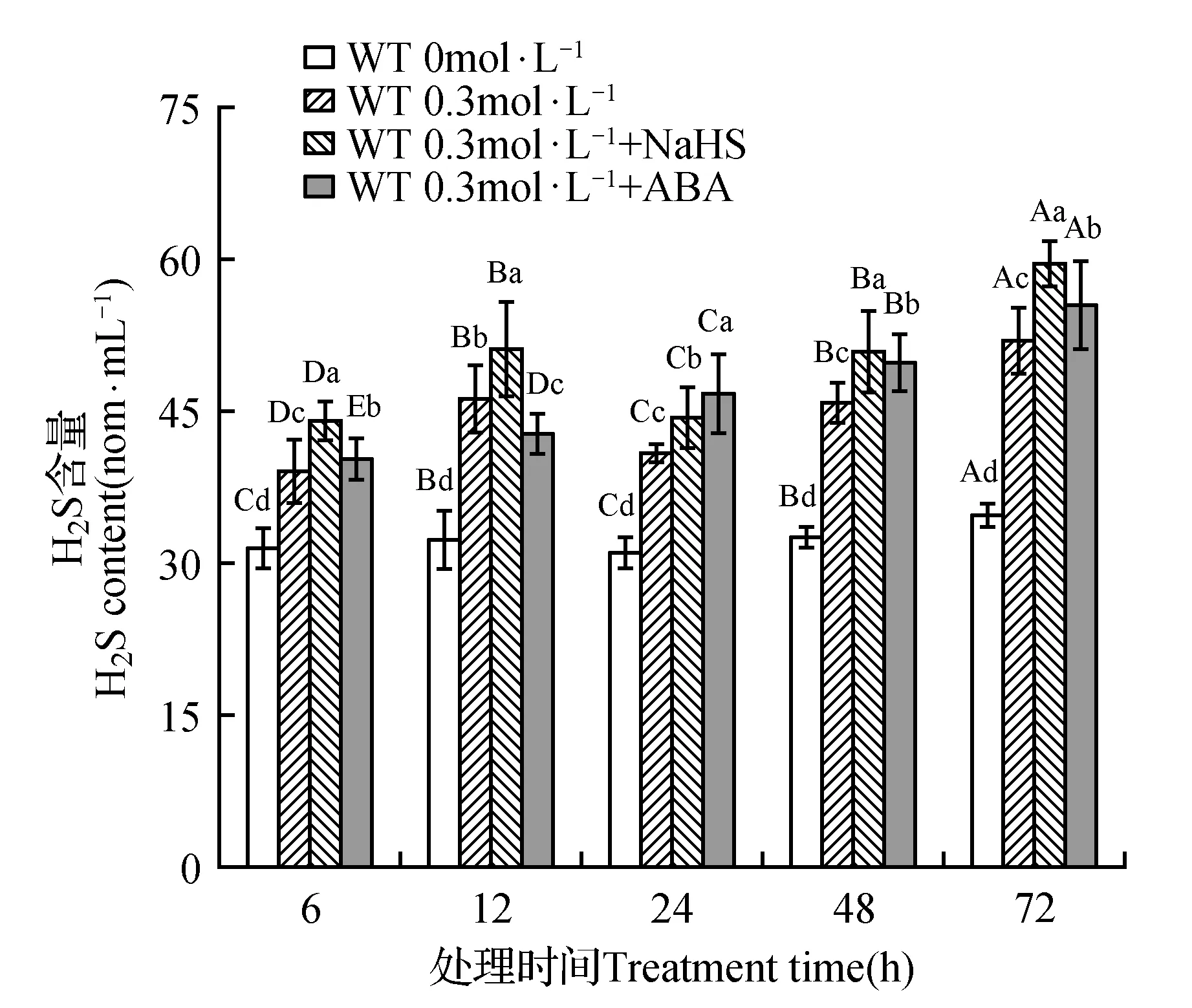
图5 干旱胁迫下,外源添加NaHS、ABA对WT中H2S含量的影响Fig.5 Effects of exogenous NaHS,ABA on H2S content in WT under drought stress
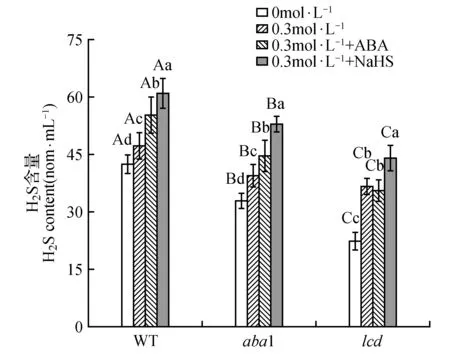
图6 干旱胁迫下,外源添加NaHS或ABA对WT、aba1和lcd中H2S含量的影响Fig.6 Effects of exogenous NaHS or ABA on the content of H2S in WT,aba1 and lcd under drought stress
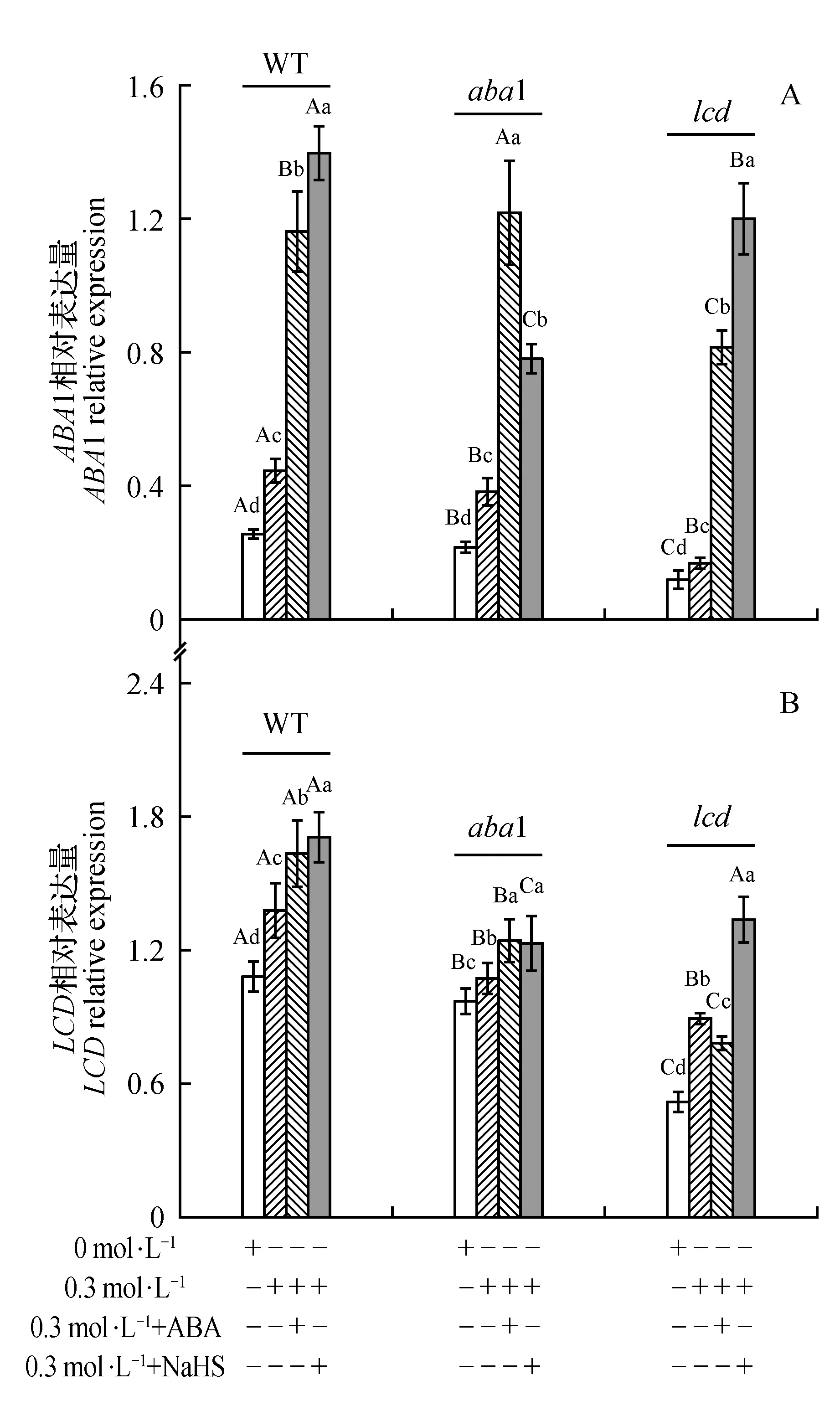
图7 外源NaHS、ABA对干旱胁迫下WT、aba1、lcd中ABA1、LCD相对基因表达量的影响Fig.7 Effects of exogenous NaHS or ABA on the relative expression of ABA1 and LCD in WT,aba1 and lcd under drought stress
2.5 干旱胁迫下,外源NaHS、ABA对野生型拟南芥內源H2S含量的影响
如图5所示,干旱胁迫下,分别外源添加150 μmol·L-1NaHS,25 μmol·L-1ABA后,随着处理时间,H2S含量会显著上升。表明ABA及H2S供体NaHS显著影响野生型拟南芥H2S的产生,说明干旱胁迫下,ABA和H2S存在一定的联系。
2.6 干旱胁迫下,外源NaHS、ABA对WT、lcd和aba1中內源H2S含量的影响
我们利用WT、H2S合成酶缺失型突变体lcd和ABA1缺失突变体aba1,通过外源添加NaHS、ABA对LCD、ABA1基因的缺失进行补偿实验,研究干旱胁迫下,ABA和H2S的信号关系(图6)。
干旱胁迫下,外源添加NaHS或ABA后,aba1中H2S含量的均显著上升,说明外源NaHS与ABA对aba1中內源H2S的释放产生作用,外源添加NaHS促进WT、aba1与lcd中H2S产生,但aba1与lcd没有恢复WT中H2S的释放量,说明调控H2S产生的不仅仅只有ABA1与LCD。当外源添加ABA后,对lcd中H2S的产生没有显著的促进作用,初步说明H2S位于ABA下游。
2.7 干旱胁迫下,外源NaHS、ABA对WT、lcd和aba1中LCD、ABA1相对基因表达量的影响
为了进一步证实H2S位于ABA下游,我们通过转录水平,研究外源NaHS、ABA对WT、lcd、aba1中LCD、ABA1基因相对表达的影响,结果如图7所示,干旱处理48 h后,胁迫诱导WT、aba1和lcd中ABA、LCD基因相对表达上调,其中aba1和lcd中ABA、LCD基因相对表达显著低于WT中ABA1、LCD基因相对表达,当外源添加H2S供体NaHS进行补偿LCD的缺失后,WT、lcd、aba1中ABA1与LCD基因相对表达均有不同程度的提高,而外源添加ABA进行补偿ABA1的缺失后,WT与aba1中ABA1,LCD基因相对表达上调,但ABA对lcd突变体中LCD基因相对表达促进作用不明显,转录水平进而证实了H2S位于ABA下游发挥作用这一结论。
3 讨论
植物的生长发育经常会受到环境非生物因素的极大影响,如干旱、高盐、低温等,植物处于逆境环境时,首先要响应并适应这些胁迫条件从而在逆境中生存,而干旱作为一种重要的环境因素一直是国内外研究的热点[19]。
H2S是新发现的第3种内源性气体信号分子,参与在植物多种生理过程。植物中H2S主要通过的产生半胱氨酸脱巯基酶(CDes)催化半胱氨酸产生,目前拟南芥中已经克隆了一些CDes编码基因,其中LCD与DCD是植物内源H2S产生过程中编码CDes合成酶功能最明确的两个基因[20]。越来越多的研究表明,H2S作为新型气体信号分子会参与低温、高盐和干旱胁迫下的信号转导,且外源NaHS能够缓解胁迫所引起的损伤[21]。植物激素是一类小分子化合物,调控了植物生长、发育和对环境变化的响应。通过改变激素的合成、运输和信号转导,植物能够调节生长与胁迫耐受的平衡,从而促进植物在胁迫环境中生存。ABA作为一种重要的植物激素,它在植物的生长发育过程中发挥着重要的作用[22]。孙丽敏等[23]发现H2S信号和WRKY会增强ABA调节根生长和气孔运动显示H2S与ABA之间存在密切关系。但关于干旱胁迫下,H2S与ABA在植物中的信号作用关系鲜有报道。
干旱影响植物的生长发育,本文通过测定WT、lcd和aba1的种子萌发率的结果发现干旱胁迫下lcd和aba1突变体的萌发率均显著低于WT,且aba1种子发芽率抑制作用最为明显(图2),说明ABA对干旱胁迫更加敏感。干旱胁迫促使拟南芥幼苗中H2S含量的增加以及CDes活性的增强(图3),二者在6~72 h胁迫时间内有相同的变化趋势(图3:A~B),CDes活性变化中,L-CDes活性始终高于D-CDes活性,说明干旱胁迫下,在合成H2S中,L-CDes占主导作用。这与本课题组前期关于干旱胁迫下研究拟南芥中H2S与PLDα1响应干旱胁迫作用的研究结果相一致[24],另一方面,干旱胁迫也会诱导ABA含量的上升(图3C),且ABA含量随处理时间呈波动趋势。H2S和ABA都会积极响应干旱胁迫,推测二者在响应胁迫的过程中有一定的联系。
对干旱胁迫下LCD和ABA1的基因表达进行定量分析发现,干旱胁迫均能诱导LCD和ABA1表达上调(图4),且LCD与L-CDes酶活性的变化趋势相同,在72 h达到最大,说明在干旱上调LCD的表达,从而促使L-CDes酶活性的变化。如图4B,ABA1表达在48 h达到峰值,但ABA含量却在12 h就已经达到了最大值,说明ABA含量变化先于ABA1的表达,ABA1表达有滞后效应。为了证明H2S和ABA存在联系,分别外源添加150 μmol·L-1NaHS,25 μmol·L-1ABA后发现,随着处理时间的延长,H2S含量会显著上升(图5),说明ABA和H2S供体NaHS能够显著影响野生型拟南芥H2S产生,进一步说明了干旱胁迫下,ABA与NaHS可能参与H2S的合成。
以拟南芥WT、突变体aba1和lcd为研究材料,通过外源添加ABA与NaHS进行补偿实验,探究ABA与H2S在干旱胁迫下的信号关系。结果表明,干旱胁迫诱导H2S的产生。外源添加NaHS和ABA后,促进了WT、aba1和lcd中H2S的释放(图6),说明即使ABA1,LCD基因缺失,但NaHS对WT、aba1、lcd中H2S释放仍然有促进作用,当外源添加NaHS补偿LCD的缺失后,H2S含量显著上升,但aba1与lcd并没有恢复WT中H2S的释放量,说明调控H2S产生的不仅仅只有ABA1与LCD。此结果与Qiao Z等人研究CDPKs通过在拟南芥中增强H2S信号来增强Cd耐受性的研究结果相似[25],当外源添加ABA后,促进了WT,aba1中H2S的释放,却对lcd中H2S的产生没有显著的促进作用(图6),说明ABA诱导H2S的产生依赖于LCD,也初步说明了H2S可能位于ABA下游。
为了证实上一结论,我们从转录水平分析H2S与ABA响应干旱胁迫的信号关系。如图7A所示,干旱胁迫能均诱导WT、aba1和lcd突变体拟南芥中ABA1、LCD的基因相对表达,aba1和lcd中ABA1、LCD的基因相对表达显著低于WT中ABA1、LCD的基因相对表达,表明干旱胁迫通过上调ABA1、LCD的基因相对表达从而促进ABA含量与H2S含量上升。外源添加NaHS、ABA后,WT、lcd、aba1中ABA1基因相对表达均有不同程度的提高,但lcd、aba1中ABA1基因相对表达并没有恢复到WT中ABA1基因相对表达水;NaHS、ABA对lcd、aba1中H2S含量的影响也得到了相似的结果,当外源添加NaHS、ABA后,促进WT、aba1中LCD的表达,表明aba1突变体中缺失ABA1基因并没有影响LCD基因相对表达,但外源ABA对lcd突变体中LCD基因的表达没有显著的促进作用,说明干旱胁迫通过ABA促进H2S的释放与上调LCD基因相对表达进而调控植物生长,干旱胁迫下H2S信号转导依赖于ABA1。转录水平证实了H2S位于ABA下游发挥作用这一结论。
综上,本研究表明干旱胁迫下,植物通过上调LCD、ABA1基因相对表达从而提高CDes酶活性,ABA含量的效果,进而开启H2S与ABA响应干旱的途径;在该响应途径中,H2S位于ABA信号下游发挥作用,但信号途径存在复杂而紧密的作用机制,这种作用机制仍值得进一步深入研究。
