刚毛柽柳S-腺苷甲硫氨酸合成酶(ThSAMS)基因的克隆及表达分析
2019-02-14王艳敏王玉成
张 悦 赵 鑫 侯 峥 王艳敏,2 王玉成 王 超*
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040; 2.黑龙江省林业科学研究所,哈尔滨 150081)
S-腺苷甲硫氨酸合成酶(SAMS)是植物代谢中的一个关键酶,它催化甲硫氨酸与ATP生物合成S-腺苷甲硫氨酸(SAM)。SAM是生物体中重要的代谢物质,参与了植物的转甲基、转氨丙基和转硫反应等多种生理过程[1~3]。SAM作为重要的甲基供体,为核酸、蛋白质、多糖、脂质等提供甲基化修[4]。SAM具有转氨丙基功能,在多胺(精胺、亚精胺等)合成途径中发挥重要作用[5]。此外,SAM还参与乙烯、谷胱甘肽、甜菜碱以及木质素的合成和代谢过程[6~8]。因此,SAMS基因在植物生长发育、新陈代谢及逆境胁迫响应过程中都发挥重要作用。
目前,SAMS基因已在拟南芥[9]、小麦[10]、玉米[11]、杨树[12]、松树[13]等多种植物中被克隆,并且发现在一些植物中SAMS基因家族具有多个成员,拟南芥中有4个SAMS成员、玉米中4个、番茄中有3个[14]、烟草中至少有2个[15]。在拟南芥基因SAMS家族4个成员中,SAMS1、SAMS2和SAMS4在所有组织中均有表达,而SAMS3主要在花粉中表达[16~17]。玉米SAMS基因家族4个成员根茎中的表达量大于叶片,其中SAMS1、SAMS2和SAMS4的表达受盐胁迫诱导,而SAMS3不受盐胁迫诱导[11]。松树PcSAMS1优先在根中表达,并且在不定根分生组织中特异性表达,而PcSAMS2在根和芽中表达并且在不定根形成期间表达下调[13]。可见,虽然植物SAMS基因序列具有较高的相似性,但不同植物SAMS基因或同一物种的不同家族成员之间的表达模式具有明显的组织和时间特异性[16~18],表明不同的SAMS基因可能参与了不同的生理代谢过程。因此,克隆不同物种的SAMS基因,对进一步了解该基因的功能具有重要意义。
刚毛柽柳(Tamarixhispida)是一种生长在干旱沙漠中的树种,能吸收到深层的地下水,并且能在含盐0.5%~1%的盐碱地上生长,具有很强的抗干旱和抗盐碱能力,表明其体内存在大量具有抗逆功能的基因资源,是研究木本植物抗逆机制和筛选及分离抗逆基因的理想材料[19]。但是,目前为止关于刚毛柽柳SAMS基因结构和功能的研究未见报道。本研究克隆了一条编码刚毛柽柳SAMS基因ThSAMS全长cDNA序列,对该序列进行了生物信息学分析,利用qRT-PCR技术分析其在NaCl、PEG和外源ABA胁迫下的表达模式,为进一步研究ThSAMS在刚毛柽柳非生物胁迫应答中的功能奠定基础。
1 材料与方法
1.1 实验材料及处理方法
将采自中国科学院吐鲁番沙漠植物园的刚毛柽柳种子播种于V(泥炭土)∶V(沙)为1∶3的混合土中,放置于温室培养,温室培养条件为:平均温度24℃,相对湿度70%~75%,光照强度400 μmol·m-2·s-1,光周期为16 h/8 h。选取生长状态良好和长势相同的2月龄刚毛柽柳幼苗对其进行处理,分别用0.4 mol·L-1NaCl、20%(w/v)PEG6000和和100 μmol·L-1ABA浇灌柽柳幼苗,在胁迫处理1、2、6、12、24、48 h后,分别取刚毛柽柳的根部组织和地上部分组织,每个时间点同时用正常浇水幼苗作为对照,每个处理重复3次,每个样品至少15棵幼苗,使其充分混合后用液氮速冻,置于-80℃冰箱用于提取RNA。
1.2 总RNA的提取和cDNA的合成
用CTAB法提取不同胁迫处理的刚毛柽柳地上和地下组织总RNA,参照PrimeScriptTMRT reagent Kit(TaKaRa)试剂盒说明进行反转录合成cDNA第一条链。
1.3 ThSASM全长cDNA序列克隆
根据刚毛柽柳转录组数据中Unigenes功能注释结果,查找并获得一条SAMS基因的序列。为了验证基因序列的准确性,利用primer premier 5.0设计引物,上游引物P1序列为TGCTGGTGACCAAGGTCACATGTTTGGCTAC,下游引物P2序列为GGTGGTGCTTTCTCCGGAAAGGAC,以柽柳cDNA为模板对该基因进行PCR扩增,得到目的条带进行胶回收纯化后,连接到pMD18-T载体上进行测序。获得ThSASM基因全长序列。
1.4 ThSASM基因及蛋白的生物信息学分析
利用在线工具ORF founder分析ThSAMS基因的开放读码框(http://www.ncbi.nlm.nih.gov/gorf/gorf.html);利用ExPASy在线软件(http://www.expasy.org/tools/protparam.html)预测ThSAMS编码的氨基酸序列的分子量及理论等电点;用二级结构预测软件(https://www.predictprotein.org/)预测ThSAMS基因编码蛋白质的二级结构;用Protscale在线分析ThSAMS蛋白质的疏水性(http://web.expasy.org/cgi-bin/protscale/protscale.pl);用PSORT进行亚细胞定位预测(https://www.genscript.com/psort.html)。通过NCBI(http://blast.ncbi.nlm.nih.gov/Blast.cgi)网站进行BlastP检索,获得与刚毛柽柳ThSAMS基因同源性较高的10种植物的SAMS基因蛋白序列,利用BioEdit软件进行多序列比对,对其进行蛋白序列保守结构分析,并利用MEGA6.0软件预测系统发育树。
1.5 ThSASM基因表达分析
利用实时荧光定量RT-PCR技术对ThSASM基因的表达进行分析。根据ThSAMS全长cDNA序列设计定量引物(表1),以刚毛柽柳β-actin(FJ618517)、α-tubulin(FJ618518)和β-tubulin(FJ618519)基因作为内参基因,引物序列见表1。利用MJ Opticon实时定量PCR仪(Bio-Rad,Hercules,CA)分析ThSAMS基因的表达模式。实时荧光定量RT-PCR使用全式金的TransStart Top Green qPCR SuperMix试剂盒,反应体系为:2×TransStart Top Green qPCR SuperMix 10 μL,稀释10倍后的模板cDNA 2 μL,上游引物和下游引物(10 μmol·L-1)各1 μL,加灭菌去离子水补足体积至20 μL。反应程序为:94℃预变性30 s;94℃变性12 s,58℃退火30 s,72℃延伸45 s,79℃读板1 s,45个循环。待PCR反应结束后,将反应温度以0.5℃·s-1的速度从55℃升到99℃。每个样品重复3次,用2-△△Ct方法进行基因的相对定量分析[20~21]。
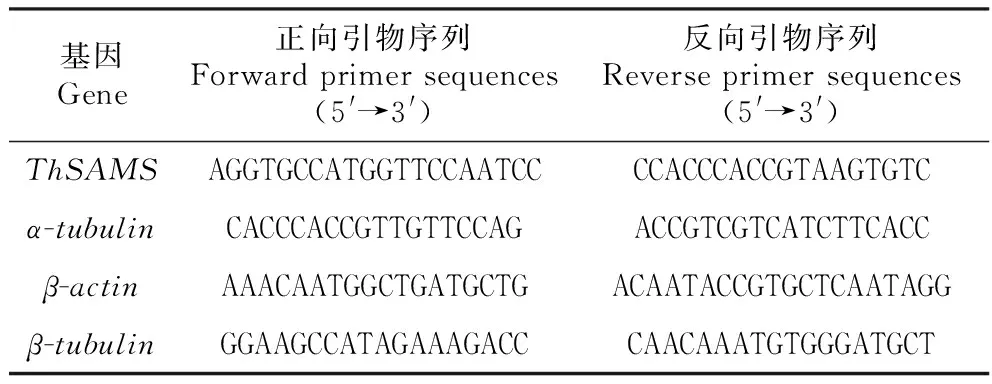
表1 实时定量RT-PCR引物序列
2 结果与分析
2.1 ThSAMS基因全长cDNA的获得
通过分析刚毛柽柳转录组数据设计全长序列的上、下游引物P1和P2,经PCR扩增,产物由琼脂糖凝胶电泳分离后呈现一条长约1 185 bp的特异性条带(图1)。与预期片段大小一致。将该序列胶回收后连接至pMD18-T上,基因测序结果与转录组碱基完全相同,将此基因命名为ThSAMS。
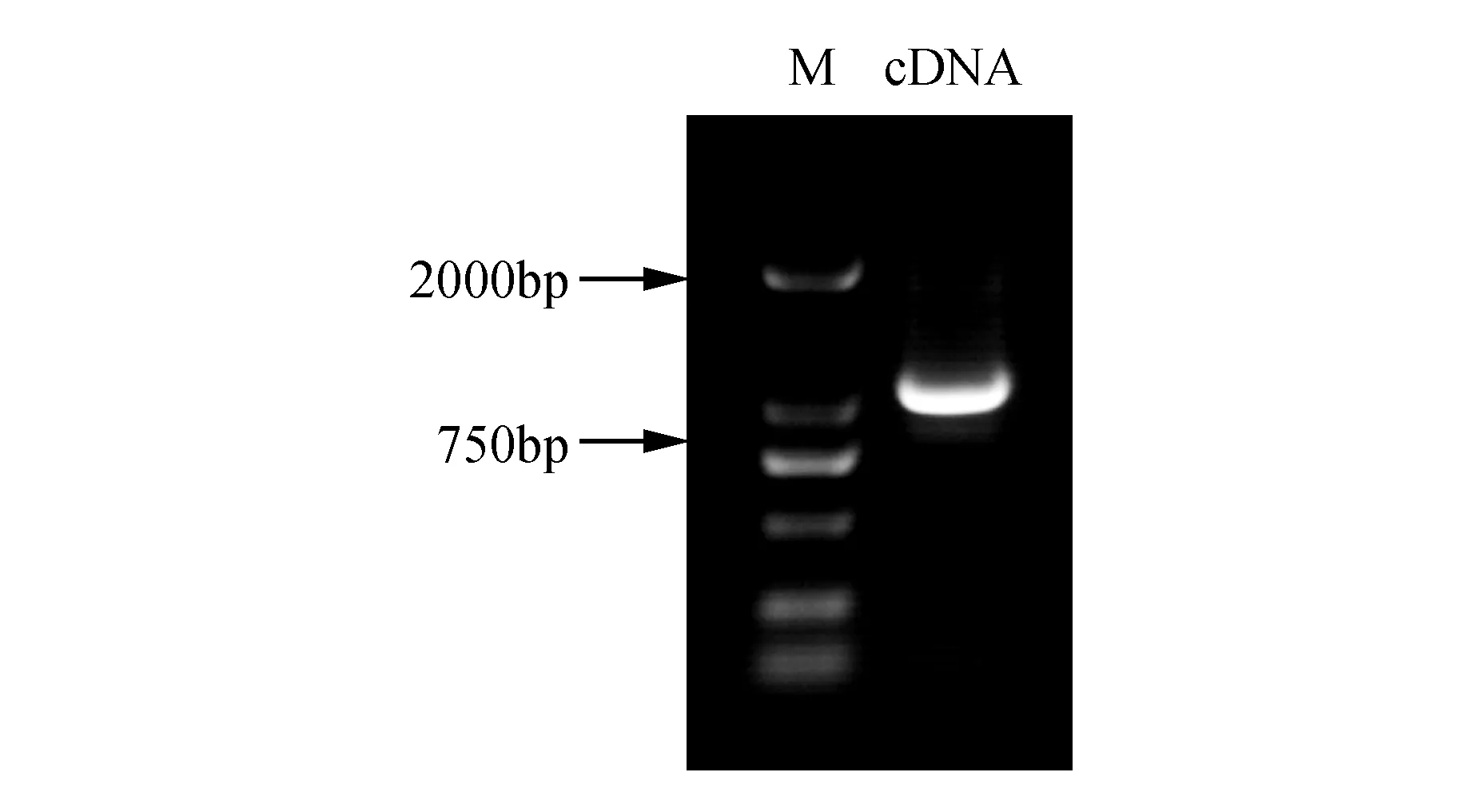
图1 柽柳ThSAMS基因的克隆Fig.1 Cloning of ThSAMS gene from T.hispida
2.2 ThSAMS基因的生物信息学分析2.2.1 ThSAMS氨基酸组成、理化性质分析
运用ORF Finder和ExPASy进行分析,得知ThSAMS基因cDNA全长(ORF)为1 185 bp,编码394个氨基酸序列(图2A)。ThSAMS基因编码蛋白的相对分子质量为97.85 kDa;理论等电点PI为5.02,推测其分子式为C3529H5875N1185O1478S290。蛋白质不稳定系数估算值为47.75,为不稳定性蛋白质。理论推导出半衰期大约为4.4 h;亲水性平均数为0.765,预测该蛋白为亲水性蛋白,与Protscale在线分析ThSAMS蛋白质的疏水性结果一致(图3B)。利用NCBI CD-Search service工具对ThSAMS编码蛋白的结构域进行分析,结果表明,ThSAMS基因序列氨基酸区域含有S-AdoMet_synt_C超级家族核心序列(图2B)。
2.2.2ThSAMS基因二级结构预测
根据蛋白质二级结构预测,发现ThSAMS二级结构由无规则卷曲,α-螺旋和β-折叠组成。其中以无规则卷曲为主,占46.67%(约184个氨基酸),其次是α-螺旋占29.74%(约117个氨基酸),其中β-折叠占23.59%(约93个氨基酸)(图3A)。利用Protscale分析发现(图3B),亲水氨基酸均匀的分布在整个ThSAMS编码蛋白质的肽链上且具有明显的亲水区,整条多肽链表现为亲水性。利用SignlP4.1Server进行氨基酸序列信号肽分析发现ThSAMS基因编码的蛋白没有信号肽存在(图3C)。
2.2.3 ThSAMS蛋白的亚细胞定位分析
利用Psort对ThSAMS蛋白的亚细胞进行定位预测,表2是可能定位在细胞质、线粒体、细胞核、过氧化氢酶和质膜上的概率,结果显示定位在细胞质概率最大(60.9%),其它定位概率较小,表明ThSAMS可能定位在细胞质中。
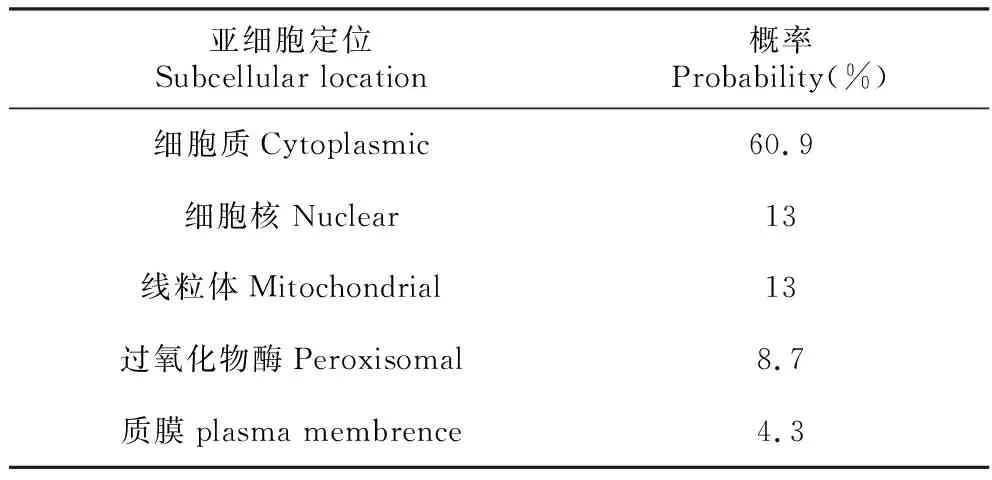
表2 ThSAMS亚细胞定位
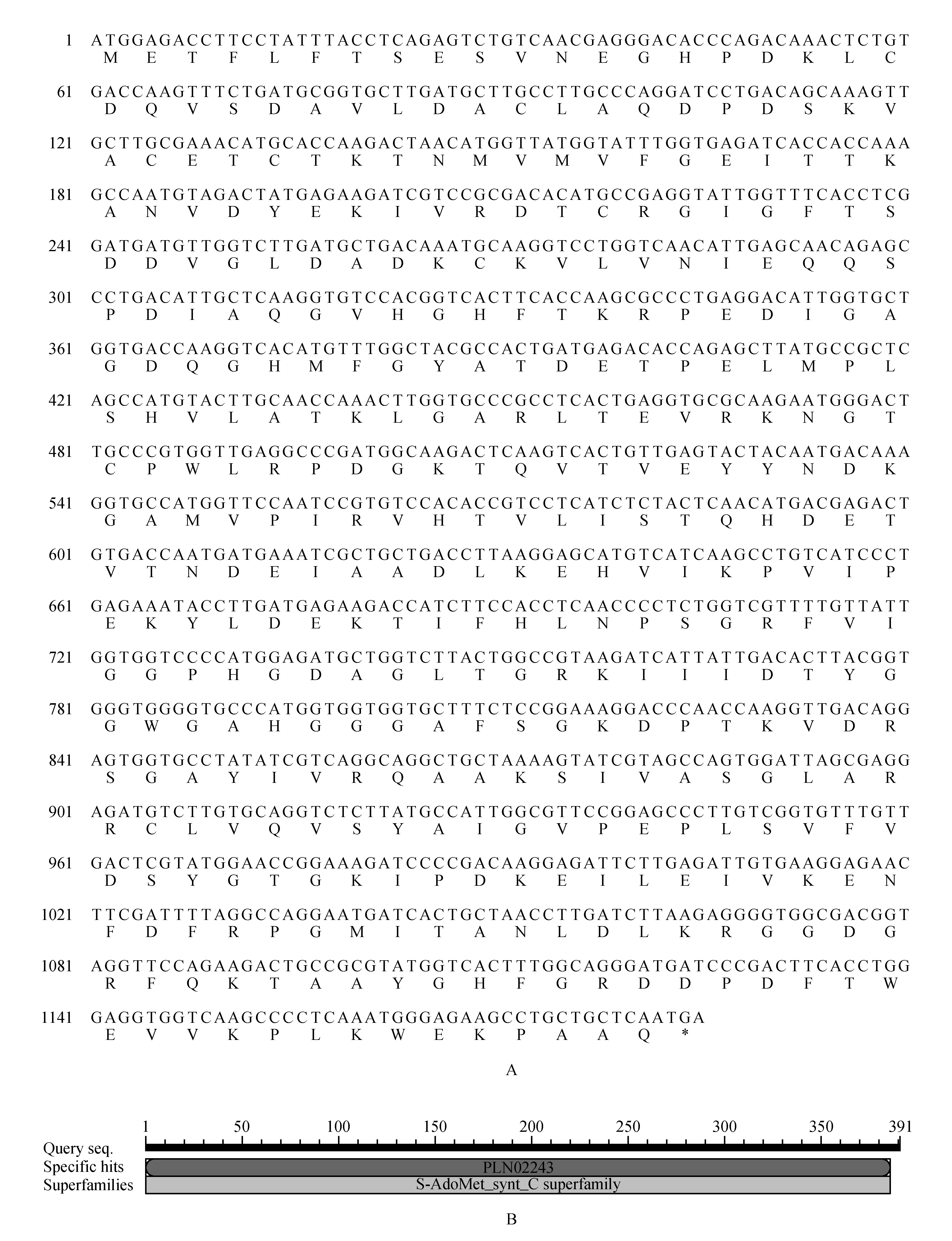
图2 刚毛柽柳ThSAMS基因序列及保守区结构 A.ThSAMS基因cDNA序列及其推测的氨基酸序列;B.ThSAMS保守区结构预测Fig.2 Nucleotide sequence and putative conserved domains of ThSAMS A.Nucleotide sequence and deduced amino acid sequence of ThSAMS; B.Putative conserved domains of ThSAMS
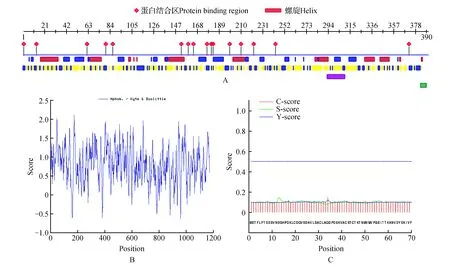
图3 ThSAMS蛋白质的生物信息学分析 A.ThSAMS二级结构预测;B.ThSAMS蛋白质的疏水结构预测;C.ThSAMS蛋白信号肽预测Fig.3 Bioinformatics analysis of ThSAMS protein A. Secondary structure prediction of ThSAMS; B. Hydrophobicity analysis of ThSAMS; C. Signal P-NN prediction for ThSAMS protein
2.2.4ThSAMS基因编码氨基酸序列的同源性分析及系统发育树构建
利用NCBI的Smart BLAST数据库进行序列同源性分析比较,发现ThSAMS蛋白与其他植物的SAMS蛋白氨基酸序列具有较高的一致性,利用Bioedit对ThSAMS蛋白与已知10种不同植物(NtSAMS烟草;HbSAMS橡胶树;DzSAMS榴莲;CcSAMS黄麻;TcSAMS可可;CaSAMS辣椒;GhSAMS陆地棉;McSAMS苦瓜;GbSAMS海岛棉;ZjSAMS枣)SAMS基因编码的蛋白进行同源性序列比较(图4)。结果表明,与其他物种的SAMS一样,ThSAMS蛋白具有S-AdoMet_synt_C家族典型的结构域。其可能在刚毛柽柳SAM的生物合成过程中扮演着重要的角色,是细胞内影响生命活动的关键。ThSAMS基因编码的氨基酸序列与烟草、海岛棉的SAMS氨基酸序列相似度高达92%,与榴莲、黄麻、可可、辣椒、陆地棉、苦瓜的SAMS氨基酸序列相似度高达93%,与橡胶树的SAMS氨基酸序列相似度高达94%,其中与枣的的SAMS氨基酸序列最相似度高达95%,说明该基因在植物进化中非常保守。
为更好地研究进化关系,利用MEGA6.0软件构建几种植物SAMS基因编码蛋白同源序列的系统进化树(图5)。结果显示刚毛柽柳SAMS与枣SAMS亲缘关系最近,二者间可能有相似的功能。
2.3 ThSAMS基因的表达分析
为了进一步研究ThSAMS基因表达的组织特异性及其对逆境胁迫的响应情况,采用实时RT-PCR方法分析其正常生长和胁迫处理下的表达模式。正常生长情况下,ThSAMS在柽柳的地上和地下部分都表达,但是其在地上部分的表达量是地下部分组织中2.36倍(图6)。在0.4 mol·L-1NaCl和20% PEG和外源ABA处理下,ThSAMS的表达都发生了变化,但在不同处理条件和不同组织中的表达模式有所差异(图7)。
在NaCl胁迫下,ThSAMS基因在柽柳中受到了不同程度的表达,其中ThSAMS基因在柽柳地上部分表达上调,表达量逐渐上升,在12 h时表达量达到峰值,约为对照表达量的14.4倍;ThSAMS基因在柽柳根部组织表达下调,表达量在2 h达到顶峰后逐渐下降,在48 h时表达量达到最低,下调了0.07倍;与地下部分相比,ThSAMS表达在地上部分中诱导程度更高。
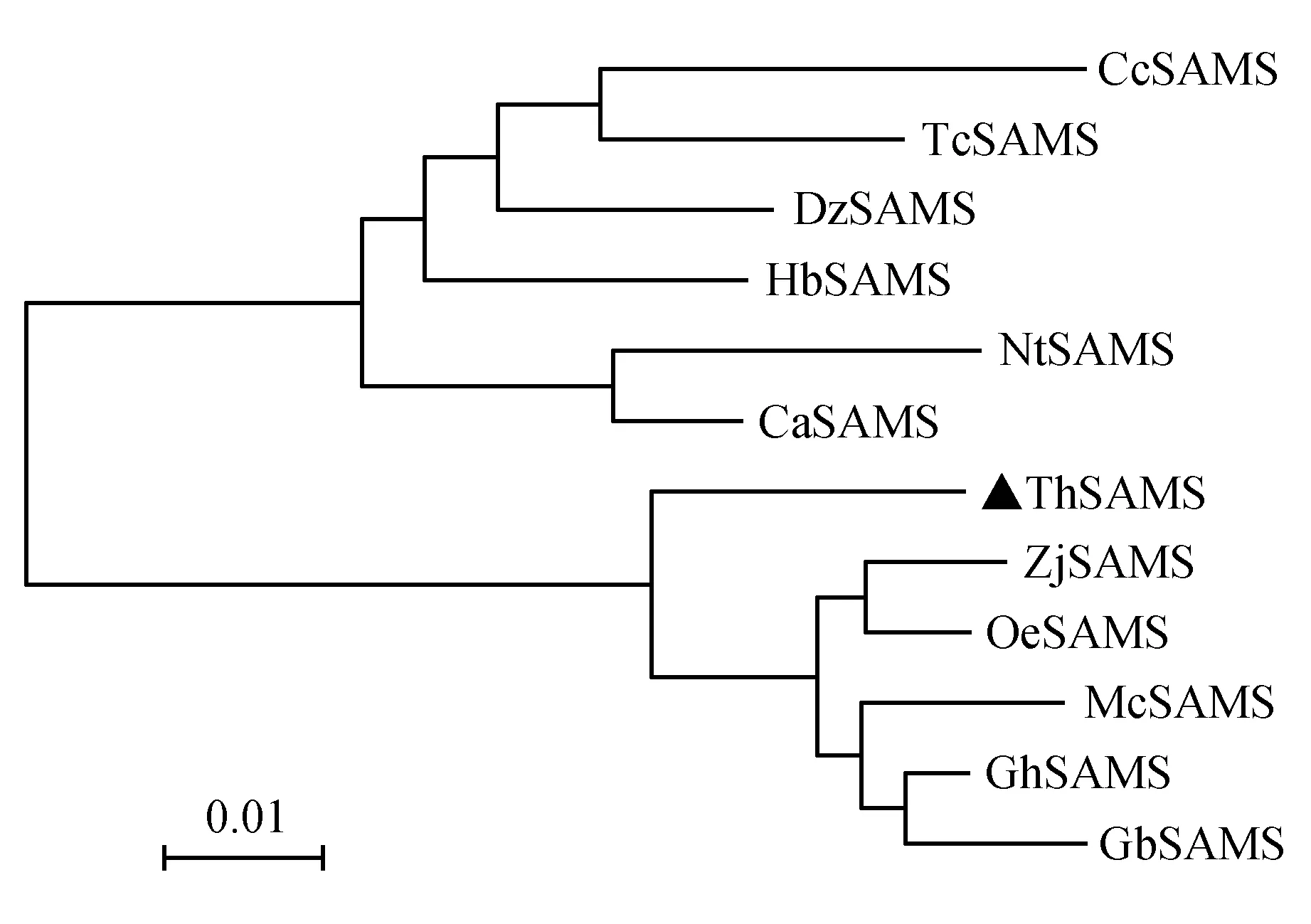
图5 几种植物SAMS蛋白同源序列的系统进化树分析 标尺代表每单位氨基酸的变化,0.01代表两个序列之间1%的差异。Fig.5 Phylogenetic tree analysis of SAMS proteins from various plant species The scale bar expected number of substitutions per site,0.01means 1% changes were observed between two sequences.
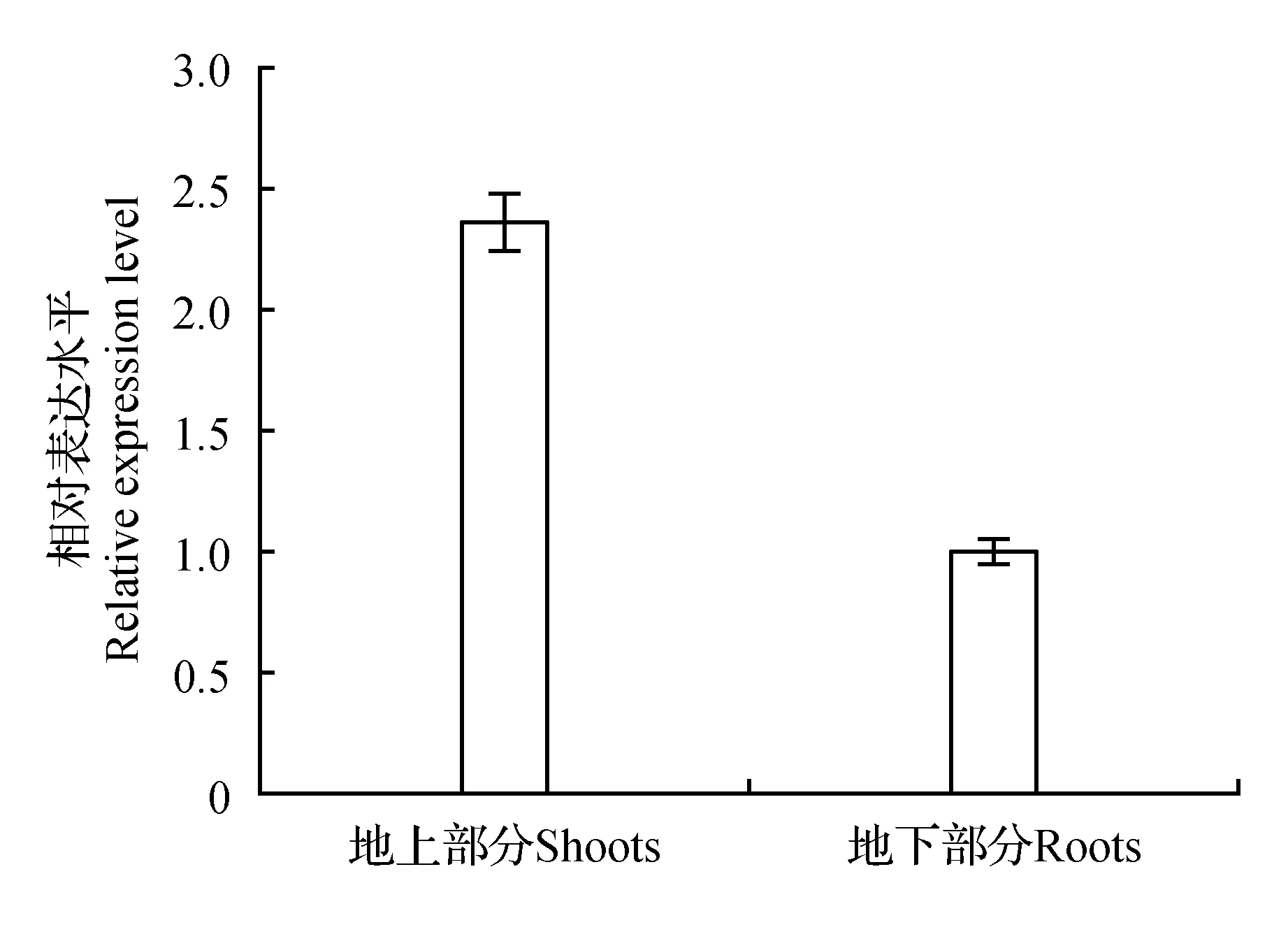
图6 ThSAMS基因在刚毛柽柳组织器官中的表达分析Fig.6 Expression analysis of ThSAMS gene in T.hispida under different tissues
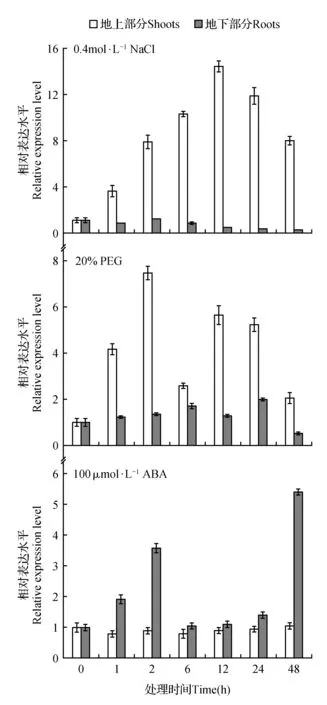
图7 ThSAMS基因在不同胁迫下的表达模式分析 基因相对表达量=2^-ΔΔCt,>1代表上调表达;=1代表表达无变化;<1代表下调表达。Fig.7 Expression analysis of ThSAMS gene under different abiotic stresses Relative expression level was 2^-ΔΔCt;>1 upregulation;=1,no change in regulation;<1,downregulation
在模拟干旱PEG胁迫下,ThSAMS基因在柽柳中呈现表达上调且呈现双峰型特征。地上部分分别在2和12 h其相对表达量达到峰值。ThSAMS基因在地下根部组织中与地上部分的表达具有相似性,在胁迫6h时达到峰值后逐渐降低,在24 h时再次达到峰值后逐渐下降。与地上部分相比,ThSAMS基因的表达在地下根部组织中随着胁迫时间的增加变化比较平缓。
在外源ABA处理下,ThSAMS基因在柽柳不同组织中呈现截然不同的表达模式。在地上部分组织中,ThSAMS基因的表达没有发生明显变化;而在地下部分组织中,ThSAMS基因受ABA诱导上调表达,处理48 h时表达量是对照的5.38倍。
上述实验结果表明,ThSAMS基因在NaCl和PEG胁迫处理后刚毛柽柳地上和地下组织的表达均能产生不同程度的改变,推测该基因可能参与柽柳抗旱耐盐生理过程。但是,在外源ABA处理下ThSAMS基因在柽柳地上和地下组织中呈现不同的表达模式,表明其在不同组织中可能受不同的信号转导途径所调控。
3 讨论
S-腺苷甲硫氨酸(SAM)是生物体中一种重要的生理活性物质,参与了多胺、乙烯和谷胱甘肽等物质的合成和代谢过程,而这些物质在植物抵御逆境胁迫过程中发挥着重要作用[22~23]。S-腺苷甲硫氨酸合成酶(SAMS)作为SAM合成的催化酶,也直接参与调节植物对多种逆境胁迫的应答反应[14,24~25]。本研究首次从刚毛柽柳中克隆到一个编码S-腺苷甲硫氨酸合成酶的基因ThSAMS的全长序列,序列分析表明,ThSAMS与其他物种的SAMS氨基酸序列具有很高的相似性,并且也包含了三个保守结构域:N端的蛋氨酸结合基序(GHPDK)、中间结构域(GAGDQGHMFGY)和C端ATP结合基序结构域(GGGAFSGKD),表明该基因属SAMS成员。
目前,多种植物中的SAMS基因已被克隆鉴定,研究发现SAMS基因表达受多种逆境胁迫诱导。盐地碱蓬、烟草和陆地棉的SAMS受盐胁迫诱导表达[26~28]。Ding等克隆了离子芥中SAMS基因,该基因表达受低温、乙烯和盐胁迫诱导[24];黄瓜CsSAMs受NaCl、PEG、高温和低温等胁迫诱导表达[29];黑穗病菌胁迫和低温(4℃)、PEG、NaCl等非生物胁迫均能诱导甘蔗ScSAM的表达[30]。这些研究暗示SAMS基因可能在植物的生物和非生物胁迫响应中发挥重要作用。Gong等[28]将SAMS1基因转入番茄中,转基因植株体内的亚精胺(Spd)和精胺(Spm)的含量显著提高,抗盐碱胁迫的能力显著增强[27];石蒜SAMS基因能够提高植物多胺和乙烯的含量,加速了细胞壁木质化,增强转基因植株的耐盐能力[31]。紫花苜蓿MfSAMS1在叶片中的表达受到了冷、脱落酸(ABA)、H2O2和一氧化氮(NO)诱导,过表达MfSAMS1促进了多胺的合成,改善细胞的抗氧化能力,进而提高转基因植物对冷和低温胁迫的耐受性[32]。盐、甘露醇、乙烯、IAA和ABA处理增强了马铃薯SbSAMS的表达水平,SbSAMS过表达拟南芥的乙烯积累增加,转基因植株表现出较高的耐盐性和抗旱性[33]。须芒草AvSAMS1在拟南芥中过量表达,通过使组蛋白H3(H3K4me3和H3K9me3)甲基化,提高了转基因拟南芥对Al、Pb、Cu和Zn等胁迫的抗性[34]。以上研究表明,SAMS能够调控植物体内多胺、乙烯、木质素等物质的合成和积累,来改变植物抵御逆境胁迫的能力。同时,SAMS通过参与DNA甲基化和组蛋白甲基化修饰也影响着植物的抗逆性。但这些SAMS参与的抗逆代谢通路之间是否存在偶联目前尚不清楚。SAMS的抗逆功能在植物基因工程育种工作中存在潜在的应用前景,因此,SAMS具有较高的研究价值。为了深入了解SAMS基因在柽柳非生物胁迫应答中的功能,本研究利用荧光定量PCR技术分析了ThSAMS在NaCl、PEG和ABA处理下的表达情况。在地上部分组织中,ThSAMS基因的表达受NaCl和PEG的诱导,胁迫后基因表达量显著上升,这与上述其它植物SAMS基因表达分析的研究结果一致。但是,在柽柳地下部分组织中,ThSAMS基因表达变化并不明显,表明在胁迫条件下其表达具有一定的组织特异性。与NaCl和PEG胁迫下的结果不同,在外源ABA处理后,ThSAMS基因在柽柳地下部分组织中表达上调,而在地上部分组织中没有变化。综合上述结果,我们推测ThSAMS可能参与刚毛柽柳对高盐和干旱的胁迫应答反应,其主要在柽柳的茎、叶组织中行使功能,且并不依赖ABA信号通路。本研究为进一步揭示ThSAMS基因在柽柳高盐、干旱胁迫应答中的具体功能及作用机制奠定基础。
