京大戟的化学成分和药理作用研究概述△
2019-02-14刘淑岚翁连进韩媛媛杨欣闵知大耿頔
刘淑岚,翁连进,韩媛媛,杨欣,闵知大,耿頔,*
1.华侨大学化工学院,福建 厦门 361021;2.中国药科大学中药学院,江苏 南京 210009
大戟科植物是双子叶植物中一个大科,包含300余个属8000余种,国内的大戟科植物有66个属360多种,主要生长于长江以南地区[1]。《新华本草纲要》收载的可作药用的大戟科植物有36个属134种,大部分产于华西地区及华南沿海[2]。京大戟为植物大戟EuphorbiapekinensisRupr.的干燥根,系大戟科(Euphorbiaceae)大戟属Euphorbia多年生草本植物,收录于历版的《中华人民共和国药典》,作为我国传统中药,具有逐饮通便、通经泻水、消肿散结的效用,现代中医临床常在方剂中用作君药,治疗痰饮积聚、水肿胀满等症[1]。
大戟全草含乳汁,植物上部枝叶互生,叶片呈现椭圆披针形,表面有白色短绒毛,长约3~8 cm,宽约6~13 mm,全缘,花期于4—5月,果期于6—7月[3]。京大戟呈长形圆锥体,长约15 cm,直径约4 cm。表面具有皮孔状横向突起、纵纹及支根痕。质地坚硬,表面呈现灰棕色且粗糙,断面为黄色或白色,性寒,味微苦[4]。
本文将对从自京大戟初次系统研究以来至今,已发现的化学成分亚型及骨架和二萜的波谱学特征进行总结概括,并对其药理作用和生物活性进行综述。相对于同类文献,对结构亚型进行进一步划分,并针对结构复杂的二萜类化合物进行波谱规律的总结,为研究者快速判断京大戟中二萜化合物类别提供依据。
1 化学成分
大戟属化学成分的研究开始于十九世纪末。在1996年,孔令义和闵知大[5]首次系统研究作为药用的京大戟的化学成分,分离得到9个化合物。随着研究深入,目前共发现87个化合物,主要有萜、鞣质、有机酸、黄酮等类成分。
1.1 萜类化合物
萜类包括单萜、倍半萜、二萜、三萜等。京大戟的萜类化合物占目前已分离得到全部化合物总数的60%以上。
1.1.1 二萜化合物及其波谱学特征 二萜类化合物是含有20个碳原子,由4个异戊二烯单位构成的化合物类群[6]。它们生源上都是由焦磷酸香叶基香叶酯(GGPP)衍生而来,大部分都含有环状结构[7]。迄今为止,在京大戟中发现的二萜化合物主要包括卡司烷(casbane)型、千金二萜烷(lathyrane)型、海松烷(pimarane)型、松香烷(abietane)型、西松烷(cembrane)型、对映-阿替生烷(ent-atisane)型、对映-贝壳松烷(ent-kaurane)型共7种亚型,32个化合物。京大戟中二萜化合物骨架见图1,化合物结构见表1。

图1 京大戟中二萜化合物的基本骨架

表1 京大戟中的二萜化合物

续表1
注:“—”表示无取代基。
目前在京大戟中发现的所有卡司烷型二萜中,Kong等[8]发现的Euphpekinensin是唯一一个3,4-cis,7,8-trans,11,12-trans类型的卡司烷型二萜,其余的卡司烷型二萜均为3,4-trans,7,8-trans,11,12-trans类型。京大戟中主要的二萜化合物波谱特征见表2。
1H-NMR谱和13C-NMR谱作为主要识别二萜化合物类型的工具,还需要有CD谱、NOE实验以及X-射线衍射实验的辅助才能进一步得到精确的化合物构型和构象方面的信息。展开京大戟中二萜化合物的深入研究,对于深入理解化合物在生物体内合成分解的生源关系,对已发现化合物的来源理解和波谱数据修正,以及活性化合物合成等后续研究也具有指导性意义。
1.1.2 单萜和倍半萜化合物 目前在京大戟中分离鉴定得到的单萜或倍半萜化合物鲜有报道,李文海[3]首先分离得到一个单萜化合物[4α-hydroxy-2-methyl-5α-(1-methylethyl)-2-cyclohexen-1-one,33]和一个倍半萜化合物[(R)-dehydtovomifoliol,34]。李雪飞等[26]对京大戟的挥发油成分运用气象色谱-质谱联用技术进行研究,两个倍半萜化合物为其主要成分,分别为沉香螺旋醇(agarospirol,35)和四甲基环癸二烯异丙醇(hedycaryol,36)。
1.1.3 三萜化合物 根据目前对京大戟的文献报道,已经发现的三萜化合物有二十种。其中甘遂甾醇(tirucallol,37)、β-谷甾醇(β-sitosterol,38)和大戟醇(euphol,39)这3种三萜化合物被多次分离得到[3-4,14,16,27-28],且其中的37和39互为同分异构体。孔令义等[5]首次在京大戟中分离得到的三萜化合物为羊毛甾醇(lanosterol,40)和β-谷甾醇(β-sitosterol,38)。

表2 京大戟中二萜化合物的波谱特征
甘遂甾醇(tirucallol,37)和大戟醇(euphol,39)首次由梁侨丽等[15]从京大戟的乙醇提取物中分离得到。相关研究[27-28]除了分离得到甘遂甾醇(37)和大戟醇(39)以外,还分别分离得到了钝叶甾醇(obtusifoliol,41)和24-亚甲基-环阿尔廷醇(24-methene-cycbartenol,42)。李文海[3]分离得到了除大戟醇之外的8个三萜化合物,分别是:大戟烷型三萜化合物25-methoxy-eupha-8,23-diene-3β-ol(43)和27-hydroxy-3-oxolup-12-ene(44)、羊毛脂甾烷型三萜化合物3β,25-dihydroxylanosta-8,23-diene(45)、羽扇豆烷型三萜化合物28-hydrozylup-20(29)-en-3one(46)、对环阿屯烷型三萜化合物(20R,23E)-25-methoxy-cycloart-23-en-3β-ol(47)、两种环阿屯烷型三萜化合物(24R)-9,19-cycloart-25-ene3β,24-diol(48)、(24S)-9,19-cycloart-25-ene3β,24-diol(49)、豆甾-4-烯-6β-醇-3-酮(50)。此外,还分离得到了β-胡萝卜苷(β-daucosterol)[4](51)、豆甾醇(stigmasterol)[29](52)、地榆皂苷I(ziyu glycoside I)(53)、3β-α-L-阿拉伯糖基-12,19(29)-二烯乌苏酸-28-β-D-葡萄糖酯[3β-α-L-arabinopyranosyloxyurs-12,19(29)-dien-28-oic acid 28-β-D-glucopyranosyl ester][30](54)、neomotiol[14](55)、环阿尔廷醇(cycloartenol)[20](56)。
1.2 鞣质类和酚酸类化合物
鞣质类和酚酸类化合物在京大戟中较为少见。孔令义等[5]首次分离到3种酸性成分,为2,2′-二甲氧基-3,3′二羟基-5,5′-氧-6,6′-联苯二甲酸酐(2,2′-dimethoxy-3,3′-dihydroxy-5,5′-oxygen-6,6′-biphenylformic anhydride,57)、3,4-二甲氧基苯甲酸(3,4-dimethoxybenzoic acid,58)和3,4-二羟基苯甲酸(3,4-dihydroxybenzoic acid,59)。京大戟中的酸性类成分还有正三十烷酸(triacontanoic acid)[15](60)、对羟基苯甲酸(p-hydroxybenzoic acid)[3](61)、正十四烷酸(myristic acid)[14](62)、丹酚酸B(Salvianolic acid B)[30](63)。京大戟中的鞣质类化合物有:3,3′-二甲氧基鞣花酸(3,3′-di-O-methylellagic acid)[4](64)、鞣花酸(ellagic acid)(65)、没食子酸(gallic acid)[20](66)、没食子酸甲酯(methyl gallate)[20](67)、3,3′-二甲氧基鞣花酸-4′-O-β-D-吡喃木糖苷(3,3′-di-O-methylellagic acid-4′-O-β-D-xylopyranoside,68)[4]、3,3′-二甲氧基鞣花酸-4′-O-β-D-吡喃葡萄糖苷(3,3′-di-O-methylellagic acid-4′-O-β-D-glucopyranoside,69)[4]。
1.3 黄酮类化合物
孔令义等[5]首次从京大戟中提取得到了槲皮素(quercetin,70)这一化合物。Ahn等[31]从中分离得到了4个黄酮类物质,分别为槲皮素-3-O-(2″-O没食子酰)-α-L-鼠李糖苷[quercetin-3-O-(2″-O-galloyl)-α-L-rhamnopyranoside,71]、山柰酚-3-O-β-D-葡萄糖苷(kaempferol-3-O-β-D-glucopyranoside,72)、槲皮素-3-O-β-D-葡萄糖苷(quercetin-3-O-β-D-glucopyranoside,73)、槲皮素-3-O-芦丁糖苷(quercetin-3-O-rutinoside,74)。
1.4 其他化合物
除上述化合物之外,孔令义等[5]还分离到了一种新化合物3-甲氧基-4-羟基反式苯丙烯酸正十八醇酯(octadecany l-3-methoxy-4-hydroxy benzeneacry late,75),以及7-羟基香豆素(7-hy droxycoumarin,76),并首次从京大戟中分离到了一种木脂素类化合物d-松脂素(d-pinoresinol,77)。此外,京大戟中的其他化合物还包括:正十八烷醇(octadecanol,78)、3-甲氧基-4-羟基反式苯丙烯酸正十八醇酯(octadecanyl-3-methoxy-4-hydrox-ybenzeneacrylate)[15](79)、阿魏酸二十八酯(octacosyl ferulate)[4](80)、邻苯二甲酸二丁酯(dibutyl phthalate)[28](81)、正三十烷醇(triacontanol)[29](82)、二十四烷醇(tetracosanol)[14](83)、Senarguine B[30](84)。京大戟挥发油中还包含少量以下3种化合物[26]:β-羟基-5α-甾醇(2-methyl-ene-5α-cholestan-3β-ol,85)、3-乙基-3 羟基-5α-雄甾烷-17酮(3-ethyl-3-hydroxy-5α-androstan-17-one,86)、(3β,5α)-2-亚甲基-3-羟基胆甾烷[(3β,5α)-2-methylene-cholestan-3-ol,87]。
2 药理作用
大戟属植物具有双重活性,在具有抗病毒、抗肿瘤、抗真菌细菌、抗白血病、神经生长因子促进等药理作用的同时又表现出对细胞的毒性,对皮肤黏膜的刺激性,服用后易出现对消化系统的毒副作用以及致炎、触发肿瘤等[32-34]。“十八反”指出:“藻戟遂芫俱战草”,“戟”即指京大戟,禁与甘草配伍用药[35],合用后对大鼠产生了心肝肾等各个器官的毒性[36]。李国锋等[37]发现二药合用作用于肠粘膜后,抑制了P-gp蛋白的表达,表明京大戟与甘草合用后毒性增强,也为其用药禁忌增加了理论依据。
现代药理学表明,京大戟及其主要成分二萜化合物表现出对人癌细胞的毒性作用。此外,据文献报道,京大戟不同的注射液、生品、炮制品、提取物、混合提取物等也有抗白血病、泻下、抗炎等药效。与此同时,与药用京大戟类似,其提取物与主成分二萜化合物所具有的毒性在生物层面和细胞层面都有所体现。
2.1 抗癌作用
京大戟中主要的活性成分二萜类化合物,尤其在抗癌作用方面效果显著[7]。前文所述的多种类型二萜成分,例如Kong等[8]从石油醚和三氯甲烷萃取部位分到的4个二萜化合物均对人鼻咽癌细胞KB具有毒性作用,其中京大戟素(1)的抗癌细胞活性非常显著(IC50=0.06 μg·mL-1)。Liang等[12]从京大戟三氯甲烷萃取部位中分离得到的pelinenal(5);高羽[16]从石油醚萃取部位分离到的异大戟素(6);Shao等[18]从京大戟石油醚萃取部位中分离出的pekinenin A(14);陈海鹰等[14]从京大戟石油醚萃取部位首次分离到的二萜化合物(3β,12α,13α)-3,12-dihydroxypimara-7,15-dien-2-one(23);Hou等[23]从石油醚萃取部位分离到的新二萜化合物(-)-(1S)-15-hydroxy-18-carboxycembrene(24);Tao等[13]从石油醚萃取部位分出的4个新颖的卡司烷型二萜化合物pekinenins C(16)、D(17)、E(18)、F(19);Tian等[21]从京大戟石油醚萃取部位分离到的8个二萜化
合物,(5β,9β,10α,12α)-2,12-dihydroxypimara-1,7,15-trien-3-one(27)、(5β,9β,10α)-2-hydroxypimara-1,7,15-trien-3-one(28)、(3β,11α,13α)-3,11-dihydroxypimara-7,15-diene-2,12-dione(29)、17-nor-7α-hydroxy-15-oxoabieta-8,11,13-triene(30)以及(3β,13α)-3-dihydroxypimara-7,15-diene-2,12-dione(31)和(12α,13α)-12-hydroxypimara-7,15-dien-3-one(32)、月腺大戟素C(21)、helioscopinolide E(22),这些化合物都对某一种或多种人体癌细胞表现出一定程度上的细胞毒性,其中抗细胞种类和半数抑制浓度(IC50)值见表3~4。

表3 京大戟化合物抗癌细胞的半数抑制浓度值 μg·mL-1
注:“—”表示空值。
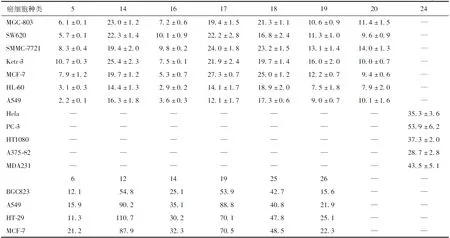
表4 京大戟化合物抗癌细胞的半数抑制浓度值 μM
注:“—”表示空值。
除二萜以外,孔艺等[30]从京大戟石油醚萃取部位分离到的Senarguine B(84),对人早幼粒白血病细胞HL-60具有细胞毒性,其IC50值为35.67 μg·mL-1,从京大戟乙酸乙酯萃取部位分离到的丹酚酸B(63)在体外和体内实验中均可以抑制人头颈部鳞癌细胞AGZY-973的生长和增殖。陈飞燕等[38]通过3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐比色法(MTT)发现,从京大戟石油醚萃取部位分离得到的pekinenal(5)可使人肝癌细胞株SMMC-7721被阻滞于S期,从而导致细胞凋亡,对其增殖有明显的抑制作用。Zhang等[39]使用醋制京大戟的水提物,通过体外和体内实验,证明京大戟具有抗血管生成特性,其中mRNA表达实验显示,醋制京大戟的水提物可以抑制大部分血管肿瘤相关基因的表达。Fan等[40]研究表明,来自京大戟石油醚萃取部位的卡司烷型二萜类化合物pekinenin E(18)在体外和体内都具有显著地抗人肝癌细胞HCC的活性。18可以抑制两种人肝癌细胞Hep G2和SMMC-7721的生长;同时,18介导的内质网(ER)应激引起C/EBP同源蛋白(CHOP)表达增加,导致体外和体内人肝癌细胞凋亡;此外,18还可以诱导S细胞周期停滞。这些研究结果都表明,18导致ER应激相关细胞死亡和细胞周期停滞,并且它可以作为治疗人类肝癌细胞的有效药物[40]。
据文献报道,大戟注射液所具有的抗白血病细胞株的药效是通过抑制癌细胞DNA合成的作用机制实现的。文成英等[41]用大戟注射液对白血病细胞株KY821和正常人骨髓干细胞进行了体外药物实验,结果表明,中药大戟注射液和西药高三尖杉酯碱都可以有效抑制癌细胞的生长(P<0.01),但是,西药组相较中药组对正常细胞集落(GM-CFU)的抑制作用显著(P<0.005),说明作为抗癌药物的大戟注射液对于正常人体细胞的毒性较低。文成英等[42]还检测了大戟注射液作用后的白血病细胞株KY821的DNA含量,其含量和细胞周期分布的结果表明,大戟注射液的抗癌作用通过抑制癌细胞DNA合成来实现。尚溪瀛等[43]进一步对大戟注射液设计了体内药物实验,大戟注射液给药组的L615白血病小鼠的存活时间延长,且通过观察小鼠细胞周期分布得出结论,大戟注射液是通过抑制癌细胞的DNA合成使其被阻断在S期。然而对于大戟注射液体外体内药物实验的研究虽然表明中药可以有效抗癌并具有较低的毒副作用,但其药效在一定程度上不如西药,这就有待研究者对京大戟的有效成分和作用机制进行深入研究,从各方面提高中药对于肿瘤细胞的抑制效果。
2.2 泻下作用
据文献报道,京大戟具有的泻下作用,可能的作用机制是通过增加肠管细胞中水通道蛋白的mRNA表达含量来实现的[25]。最终表现为促进肠道蠕动,促进肠内容物向下推进,增加对其水分吸收,减少其停留时间,最终达到泄水逐饮的作用[32]。
张乐林等[44-45]进行小鼠的碳末肠推进实验、利尿实验,采用京大戟和醋京大戟各萃取部位提取物溶液对其灌胃处理,结果显示,生品和醋品乙酸乙酯部位的泻下作用和利尿作用十分显著(P<0.01),醋制后药性有所降低。邱韵萦等[46]用小鼠构建肠推进运动模型,对其进行京大戟70%乙醇水提取物溶液灌胃处理,与正常小鼠相比,给药鼠的肠推率显著增加;醋品与生品组相比,具有显著性差异,表明醋制后的京大戟药效降低。Wang等[25]用京大戟经三氯甲烷提取后分离得到京大戟的总二萜化合物(TDEP),小鼠口服TDEP后结肠中的水通道蛋白AQP3、AQP4的水平显著增加。组织病理学实验显示,结肠细胞并没有明显损伤。同时,从京大戟石油醚萃取部位分离到的卡司烷型二萜Pekinenin C(16)可以显著增加人肠上皮细胞(HT-29 cells)的水通道蛋白AQP3和mRNA表达量。实验结果表明,京大戟的的泻下作用可能与其含有的二萜化合物有关,它们可能引起结肠中的水通道蛋白AQP含量变化。
2.3 抗炎作用
据文献报道,京大戟的抗炎作用机制可能与其对组织血管壁细胞膜的通透性的抑制作用有关,管壁细胞膜通透性降低会导致白细胞总数增加的同时减少渗出液,从而达到抗炎功能[47]。
由角叉菜胶诱导的大鼠和小鼠足水肿可以通过京大戟石油醚提取液(PEE)得到明显改善,并且对佐剂或者甲醛所导致的关节炎具有显著的抗炎活性[47]。孔艺等[30]从乙酸乙酯和正丁醇萃取部位分离到的化合物地榆皂苷I(53),在二甲苯致小鼠耳肿胀实验中表现出抗炎活性。Yasukawa等[48]从甘遂大戟(Euphorbiakansui)中分离得到的三萜化合物大戟醇(39)和Fernandez-Arche等[49]从大戟属植物Euphorbialacteal中分离得到的三萜化合物甘遂甾醇(37),通过体内实验表明,两种化合物可以显著地抑制由TPA诱导的小鼠耳朵的水肿。张乐林等[45]用京大戟和醋京大戟各萃取部位样品溶液对小鼠灌胃进行小鼠耳肿胀实验,实验结果表明,京大戟的乙酸乙酯部位发挥主要药效,且醋制京大戟抗炎作用的提高非常显著(P<0.05)。
2.4 毒性作用
据文献报道,京大戟毒性作用机制可能与其能改变胞内线粒体膜通透性有关,通透性的改变可以导致细胞周期停滞以及细胞凋亡[50-51]。推测所含的二萜类化合物为其毒性作用的主要药效成分[44]。
京大戟表现出一定的刺激性,皮肤接触后可能引起充血、脱皮;对胃肠的刺激表现为引起腹痛腹泻,甚至便血。过量服用京大戟会影响中枢神经系统,出现昏迷、痉挛、虚脱等症,严重会导致死亡[44]。此外,京大戟提取液也对小鼠、大鼠或各类人体细胞有不同程度的毒性作用。张宏利等[52]用京大戟粉末样品对小鼠进行实验,饲料混毒喂食后的死亡小鼠中,取食样品最小的相当于小鼠体重的75.63 g·kg-1;用京大戟50%乙醇水提取物对实验小鼠灌胃后测得半数致死量(LD50)为19.5 g·kg-1。张乐林等[45]用京大戟和醋京大戟各萃取部位样品溶液对小鼠进行急性毒性实验,生品和醋品的乙酸乙酯萃取部位的LD50分别为160.3、234.8 g·kg-1,结果表明,京大戟醋制减毒效果显著。Hou等[53]对京大戟的乙醇提取物和水提物进行实验,结果显示,醇提物作用的细胞部分损伤甚至坏死,而水提物的细胞表现基本正常,可以得出结论,京大戟引起的肝毒性和肾毒性主要由其乙醇提取物导致,并运用主成分分析法通过超高效液相色谱-串联质谱(UPLC/MS/MS)鉴定出了8个潜在的生物标志物。曹雨诞等[50]通过增殖抑制实验,发现生品大戟对大鼠小肠隐窝上皮细胞IEC-6具有较强毒性(P<0.01),醋品大戟可显著改善对肠细胞的增殖抑制作用。可能的作用机制是通过缓解其改变肠细胞线粒体膜通透性,阻止细胞凋亡。Zhang等[54]通过UFLC-MS/MS方法研究了灌胃给予大鼠京大戟乙醇提取物后,其血浆中肾毒性二萜的毒代动力学行为。大鼠以9 g·kg-1的剂量口服京大戟提取物后,二萜在大鼠血浆浓度迅速达到最大后缓慢降低,表明二萜的毒性可能快速发生,可能在组织和器官中积累。Cao等[51]研究了从京大戟分离得到的卡司烷型二萜Pekinenin C(16)在大鼠小肠隐窝上皮细胞IEC-6中的凋亡机制,16通过线粒体和死亡受体途径有效促进肠细胞凋亡,同时16细胞还可导致细胞周期停滞,两者结合发挥对肠细胞毒性作用。邵霞等[55]用京大戟和醋京大戟各萃取部位样品溶液,处理人胃粘膜上皮细胞GES-1和大鼠小肠隐窝上皮细胞IEC-6,细胞活性降低,细胞分裂、增殖被抑制,京大戟石油醚、乙酸乙酯萃取部位对胃肠细胞具有较强的毒性作用(P<0.01、P<0.05),醋制后增殖抑制作用显著降低(P<0.05、P<0.05)。
2.5 其他作用
Kan等[56]研究发现,KIOM-79(京大戟、葛根、厚朴、甘草得到的植物混合提取液)通过Akt-Nrf2-ARE信号通路诱导血红素加氧酶-1(heme oxygenase-1,HO-1)的蛋白表达水平,从而保护胰岛β-细胞抵抗链脲霉素诱导的氧化应激损伤。
3 总结与展望
京大戟中化学成分多样,有萜类、鞣质和酚酸类物质、黄酮类等。其中的主要活性成分为二萜类化合物,其一直以来备受学者们关注。目前已报道过的来自于京大戟的所有化合物中,二萜类化合物占比三分之一以上,而卡司烷型的二萜又占二萜化合物总数的三分之一以上。迄今为止,已发现的天然化合物中的卡司烷型二萜分布范围较小且数量很少[9],大部分都存在于大戟科[6]。卡司烷型二萜作为几类大环二萜的重要前体物,在生物合成、植物代谢产物及其途径的研究中具有十分重要的价值[6]。所以对于富含二萜化合物的京大戟,乃至大戟属植物的研究都有着颇为深远和重要的意义。
京大戟中的萜类化合物既是其活性成分,又是有毒成分,大部分提取分离于石油醚部位。根据文献报道,萜类成分是京大戟药效的物质基础,在抗人体癌细胞方面有显著疗效,具有很高的药用价值。但同时,萜类物质也可能是京大戟毒性的原因,使得京大戟具有对组织、黏膜等的刺激性,导致细胞坏死凋亡等作用。十八反中对于京大戟与甘草配伍的禁忌,是由于甘草中所含的甘草酸可以增加其他配伍药物某些成分的溶解度,一些有毒甾萜溶出量也随之增加,京大戟与甘草合用可以增强其毒性[35]。因此,学者们也在致力于开发更有效的解毒方法,使得京大戟在降低毒性的同时实现药效最大化。目前已知的方法中,醋制京大戟基本达到了减毒和缓和药性的炮制目的[45-46,50],使得其更加温和不致机体和组织损伤,同时又兼具药效。
对京大戟的研究还有待深入,这不仅对于各类有效的抗肿瘤天然药物的开发具有重大价值,而且对于高效靶向作用药物合成也一样具有指导意义。另外,对大戟属中各类植物的化学成分的生物活性进行广泛研究和药理作用的筛选,是了解植物中同类化合物的代谢机制和生源关系的重要前提,也为以后对资源丰富的大戟属植物进行充分地开发利用打下了基础。
