掺钾硅酸锂吸附强化乙醇水蒸气重整制氢
2019-02-14余 阳,郭 欣,刘 亮
余 阳,郭 欣,刘 亮
掺钾硅酸锂吸附强化乙醇水蒸气重整制氢
余 阳,郭 欣,刘 亮
(华中科技大学煤燃烧国家重点实验室,武汉 430074)
针对吸附强化乙醇水蒸气重整(SE-SRE)制氢技术,通过热力学分析和制氢实验,研究了硅酸锂加入乙醇重整的效果,并结合多种表征手段分析了掺杂K对硅酸锂的影响,进一步用实验方法探究了多种工艺条件对以掺钾硅酸锂为吸附剂的SE-SRE系统的影响及该系统的循环稳定性.结果表明,硅酸锂加入乙醇重整提高了氢气产率,适量掺钾能改善硅酸锂的结晶度和孔隙特性,提升其吸附性能.SE-SRE系统的最佳工艺条件是:温度为525℃,空速为0.9mL/(g·h),水醇体积比为8∶1,催化剂与吸附剂配比为1∶3,经过10次循环后SE-SRE系统仍能保持较高的二氧化碳吸附活性和氢气产率.
掺钾硅酸锂;乙醇水蒸气重整;吸附强化;循环稳定性
氢气作为一种清洁高效的二次能源以及重要的工业原料在新能源领域受到了广泛关注和研究.目前工业上最主要的制氢方式就是化石燃料制氢,其中又以天然气重整制氢为应用最多的方式[1].然而化石燃料制氢面临着资源储量有限的问题,因此研究者开发出了可再生原料重整制氢,如生物油[2],乙醇[3],甘油[4]等,其中乙醇是最常见也最可能实现大规模生产的生物燃料,且具有更加安全以及便于存储、运输等优点.
Hufton等[5-6]在1996年首次提出吸附强化反应过程,即通过移除反应中某一副产物来获得高纯度的目标产物,并于1999年进一步提出了吸附强化甲烷水蒸气重整,通过向反应系统中加入化学吸附剂移除反应产生的CO2,促进平衡向生成H2的方向移动,从而得到高纯度的H2,同时还能有效降低反应温度.此后研究者也探究了吸附强化乙醇水蒸气重整(SE-SRE)的可行性[7-9],SE-SRE中常见的高温CO2吸附剂有钙基吸附剂、锂基吸附剂以及类水滑石吸附剂.钙基吸附剂吸附容量大[10],但是循环过程中易烧结导致吸附性能降低,类水滑石吸附剂循环稳定性尚可,但是吸附容量较低,而锂基吸附剂中硅酸锂既有较高的吸附容量,又有良好的循环稳定性,且相比钙基吸附剂其吸附再生温度更低,因此更加适用于乙醇水蒸气重整制氢.
在本课题组前期研究中,王珂等[11]进行了对飞灰作硅源合成的硅酸锂掺杂K的实验研究,发现未掺杂K时,样品的吸收容量为64.3mg/g,而掺杂K的样品吸收容量最高可达到141.7mg/g,且经过 15次循环后掺杂K的样品相比未掺杂样品吸收量衰减更小.罗重奎[12]对纯硅酸锂掺杂K进行了实验研究,发现K2CO3的掺杂比例为0.02时,制得的掺钾硅酸锂吸附容量会提升,且吸附温度有所降低.此外,Qiao等[13]通过动力学模拟计算的方式从能量角度分析了硅酸锂加入乙醇水蒸气重整反应的效果以及多种工艺条件对反应的影响.而针对掺钾硅酸锂吸附强化乙醇水蒸气重整制氢的多种工艺条件分析及循环稳定性的实验研究,目前鲜见报道.
本文将结合热力学分析和实验方法,研究乙醇重整中加入硅酸锂的效果,并通过多种表征手段分析掺杂K对硅酸锂吸附剂的影响,然后进行不同工况下的掺钾硅酸锂吸附强化乙醇重整制氢实验,以分析温度、空速、水醇比及催化剂与吸附剂配比等条件对反应的影响,筛选出最优工况后进行循环制氢实验来探究此反应系统的循环稳定性,为吸附强化乙醇重整制氢的工业放大提供依据.
1 实验材料和方法
1.1 吸附剂制备
纯硅酸锂的制备:将分析纯Li2CO3和分析纯SiO2按照物质的量之比2.1∶1准确称量,放入研钵中,同时添加少许分析纯无水乙醇,研磨至粉末状混合均匀,放入烘箱中烘干至恒重,然后转移到坩埚中,放入马弗炉,在空气气氛中800℃下煅烧4h,煅烧完得到的样品在马弗炉中自然冷却至室温并转移到研钵中,研磨至粉末状密封保存备用.
掺钾硅酸锂的制备:将分析纯Li2CO3、分析纯SiO2和分析纯K2CO3按照物质的量之比2∶1∶0.04准确称量,后续步骤同上.
1.2 催化剂制备
35%Ni/γ-Al2O3的制备:将分析纯Al2O3先在马弗炉中500℃下煅烧4h得到γ-Al2O3,密封保存备用.称取一定质量的分析纯Ni(NO3)2·6H2O放入烧杯,加入适量去离子水搅拌溶解,再按照(Ni):(Ni/γ-Al2O3)=35%(质量比)称取γ-Al2O3加入烧杯,充分搅拌后在室温下浸渍6h,然后置于80℃水浴中搅拌蒸干,收集析出物置于烘箱中,在100℃下干燥12h,然后将烘干的样品放入马弗炉中,在 500℃下煅烧3h,煅烧完得到的样品在马弗炉中自然冷却至室温并转移到研钵中,研磨至粉末状密封保存备用.
1.3 吸附剂表征
样品的物相分析由X射线衍射仪(XRD)来测定,采用铜靶作为辐射源,扫描角度2=10°~90°.样品的比表面积和孔隙特性通过比表面积与孔径测定仪(BET)在N2气氛下吸附-脱附来测定.样品的形貌特征采用场发射扫描电镜(FSEM)来观察.
1.4 重整实验
固定床实验台架如图1所示,主要由进气单元、重整反应单元和产物检测单元3部分组成.石英反应器的内径为14mm,长度为600mm,在反应器筛板上方填装催化剂与吸附剂(或等量石英砂)的混合物,填料上下两端加石英棉使气流更均匀.
重整反应实验步骤如下:
(1)反应器升温至600℃,通入10%H2/N2(体积比)混合气,流量为100mL/min,持续1h以预还原催化剂;
(2)关闭混合气,打开载气N2,流量为20mL/min,调整至重整反应温度;
(3)打开输液泵通入水和乙醇混合液开始重整反应,同时气体分析仪开始记录数据;
(4)进行循环实验时,一次重整反应结束后,温度调节至600℃,通入10%H2/N2(体积比)混合气,完成催化剂还原和吸附剂再生后再次将温度调节至重整反应温度,进行下一次重整反应,直至循环实验结束.

图1 乙醇水蒸气重整固定床实验装置示意
2 结果与讨论
2.1 热力学分析
为研究在乙醇水蒸气重整中加入硅酸锂吸附剂对制氢效果的影响,本文采用了HSC6.0软件对乙醇水蒸气重整反应中不加硅酸锂和加硅酸锂两种情况下的平衡产物进行了热力学模拟,反应物分别设定为C2H6O和H2O体积比为1∶6,C2H6O、H2O和Li4SiO4体积比为1∶6∶6,平衡产物组分如图2所示.由图可见,不加硅酸锂时产物H2体积分数只有70%左右,而加入硅酸锂时H2体积分数明显提高,最高可达到90%以上,可见从热力学角度来看硅酸锂的加入确实能提高H2的产率.此外,从图中还可以看出,硅酸锂吸附强化乙醇水蒸气重整反应的适宜温度范围是500~600℃,这也为后续的实验条件设定提供了一定参考.
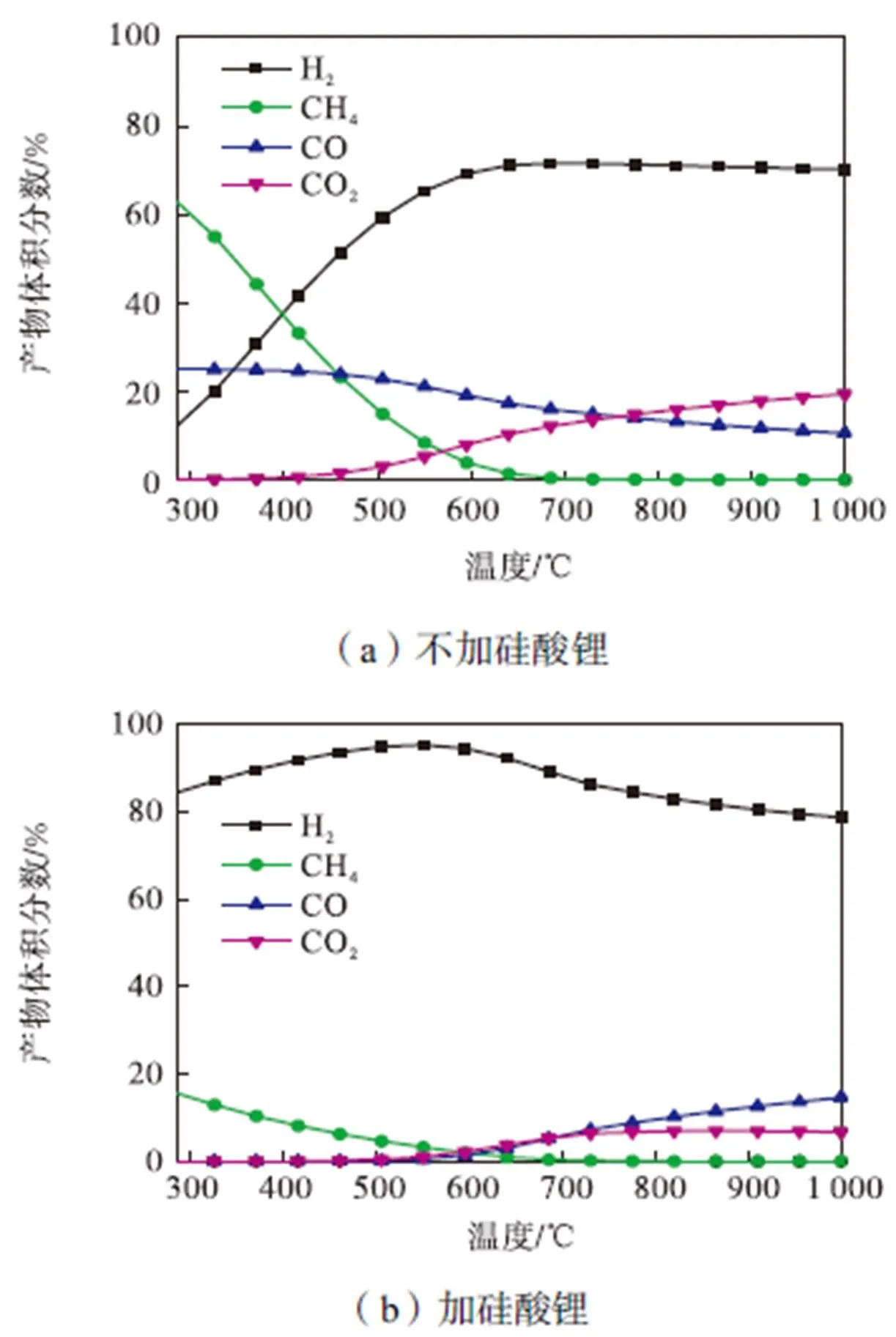
图2 乙醇水蒸气重整平衡产物组分体积分数
2.2 吸附剂表征
图3为吸附剂物相的XRD图谱.从图中可以看出,制得的两种吸附剂主要成分都是Li4SiO4,其中含有的极少量 Li2SiO3可能是由于吸附剂吸收了空气中的少量CO2生成的.对比两种样品的衍射图谱可以发现,两种吸附剂的衍射峰整体分布是较为相似的,说明两者成分很接近,其主要区别在于掺钾硅酸锂样品的衍射峰强度高于纯硅酸锂样品中对应的衍射峰,一般衍射峰强度越高代表结晶程度越高,由此说明适量掺杂K元素可以使硅酸锂吸附剂的结晶度更高.

图3 吸附剂的XRD图谱
表1为吸附剂孔隙结构的BET测试结果.从表中数据可以看出,掺钾硅酸锂相比纯硅酸锂,比表面积、孔容积和孔径都更大,因此适量掺杂K元素可以改善硅酸锂吸附剂的孔隙特性.
表1 吸附剂的孔隙结构

Tab.1 Porestructure of sorbents
图4为吸附剂形貌特征的SEM图.由图可见,纯硅酸锂表面颗粒分布较为密集,存在一定程度的烧结现象,而掺钾硅酸锂颗粒分布更均匀,表面更加疏松多孔,这也与BET测试结果相符,因此适量掺杂K元素可以使硅酸锂吸附剂表面更疏松多孔,有利于CO2吸附.

图4 吸附剂的SEM图
2.3 乙醇水蒸气重整实验
2.3.1 硅酸锂对乙醇水蒸气重整的影响
以石英砂作空白组,与纯硅酸锂进行对比来分析硅酸锂加入乙醇重整的效果,然后将纯硅酸锂与掺钾硅酸锂进行对比来分析掺杂K对硅酸锂的影响,分别取2g催化剂加6g石英砂、纯硅酸锂和掺钾硅酸锂,反应温度为575℃,空速为0.9mL/(g·h)(空速是指单位时间内单位质量的催化剂处理的液体量),水醇体积比为6∶1,3种情况下产物体积分数随时间的变化情况如图5所示.从图中可以看出,没有硅酸锂的情况下,H2体积分数稳定在75%左右,CO2体积分数大约为17%,而加入硅酸锂后,反应初始阶段由于硅酸锂吸附CO2的效果,产物中CO2体积分数明显降低至5%以下,同时也促进反应平衡向生成H2的方向移动,使得H2体积分数大幅提升至90%以上,与热力学模拟结果相符.对比两种硅酸锂吸附剂的结果可发现,掺钾硅酸锂吸附CO2的能力更强,得到的H2浓度也更高,因此后续的SE-SRE工艺条件分析及循环稳定性测试选用吸附性能更强的掺钾硅酸锂作吸附剂.

图5 3种工况下产物体积分数随时间的变化情况
2.3.2 温度对SE-SRE的影响
温度是乙醇重整反应的关键条件,根据热力学模拟结果选取475℃、525℃、575℃和625℃共4个重整反应温度对比以分析其影响,空速为0.9mL/ (g·h),水醇体积比为6∶1,取2g催化剂和6g掺钾硅酸锂,所得产物体积分数随时间的变化情况如图6所示.从图中可以看出,反应温度为525℃时,所得H2体积分数最高,而CO2、CO和CH4体积分数都较低.当温度降低至475℃时,CO2、CO体积分数有所降低,这是由于硅酸锂吸附CO2是放热反应,随温度降低有所增强,但中间产物甲烷含量明显升高,是由于甲烷重整是吸热反应,受到较大限制,最终导致H2体积分数有所降低.在525℃以上,随着温度升高,甲烷重整反应有所增强,然而硅酸锂吸附CO2的能力明显下降,导致平衡移动的效果减弱,最终得到的H2体积分数也有所降低.总的来说,温度对SE-SRE的影响是对重整反应和CO2吸附两方面共同作用的结果,温度变化对两者的影响是相反的,因为必然存在一个使制氢效果达到最优的平衡点.实验结果表明,525℃既能满足重整反应的需求,又能使掺钾硅酸锂吸附能力达到较高水平,是SE-SRE系统的最佳反应温度.
2.3.3 空速对SE-SRE的影响
空速反映的是反应装置的处理能力,也是重要的工艺参数.为分析空速对制氢效果的影响,分别取空速为0.9mL/(g·h)、1.5mL/(g·h)、2.1mL/(g·h)和2.7mL/(g·h)进行对比实验,温度为525℃,水醇体积比为6∶1,取2g催化剂和6g掺钾硅酸锂,所得产物体积分数随时间的变化情况如图7所示.从图中可以看出,随着空速的提升,产物中H2体积分数越来越低,而CO2体积分数越来越高,这是由于当空速升高时,反应生成的CO2在反应器中的停留时间缩短,导致硅酸锂吸附CO2反应不能充分进行,促进平衡移动的效果也会随之减弱,最终得到的产物中H2体积分数也会降低,反应开始0.5h后,空速为0.9mL/(g·h)的情况下H2体积分数还保持在93%以上,而其他3个较高空速条件下H2体积分数都已降低到90%以下,因此选取0.9mL/(g·h)为SE-SRE系统的最佳空速.
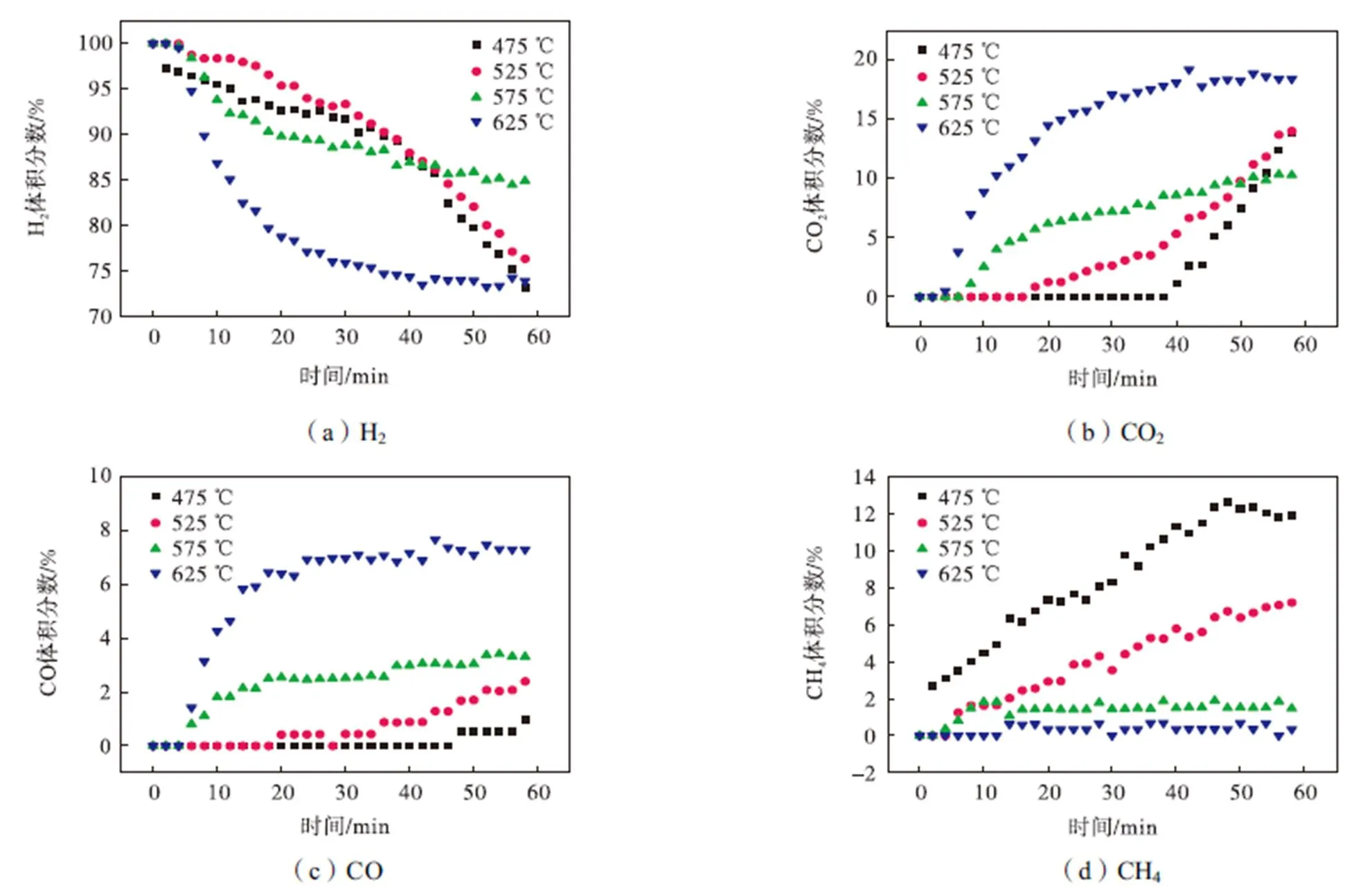
图6 不同温度下产物体积分数随时间的变化情况

图7 不同空速下产物体积分数随时间的变化情况
2.3.4 水醇比对SE-SRE的影响
水醇比提高有助于减少催化剂积碳,然而根据动力学模拟可知高水醇比需要高能耗[13].为得到合适的水醇比,分别取4∶1、6∶1、8∶1和10∶1这4种水醇比的原料进行对比实验,温度为525℃,空速为0.9mL/(g·h),取2g催化剂和6g掺钾硅酸锂,所得产物体积分数随时间的变化情况如图8所示.从图中可以看出,随着水醇比的增加,产物中H2体积分数增加,而CH4体积分数降低,这是由于反应物中水蒸气分压的增大,导致了甲烷水蒸气重整反应平衡向生成H2的方向移动,从而增加了CH4的转化率和H2的产率,然而水醇比的增加还意味着原料气化需要更大的能耗,水醇比为8∶1时反应0.5h后仍能保持96%以上的高H2纯度.因此综合考虑H2产率以及反应能耗,选取8∶1为SE-SRE系统的最佳水醇比.

图8 不同水醇比下产物体积分数随时间的变化情况
2.3.5 催化剂与吸附剂配比对SE-SRE的影响
吸附剂量增加能提升吸附效果,但也会增加成本,因此需要选取合适的催化剂与吸附剂配比.将催化剂量定为2g,掺钾硅酸锂分别取2g、4g、6g和8g,温度为525℃,空速为0.9mL/(g·h),水醇比为8∶1,所得产物体积分数随时间的变化情况如图9所示.从图中可以看出,随着吸附剂量的增大,产物中CO2体积分数降低,吸附穿透前阶段持续时间也会随之增加,吸附CO2的效果更好,带来的平衡移动效果也更强,因此产物中H2体积分数也就随之升高,然而吸附剂量的增加必然会带来成本的增长,催化剂与吸附剂配比为1∶3时,反应0.5h后仍能保持96%以上的高H2纯度,而配比从1∶3增大到1∶4时,可以看出吸附效果的提升并不很大,因此综合考虑H2产率以及成本因素,选取1∶3为SE-SRE系统最佳的催化剂与吸附剂配比.
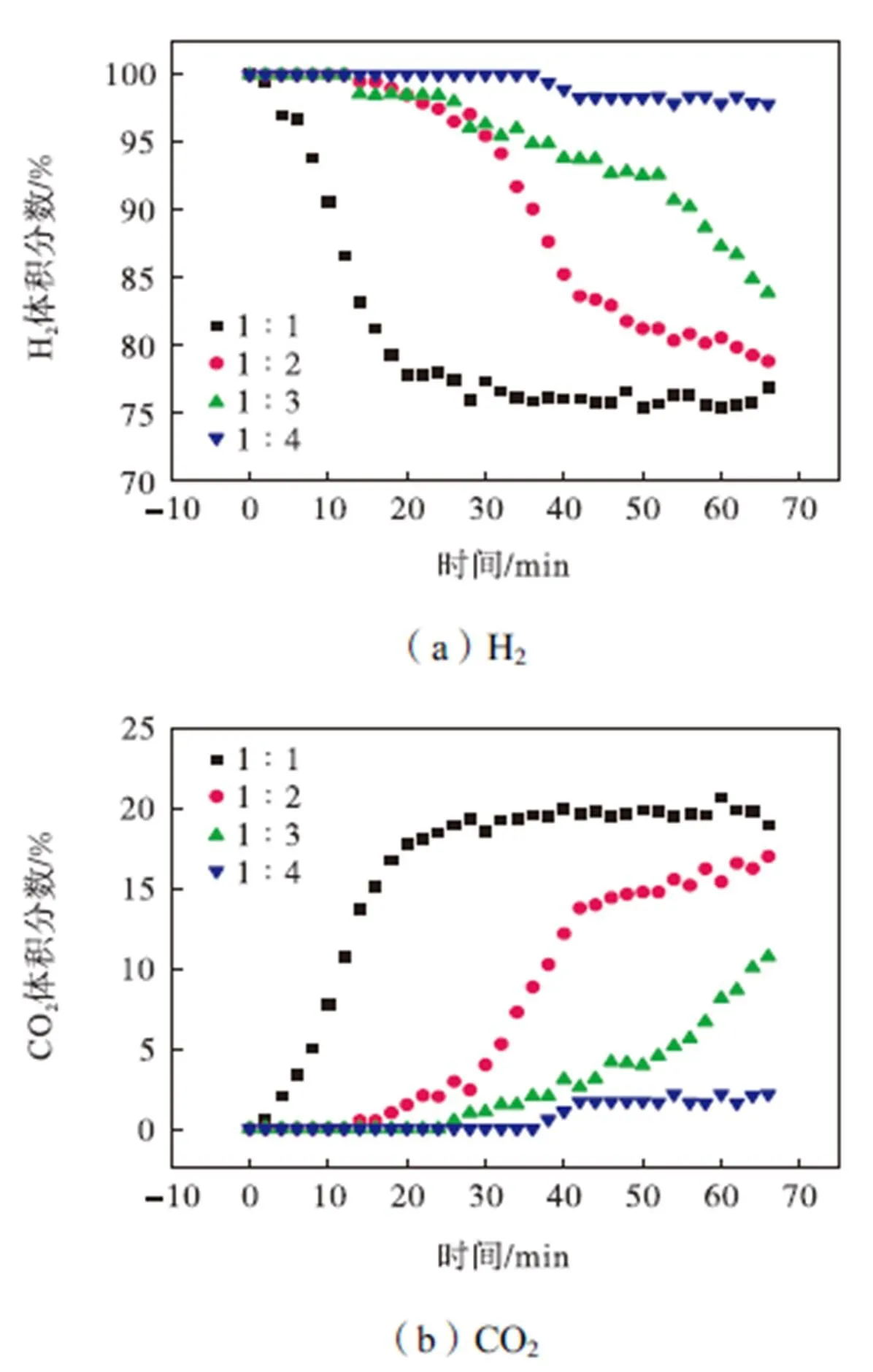
图9 不同催化剂与吸附剂比例下产物体积分数随时间变化情况
2.3.6 SE-SRE循环实验
吸附剂和催化剂在循环使用中的稳定性直接关系到在工业生产中的实用性.为了探究以掺钾硅酸锂为吸附剂的SE-SRE系统的循环稳定性,在上文所得最优工况下进行10次循环实验,温度为525℃,空速为0.9mL/(g·h),水醇比为8∶1,取2g催化剂和6g掺钾硅酸锂,每次循环实验中反应0.5h后的产物体积分数如图10所示.从图中可以看出,经过10次SE-SRE循环实验后,产物中CO2体积分数基本维持不变,这说明掺钾硅酸锂吸附剂在循环过程中吸附性能保持良好,而CH4体积分数略有升高,这可能是由于催化剂积碳等因素导致催化性能在多次循环过程中存在一定衰退,因而导致H2体积分数也从96%略微降低到93%,不过总的来说,以掺钾硅酸锂为吸附剂的SE-SRE系统在循环过程中仍能保持较高的CO2吸附活性和H2产率.

图10 循环实验中反应0.5h后的产物体积分数
3 结 论
(1) 通过多种表征方法的结果可以看出,掺钾硅酸锂相比纯硅酸锂具有更高的结晶程度、比表面积和更好的孔隙特性.
(2) 结合热力学分析和重整制氢的实验结果可知,向乙醇水蒸气重整系统中加入硅酸锂吸附剂能有效提高H2产率,掺钾硅酸锂的吸附强化效果优于纯硅酸锂.
(3) 以掺钾硅酸锂为吸附剂的SE-SRE系统的最佳工艺条件是:温度为525℃,空速为0.9mL/(g·h),水醇比为8∶1,催化剂与吸附剂配比为1∶3.该条件下SE-SRE系统经过10次循环实验后仍能保持较高的CO2吸附活性和H2产率.
[1] Holladay J D,Hu J,King D L,et al. An overview of hydrogen production technologies[J].,2009,139(4):244-260.
[2] Kechagiopoulos Panagiotis N,Voutetakis Spyros S,Lemonidou Angeliki A,et al. Hydrogen production via steam reforming of the aqueous phase of bio-oil in a fixed bed reactor[J].,2006,20(5):2155-2163.
[3] Llorca J,Homs N,Sales J,et al. Efficient production of hydrogen over supported cobalt catalysts from ethanol steam reforming[J].,2002,209(2):306-317.
[4] Wang C,Chen Y,Cheng Z,et al. Sorption-enhanced steam reforming of glycerol for hydrogen production over a NiO/NiAl2O4catalyst and Li2ZrO3-based sorbent[J].,2015,29(11):7408-7418.
[5] Carvill B T,Hufton J R,Anand M,et al. Sorption enhanced reaction process[J].,1996,42(2):248-256.
[6] Hufton J R,Mayorga S,Sircar S. Sorption‐enhanced reaction process for hydrogen production[J].,1999,45(2):248-256.
[7] Olivas D Y A,Guerrero M R B,Bretado M A E,et al. Enhanced ethanol steam reforming by CO2absorption using CaO,CaO*MgO or Na2ZrO3[J].,2014,39(29):16595-16607.
[8] Essaki K,Muramatsu T,Kato M. Effect of equilibrium-shift in the case of using lithium silicate pellets in ethanol steam reforming[J].,2008,33(22):6612-6618.
[9] Dewoolkar K D,Vaidya P D. Tailored hydrotalcite-based hybrid materials for hydrogen production via sorption-enhanced steam reforming of ethanol[J].,2016,41(14):6094-6106.
[10] 刘 亮,洪迪昆,冯于川,等. CaO基CO2吸附剂掺杂/负载活性组分的第一性原理[J]. 燃烧科学与技术,2017,23(5):412-417.
Liu Liang,Hong Dikun,Feng Yuchuan,et al. Promoted CaO-based CO2sorbents by first-principles calculations[J].,2017,23(5):412-417(in Chinese).
[11] 王 珂,郭 欣,赵鹏飞,等. 飞灰-硅酸锂吸收捕获CO2的实验研究[J]. 工程热物理学报,2011,32(7):1257-1259.
Wang Ke,Guo Xin,Zhao Pengfei,et al. Experimental study on CO2capture using fly ash-Li4SiO4sorbents[J].,2011,32(7):1257-1259(in Chinese).
[12] 罗重奎. 硅酸锂高温吸收CO2强化甲烷水蒸气重整制氢的研究[D]. 武汉:华中科技大学能源与动力工程学院,2014.
Luo Zhongkui. Study on Capture CO2Using Lithium Silicate Sorbentsat High Temperature Enhanced Steam MethaneReforming for Hydrogen Production[D]. Wuhan:School of Energy and Power Engineering,Huazhong University of Science and Technology,2014(in Chinese).
[13] Qiao X,Lisbona P,Guo X,et al. Energy assessment of ethanol-enhanced steam reforming by means of Li4SiO4carbon capture[J].,2015,30(3):1879-1886.
Hydrogen Production by Sorption-enhanced Steam Reforming of Ethanol Using K2CO3-doped Lithium Silicate
Yu Yang,Guo Xin,Liu Liang
(State Key Laboratory of Coal Combustion,Huazhong University of Science and Technology,Wuhan 430074,China)
Regarding the hydrogen production technology bysorption-enhanced steam reforming of ethanol(SE-SRE),we investigated the effect of lithium silicate on SRE by thermodynamic analysis and hydrogen production experimentation,and analyzed the influence of doped potassium on lithium silicate by combining several characterization methods. In addition,we experimentally studied both the effect of several technological conditions on the SE-SRE system using K2CO3-doped lithium silicate and the cyclic stability of the SE-SRE system. The results indicate that adding lithium silicate to the SRE process enhanced the hydrogen yield,and properly doped potassium can improve the crystallinity and pore characteristics of lithium silicate,thereby increasing its adsorption capacity. We found the best technological conditions for the SE-SRE system to bethe following: a temperature of 525℃,a space velocity of 0.9 mL/(g·h),a ratio of water to ethanol of 8∶1,anda ratio of catalyst to sorbent of 1∶3. After ten cycles,the adsorption activity of lithium silicate and the hydrogen yield still maintained relatively high levels in the SE-SRE system.
K2CO3-doped lithium silicate;steam reforming of ethanol(SRE);sorption enhancement;cyclic stability
TK91
A
1006-8740(2019)01-0045-07
10.11715/rskxjs.R201809017
2018-09-04.
国家自然科学基金资助项目(51576085).
余 阳(1993— ),男,工学硕士,1521386870@qq.com.
郭 欣,女,博士,教授,guoxin@mail.hust.edu.cn.
