miR-101-3p靶向调控Rac1对乳腺癌细胞侵袭和迁移的影响
2019-02-13刘娜翁闪凡陈姝叶国麟
刘娜,翁闪凡,陈姝,叶国麟
(1 佛山科学技术学院,广东佛山528000;2 佛山市第一人民医院)
乳腺癌是女性最常见的恶性肿瘤之一,居女性癌症死亡原因的的首位[1]。侵袭和转移是导致乳腺癌预后不良的主要原因。但目前乳腺癌侵袭和转移的分子机制尚不完全清楚[2]。微小RNA(miRNA)是一类非编码小分子RNA,长度为19~25个核苷酸,主要通过结合靶基因mRNA的3′UTR区,参与基因转录后调控[3]。近年研究发现,miRNA可通过调控癌基因或抑癌基因表达,参与肿瘤细胞增殖、分化、凋亡等生物学过程[4~6]。miR-101-3p是miR-101家族的成员之一,已有研究证实,miR-101-3p表达在肺癌、卵巢癌、胃癌等肿瘤组织中明显下调,并与肿瘤的侵袭和转移有关[7~11]。Rac1是Rho家族的重要成员之一,可参与细胞有丝分裂、骨架重排等生物学过程。有研究发现,在多种肿瘤组织中Rac1高表达,且其高表达可促进肿瘤的侵袭和转移[12,13]。TargetScan软件预测,Rac1是miR-101-3p的靶向调控基因。因此,我们推测miR-101-3p可能通过靶向调控Rac1促进乳腺癌的侵袭和转移。为此,2016年7月~2018年7月,我们进行了如下研究。现报告如下。
1 材料与方法
1.1 材料 乳腺癌细胞株MCF-7、SK-BR-3、MDA-MB-435及正常乳腺细胞株HBL-100,购自上海生命科学院细胞和生物化学研究所。miR-101 mimics、miR-101抑制物及其阴性对照物,美国Ambion公司。所有引物序列由上海捷瑞生物工程有限公司设计合成。Mastercycler Ep Realplex实时荧光定量PCR仪,德国Eppendorf公司;Multiskan MK3型酶标仪,美国Thermo Fisher Scientific公司。野生型与突变型Rac1荧光素酶报告基因载体,美国Introvigen公司。PrimeScriptTMRT Reagent Kit逆转录试剂盒、SYBR Premix Ex TaqTMqRT-PCR试剂盒,日本TaKaRa株式会社;双荧光素酶活性检测试剂盒,北京艾然生物科技有限公司。Rac1、MMP-2、GAPDH一抗及HRP标记的羊抗鼠二抗,美国CST公司。
1.2 细胞传代培养 将MCF-7、SK-BR-3、MDA-MB-435及HBL-100细胞37 ℃快速解冻,然后将MCF-7、SK-BR-3、MDA-MB-435细胞接种于含10% FBS的DMEM高糖培养基中,HBL-100细胞接种于含10% FBS的RPMI 1640培养基中,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。待细胞融合80%以上时,按1∶3传代。取传2代、对数生长期、生长状态良好的细胞用于后续实验。
1.3 乳腺癌细胞筛选 收集传2代、对数生长期、生长状态良好的MCF-7、SK-BR-3、MDA-MB-435及HBL-100细胞,采用TRIzol法提取细胞总RNA,经超微量分光光度计鉴定,A260/A280为1.8~2.0,可用于后续实验。按PrimeScriptTMRT Reagent Kit试剂盒说明将总RNA逆转录为cDNA,以cDNA为模板,按SYBR Premix Ex TaqTMqRT-PCR试剂盒说明进行PCR扩增。引物序列:miR-101-3p上游引物5′-ACGGGCGAGCTCAGTACTGTG-3′,下游引物5′-CCAGTGCAGGGTCCGAGCTA-3′;GAPDH上游引物5′-CTGGGCTACACTGAGCACC-3′,下游引物5′-AAGTGGTCGTTGAGGGCAATG-3′。PCR反应条件:95 ℃预变性5 s,95 ℃变性5 s、60 ℃退火30 s共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。选择miR-101-3p相对表达量最低的乳腺癌细胞进行后续实验。
1.4 细胞分组与转染 取miR-101-3p相对表达量最低的乳腺癌细胞,接种于6孔板,每孔1×105个。随机分为对照组、miR-101-3p抑制物组和miR-101-3p mimics组,每组设3个复孔。然后将6孔板置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。待细胞贴壁且生长融合30%左右时,miR-101-3p抑制物组加入miR-101-3p抑制物和Lipofectamine2000转染试剂,miR-101-3p mimics组加入miR-101-3p mimics和Lipofectamine2000转染试剂,对照组仅加入等量Lipofectamine2000转染试剂。收集各组转染24 h细胞,按1.3中的方法检测miR-101-3p相对表达量。实验重复3次,取平均值。
1.5 各组细胞侵袭和迁移能力检测 ①细胞侵袭能力:采用Transwell侵袭实验。收集各组转染24 h细胞,胰酶消化后制成单细胞悬液,细胞密度为1×106个/mL。将Transwell小室的上下室之间用包被了人工基底胶的聚碳酸酯微孔膜(孔径8 μm)分隔,上室加入细胞悬液100 μL,下室加入含10% FBS的完全培养基500 μL。然后将Transwell小室置于37 ℃、5% CO2、饱和湿度的细胞培养箱中孵育8 h。取出聚碳酸酯微孔膜,用棉签轻轻擦去基底胶和上表面的细胞,然后中性甲醛固定,苏木素染色。显微镜下随机选取5个50倍视野,计数穿膜细胞数。以穿膜细胞数代表细胞侵袭能力。实验重复3次,取平均值。②细胞迁移能力:采用Transwell迁移实验。方法同上,但聚碳酸酯微孔膜不包被人工基底胶。实验重复3次,取平均值。
1.6 miR-101-3p靶向调控基因检测 采用双荧光素酶报告基因实验。取miR-101-3p相对表达量最低的乳腺癌细胞,接种于24孔板,每孔2×104个。随机将细胞分为野生型Rac1+miR-101-3p mimics组、突变型Rac1+miR-101-3p mimics组、野生型Rac1+阴性对照物组、突变型Rac1+阴性对照物组,每组设3个复孔,然后置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。当细胞融合80%左右时,按Lipofectamine2000试剂盒说明分别加入相应的转染物和转染试剂。各组转染24 h,每孔加入1×passive Lysis Buffer 100 μL,充分混匀,室温孵育15 min。每孔取20 μL,置于96孔发光检测板,于ModulusTM发光检测仪检测。实验重复3次,取平均值。
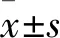
2 结果
2.1 MCF-7、SK-BR-3、MDA-MB-435、HBL-100细胞miR-101-3p表达比较 MCF-7、SK-BR-3、MDA-MB-435、HBL-100细胞miR-101-3p相对表达量分别为2.33±0.42、2.05±0.26、1.82±0.38、3.05±0.42。MCF-7、SK-BR-3、MDA-MB-435细胞miR-101-3p相对表达量均明显低于HBL-100细胞(P均<0.05)。以MDA-MB-435细胞miR-101-3p相对表达量最低。
2.2 各组miR-101-3p表达比较 对照组、miR-101-3p抑制物组、miR-101-3p mimics组miR-101-3p相对表达量分别为1.47±0.39、0.58±0.16、9.22±0.82。miR-101-3p抑制物组miR-101-3p相对表达量明显低于对照组,而miR-101-3p mimics组miR-101-3p相对表达量明显高于对照组(P均<0.05)。
2.3 各组细胞侵袭能力比较 对照组、miR-101-3p抑制物组、miR-101-3p mimics组穿膜细胞数分别为(105.67±7.77)、(188.00±18.08)、(68.67±9.45)个。miR-101-3p抑制物组穿膜细胞数明显高于对照组,而miR-101-3p mimics组穿膜细胞数明显低于对照组(P均<0.05)。
2.4 各组细胞迁移能力比较 对照组、miR-101-3p抑制物组、miR-101-3p mimics组穿膜细胞数分别为(85.67±11.50)、(194.20±15.38)、(54.67±8.33)个。miR-101-3p抑制物组穿膜细胞数明显高于对照组,而miR-101-3p mimics组穿膜细胞数明显低于对照组(P均<0.05)。
2.5 miR-101-3p靶向调控基因验证 野生型Rac1+miR-101-3p mimics组荧光素酶活性为0.21±0.04,野生型Rac1+阴性对照物组为0.64±0.09,突变型Rac1+miR-101-3p mimics组为0.65±0.05,突变型Rac1+阴性对照物组为0.59±0.09。野生型Rac1+miR-101-3p mimics组荧光素酶活性明显低于其他三组(P均<0.05),而其他三组两两比较P均>0.05。
3 讨论
近年来,随着医学技术的发展、手术方式的不断改进以及靶向药物的临床应用,乳腺癌早期预后明显提高[14]。但对晚期多发转移性乳腺癌仍缺乏有效的治疗手段,患者预后仍然较差[15]。侵袭和转移是导致乳腺癌预后不良的主要原因。但目前乳腺癌侵袭和转移的分子机制尚不完全清楚[2]。miRNA是一类高度保守的小分子非编码单链RNA。近年研究已证实,miRNA在多种肿瘤组织中差异表达,可调控肿瘤细胞增殖、凋亡以及血管形成,从而促进肿瘤的侵袭和转移,有可能作为肿瘤的治疗靶点。因此,深入了解miRNA的功能对于分子靶向药物的研发具有重要意义[16,17]。miR-101-3p属于肿瘤抑制因子,在鼻咽癌、肝癌等组织中表达明显降低,并与肿瘤的侵袭和转移有关[18,19]。在乳腺癌组织中miR-101-3p表达亦明显降低[20]。但其在乳腺癌侵袭和转移中的作用机制尚不清楚。
本研究首先采用qRT-PCR法检测了乳腺癌MCF-7、SK-BR-3、MDA-MB-435细胞及正常乳腺HBL-100细胞中miR-101-3p表达,结果发现,三种乳腺癌细胞miR-101-3p表达均明显降低,且以MDA-MB-435细胞表达最低,与Liu等[20]报道一致。为进一步验证miR-101-3p对乳腺癌细胞侵袭和迁移的影响,我们采用瞬时转染技术将miR-101-3p抑制物、miR-101-3p mimics转染入MDA-MB-435细胞,通过Transwell侵袭和迁移实验观察了细胞侵袭和迁移能力,结果发现,miR-101-3p抑制物组细胞侵袭和迁移能力均明显高于对照组,而miR-101-3p mimics组细胞侵袭和迁移能力均明显低于对照组,表明miR-101-3p与乳腺癌细胞的侵袭和迁移有关。
众所周知,miRNA主要是通过结合靶基因mRNA的3′UTR区,参与其靶基因的转录后调控[3],主要体现在一方面可与沉默核糖蛋白复合物结合,通过序列完全互补的方式降解目的蛋白,另一方面可通过非完全互补结合发挥转录后调控。TargetScan软件能够预测miRNA的靶基因及其结合位点。我们采用TargetScan软件预测发现,Rac1可能是miR-101-3p的靶基因。Rac1是一种Rho GTP酶,具有GTP和GDP两种状态,可结合并水解鸟苷酸,广泛表达于人体各种组织。Rac1异常表达可引起糖尿病、亨廷顿舞蹈病等[21,22]。近年研究发现,在多种肿瘤组织中Rac1高表达,且其高表达可促进肿瘤的侵袭和转移[12,13]。有文献报道,在乳腺癌组织中Rac1表达亦明显升高,并通过调控Rac1/ROS/MMPs信号通路,促进肿瘤的侵袭和转移[23]。为了探究miR-101-3p与Rac1的靶向调控关系,本研究双荧光素酶报告基因实验显示,Rac1为miR-101-3p的直接靶基因。
综上所述,miR-101-3p可能通过靶向调控Rac1参与乳腺癌的侵袭和转移。这为转移性乳腺癌的靶向治疗提供了新思路。
