催吐萝芙木离体培养和植株再生体系的建立
2019-02-13董佳颖杨小田向小群郭晋雅高峰
董佳颖,杨小田,向小群,郭晋雅,高峰
催吐萝芙木离体培养和植株再生体系的建立
董佳颖,杨小田,向小群,郭晋雅,高峰*
(华南师范大学生命科学学院, 广州 510631)
为建立催吐萝芙木(Afzel.)的快繁再生体系,以茎段为外植体,比较了植物生长调节剂对其愈伤组织诱导、分化及生根的影响。结果表明,诱导愈伤组织的适宜培养基为MS+2,4-D 1.0 mg L–1+TDZ 0.5 mg L–1或MS+2,4-D 2.0 mg L–1+TDZ 0.5 mg L–1,出愈率达100%且生长状况良好;诱导丛生芽的最佳培养基为MS+6-BA 3.0 mg L–1+NAA 0.1 mg L–1,出芽率为46.6%,平均出芽数为3.04。这为催吐萝芙木的快速繁殖和遗传转化研究奠定了基础。
催吐萝芙木;愈伤组织;再生;组织培养
萝芙木为夹竹桃科(Apocnyaceae)萝芙木属()植物的总称,是一类天然名贵的热带药用植物。富含多种生物碱,如利血平、阿马尼新、育亨宾等, 可以用于治疗多种疾病[1–5]。萝芙木属植物共有135种和变种,我国产9种,比较重要的有中国萝芙木()、云南萝芙木()、催吐萝芙木()和印度萝芙木()[6]。
有研究表明,催吐萝芙木的各项生长指标明显高于其他萝芙木物种。云南萝芙木植株较小,生物产量低,利血平含量也低;印度萝芙木植株中等, 生物产量也较多,利血平含量高[5];催吐萝芙木植株高大,生物产量多,利血平含量高;作为提取利血平的原料开发,应首选催吐萝芙木和印度萝芙木[7]。在国内催吐萝芙木已用作提取利血平的原料,并将其制成治疗高血压的降压灵(verticil)和降压平(resemine)等药品应用于临床[8]。
然而,由于萝芙木的种子繁殖出芽率低,生长缓慢,扦插繁殖生根困难[7],无法用于大规模的生产。因此,采用离体培养萝芙木无疑具有重要的理论和应用价值。目前,关于萝芙木的组织培养仅在印度萝芙木和云南萝芙木中有报道[8–11],而催吐萝芙木的离体培养及植株再生尚未见报道。本文以催吐萝芙木的茎段和叶片为外植体,通过比较不同植物生长调节剂对其愈伤组织诱导、分化及试管苗生根的影响,以建立催吐萝芙木的离体培养植株再生体系,为催吐萝芙木的快速繁殖及遗传转化奠定基础。
1 材料和方法
1.1 材料
催吐萝芙木(Afzel.)由华南师范大学生命科学学院周先叶副教授鉴定并提供, 种植于该校生物园内。
1.2 外植体的表面消毒
选取幼嫩茎段或幼叶作为外植体,用洗洁精浸泡和流水冲洗30 min后,蒸馏水冲洗2~3次,洁净纱布吸干。用70%乙醇浸泡20 s后,用2%次氯酸钠消毒7~8 min,再用无菌水冲洗5~8次。
1.3 愈伤组织的诱导
将消毒后的幼茎切成长度为5 mm的茎段,叶片切成0.5 cm×0.5 cm接种于含有不同植物生长调节剂组合的MS培养基上,在28℃黑暗培养。每3 d观察1次,30 d统计出愈率=产生愈伤组织的外植体数/接种的外植体总数。每处理接种27个外植体,重复3次。
1.4 芽的分化诱导
将愈伤组织转移到含6-BA (1.0~4.0 mg L–1)+ NAA (0.05~0.5 mg L–1)的MS培养基上,暗培养1周后转为16 h d–1光照培养(光强2 000mol m–2s–1)。每3 d观察1次,6周后统计出芽率=(分化出芽的愈伤组织数/接种的愈伤组织总数)×100%。
1.5 丛生芽的生根诱导
丛生芽生长至1~2 cm长时,切成单芽,扦插至含不同浓度NAA和IBA的1/2MS生根培养基中。4周后统计生根率和根的数量,筛选最适生根培养基。
1.6 炼苗移栽
将已生根试管苗的培养瓶盖拧松(但不揭开), 自然光照2~3 d后再揭去瓶盖。在自然光照下经过5~7 d练苗,将试管苗移栽入盛有营养土的培养钵中,并观察成活情况。
2 结果和分析
2.1 愈伤组织的诱导
分别将外植体接种在含生长素类激素2,4-D、NAA、IBA和含细胞分裂素类激素6-BA或TDZ的MS培养基上,进行不同植物生长调节剂对愈伤组织诱导影响的单因素试验。结果表明,幼茎切段在两端的切口处能诱导产生愈伤组织(图1: A),但不同植物生长调节剂对愈伤组织的诱导效果不同(表1), 除IBA和6-BA外,2,4-D、NAA和TDZ均能诱导愈伤组织产生,且TDZ>2,4-D>NAA。
从表2可见,在2.0 mg L–12,4-D+0.5 mg L–1NAA,2.0 mg L–12,4-D+0.5 mg L–16-BA,1.0 mg L–12,4-D+0.5 mg L–1TDZ,2.0 mg L–12,4-D+0.5 mg L–1TDZ,2.0 mg L–16-BA+0.5 mg L–1NAA的培养基上,出愈率均为100%。外植体在2,4-D+TDZ组合的培养基中培养3 d,开始产生愈伤组织,一周后愈伤组织较明显,三周后整个外植体基本被愈伤组织覆盖,且愈伤组织生长状况好,愈伤组织量大;在2,4-D+ 6-BA和2,4-D+NAA的组合中,外植体启动愈伤组织发生的时间稍慢,一般为一周左右;而在6-BA+ NAA的组合中,愈伤组织易褐化。综合考虑愈伤组织启动时间、出愈率和愈伤组织生长情况, 诱导催吐萝芙木产生愈伤组织的最佳培养基为MS+2,4-D 1.0 mg L–1+TDZ 0.5 mg L–1或MS+2,4-D 2.0 mg L–1+ TDZ 0.5 mg L–1。
2.2 6-BA与NAA配比对愈伤组织芽分化的影响
不同浓度6-BA与NAA配比对催吐萝芙木诱导愈伤组织产生不定芽具有一定的影响(表3)。6-BA浓度对愈伤组织的不定芽分化的影响尤为明显。随6-BA浓度的增加,愈伤组织诱导不定芽的分化率也提高,但并不呈线性正相关。同时,6-BA/NAA对愈伤组织分化出芽有明显影响,比值低时促进愈伤组织生长,抑制芽的分化,分化的芽矮小畸形; 随6-BA/NAA比值的增加,芽分化率也逐渐增大,愈伤组织也由原来的黄白色逐渐变为绿色,表面芽点突出;当6-BA/NAA比值达到30时,芽的数量和生长状态为最佳(图1: B)。

表1 植物生长调节剂对愈伤组织诱导的影响

表2 植物生长调节剂组合对催吐萝芙木愈伤组织诱导的影响
2.3 试管苗的生根培养与炼苗
不定芽在添加NAA的培养基中培养1周后, 基部分化出不定根(图1: C),同时,随NAA浓度增加生根率和生根数呈先升高后下降的趋势;NAA浓度为0.1 mg L–1时,生根数量少,长出的根细而长; NAA浓度为0.5 mg L–1时,生根数量多,且根粗而短;NAA浓度达到1.0 mg L–1时,生根率下降到60%;当NAA浓度为2.0 mg L–1时,生根率仅为13.3%。这说明低浓度的NAA利于生根,而高浓度的NAA对生根具有抑制作用。从生根数和根的生长情况来看,IBA对试管苗根的诱导效果较NAA差。当IBA浓度为0.5~1.0 mg L–1时,能不同程度诱导生根, 但根数量少,且比较细长。两种生长素等比例混合对根的诱导效果并没有表现出叠加效应,甚至与单一生长素相比,产生根的数量更少,诱导效果更差。因此,综合生根率、生根数和根生长情况来看,催吐萝芙木生根培养的最佳培养基为1/2MS+NAA 0.5 mg L–1,生根率达100%,且根的生长状态最佳, 从而形成完整的再生植株(图1: D)。选择生长健壮、株高、茎粗和木质化程度高的完整再生植株进行炼苗(图1: E),然后将再生植株移栽至土壤,幼苗成活且生长状态良好(图1: F)。
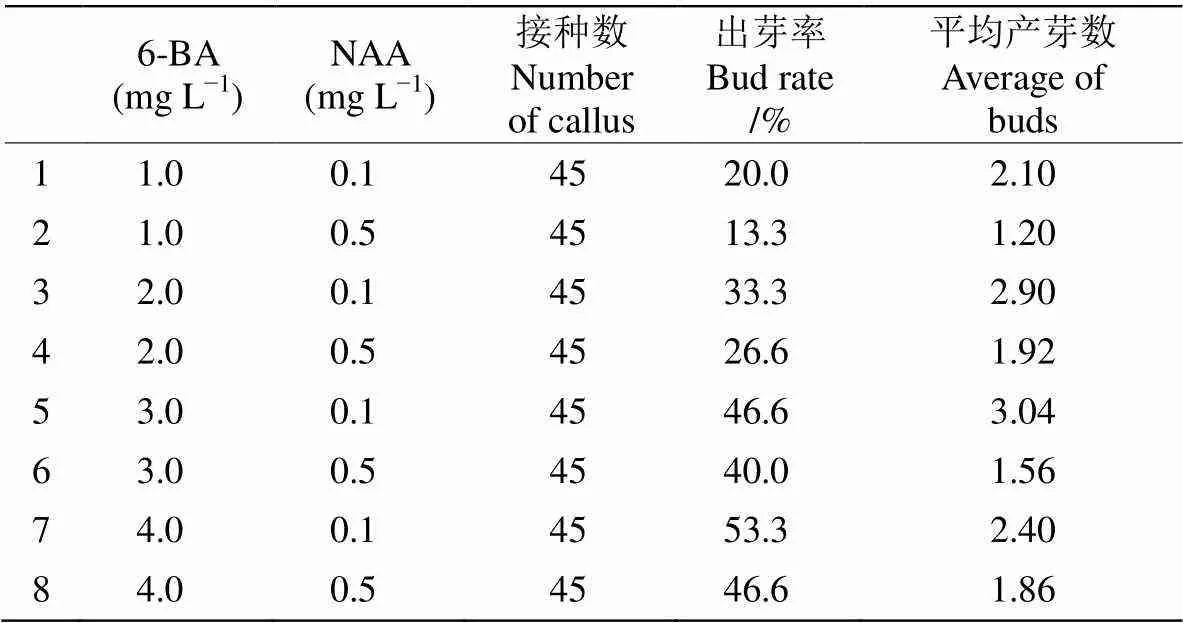
表3 6-BA与NAA配比对不定芽诱导的影响
3 讨论
植物生长调节剂在植物离体培养中起着启动愈伤组织形成和芽、根的分化等作用,其种类和配比是影响愈伤组织产生和分化的主要因素。其中生长素具有促进细胞增殖和促进生根等生理作用,细胞分裂素具有引起细胞分裂,诱导芽的形成和促进芽的生长等生理作用。萝芙木属植物愈伤组织诱导中,常用的生长素是2,4-D和NAA,细胞分裂素是6-BA。印度萝芙木愈伤组织诱导使用的是6-BA和NAA组合[8];而云南萝芙木愈伤组织诱导使用的是2,4-D和6-BA组合[11]。本研究结果表明,2,4-D和TDZ单独使用对催吐萝芙木茎段愈伤组织的启动效果优于NAA、IBA和6-BA,且2,4-D与TDZ或6-BA的组合效果更佳;其中2,4-D与TDZ是诱导催吐萝芙木愈伤组织形成的最佳组合,启动愈伤组织的时间快且出愈率高。从芽的分化诱导来看,云南萝芙木不定芽诱导的最佳培养基是MS+6-BA 3.0 mg L–1+NAA 0.05 mg L–1[11];印度萝芙木则为MS+6- BA 1.0 mg L–1+NAA 0.1 mg L–1[8];而催吐萝芙木则是MS+6-BA 3.0 mg L–1+NAA 0.1 mg L–1。这说明萝芙木属不同物种的愈伤组织诱导和分化所需的植物生长调节剂种类和浓度存在一定的差异。
云南萝芙木用叶片,而印度萝芙木用腋芽、叶片和顶芽都可成功诱导愈伤组织产生和分化,并获得再生植株[8–11]。本文采用2,4-D与TDZ或6-BA组合可诱导催吐萝芙木叶片产生愈伤组织,但经过几个月的培养仍未分化。高燕等[11]对印度萝芙木组织培养的研究表明,叶片容易产生愈伤组织,但再分化能力较差,这与本研究结果相一致。而以云南萝芙木的叶片作为外植体诱导的愈伤组织可正常分化,并获得再生植株[8]。这可能是由于萝芙木不同物种或不同组织对植物生长调节剂的敏感度不同所致,但具体原因尚需进一步研究。
此外,萝芙木离体培养技术除了可用于快速繁殖外,还可用于作为基因工程技术的受体系统,通过根癌农杆菌或发根农杆菌介导外源基因到萝芙木组织内,进行品种改良与器官再生[12–15],培育出优良高产的催吐萝芙木新品种。本文所建立的催吐萝芙木组织培养及植株再生体系将为其遗传转化奠定重要的技术基础。
[1] ZHENG Y, LIAO Z H. Research progress of tissue culture technology of[J]. J Anhui Agric Sci, 2011, 39(15): 8929– 8930,8984. doi:10.3969/j.issn.0517-6611.2011.15.042.郑月, 廖志华. 萝芙木组织培养技术研究进展[J]. 安徽农业科学, 2011, 39(15): 8929–8930,8984. doi:10.3969/j.issn.0517-6611.2011.15.042.
[2] YU J, MA Y, DRISKO J, et al. Antitumor activities ofextract and potentiation of carboplatin effects against ovarian cancer [J]. Curr Ther Res, 2013, 75: 8–14. doi: 10.1016/j.curtheres. 2013. 04.001.
[3] Rao B G, Rao P U, Rao E S, et al. Evaluation ofantibacterialactivity and anti-inflammatory activity for different extracts ofL. root bark [J]. Asian Pac J Trop Biomed, 2012, 2(10): 818–821. doi: 10.1016/S2221-1691(12)60235-4.
[4] Lobay D.in the treatment of hypertension [J]. Integr Med (Encinitas), 2015, 14(3): 40–46.
[5] EZEIGBO I I, EZEJA M I, MADUBUIKE K G, et al. Antidiarrhoeal activity of leaf methanolic extract of[J]. Asian Pac J Trop Biomed, 2012, 2(6): 430–432. doi:10.1016/S2221-1691(12) 60070-7.
[6] ZHAO Y S, ZHOU Y X, CHA Y S. Introduction and domestication ofand its prospects for development [J]. Chin J Ethnomed Ethnopharm, 2006(3): 179–180.赵永生, 周亚兴, 查云盛. 云南萝芙木引种驯化栽培及发展前景[J]. 中国民族民间医药杂志, 2006(3): 179–180.
[7] ZHANG L X, GUO S R, LI X L, et al. The main insect pests and control of[J]. J Chin Med Mat, 2006, 29(12): 1276–1278. doi:10.3321/j.issn:1001-4454.2006.12.005.张丽霞, 郭绍荣, 李学兰, 等. 催吐萝芙木的主要虫害及其防治[J]. 中药材, 2006, 29(12): 1276–1278. doi:10.3321/j.issn:1001-4454.2006.12.005.
[8] LONG J X, CAO F X, CAO J W, et al. Callus inducement and plantlet regeneration from leaves ofTsiang [J]. J CS Univ For Technol, 2008, 28(3): 49–54. doi:10.3969/j.issn.1673-923X. 2008.03.010.龙绛雪, 曹福祥, 曹基武, 等. 云南萝芙木叶愈伤组织诱导与植株再生[J]. 中南林业科技大学学报, 2008, 28(3): 49–54. doi:10.3969/ j.issn.1673-923X.2008.03.010.
[9] Baksha R, Jahan M A A, Khatun R, et al.rapid clonal propagation of(Linn.) Benth [J]. Bangladesh J Sci Ind Res, 2007, 42(1): 37–44. doi: 10.3329/bjsir.v42i1.353.
[10] Shahrear A, Amin M N, Azad M A K, et al. Micropropagation and plant regeneration ofby tissue culture technique [J]. Pakistan J Biol Sci, 2002, 5(1): 75–79. doi:10.3923/pjbs. 2002.75.79.
[11] GAO Y, LI S L, BAI Y B, et al. Study on[J]. Trop Agric Sci Technol, 2009, 32(2): 29–31,34. doi:10.3969/j. issn.1672-450X.2009.02.011.高燕, 李守岭, 白燕冰, 等. 印度萝芙木组织培养技术研究[J]. 热带农业科技, 2009, 32(2): 29–31,34. doi:10.3969/j.issn.1672-450X. 2009.02.011.
[12] BENJAMIN B D, ROJA G, HEBLE M R.mediated transformation ofRegeneration and alkaloid synthesis [J]. Plant Cell Tiss Org, 1993, 35(3): 253–257. doi: 10.1007/BF00037278.
[13] SUDHA C G, REDDY B O, RAVISHANKAR G A, et al. Production of ajmalicine and ajmaline in hairy root cultures ofHook f., a rare and endemic medicinal plant [J]. Biotechnol Lett, 2003, 25(8): 631–636. doi:10.1023/A:1023012114628.
[14] Ding L M, Long R J, Zhu T X. The effect of 2,4-dichlorophen- oxyacetic acid (2,4-D) and 6-benzyladenine (6-BA) on callus induction of bluegrasses [J]. Grassl Turf, 2003(1): 34–37. doi: 10.3969/j.issn. 1009-5500.2003.01.010.丁路明, 龙瑞军, 朱铁霞. 2,4-D和6-BA对早熟禾愈伤组织诱导的影响[J]. 草原与草坪, 2003(1): 34–37. doi: 10.3969/j.issn.1009-5500. 2003.01.010.
[15] Wang H, Liao Z H, Tian G X, et al. Genetic transformation oftsiang by[J]. J SW China Norm Univ (Nat Sci), 2006, 31(2): 137–141. doi: 10.3969/j.issn. 1000-5471.2006.02.032.王泓, 廖志华, 田桂香, 等. 发根农杆菌介导云南萝芙木的遗传转化[J]. 西南师范大学学报(自然科学版), 2006, 31(2): 137–141. doi: 10.3969/j.issn.1000-5471.2006.02.032.
Culture and Establishment of Rapid Regeneration System of
DONG Jia-ying, YANG Xiao-tian, XIANG Xiao-qun, GUO Jin-ya, GAO Feng*
(School of Life Sciences, South China Normal University,Guangzhou 510631, China)
To constructe the rapid regeneration system of Rauvolfia vomitoriaAfzel., the effects of plant growth regulators on callus induction, differentiation, and rooting were studied with young stems as explants. The results showed that the optimal medium for callus induction was MS+2,4-D 1.0 mg L–1+TDZ 0.5 mg L–1or MS+2,4-D 2.0 mg L–1+TDZ 0.5 mg L–1with callus induction rate of 100%. The optimal medium for callus differentiation was MS+6-BA 3.0 mg L–1+NAA 0.1 mg L–1with shooting rate of 46.6% and average buds of 3.04. So, these would lay a foundation for studying on rapid regeneration and genetic transformation of R. vomitoria.
Afzel.; Callus; Regeneration; Tissue culture
10.11926/jtsb.3935
2018-04-25
2018-07-04
国家自然科学基金项目(31171601)资助
This work was supported by the National Natural Science Foundation of China (Grant No. 31171601).
董佳颖(1994~ ),女,硕士研究生,主要从事植物遗传调控研究。E-mail: ddongjiaying@163.com
E-mail: peak0041@vip.sina.com
