CT引导微波消融治疗下肢骨样骨瘤的临床研究
2019-02-10马小燕徐燕能罗建明张向琼斯光晏
郑 波 胡 伟 马小燕 袁 罡 徐燕能 张 训 罗建明 张向琼 斯光晏
(西南医科大学附属中医医院介入科,四川省泸州市 646000)
骨样骨瘤是一种生长缓慢的良性成骨细胞性骨肿瘤,于1935年由Jaffe首先报道[1],其发病率占良性骨肿瘤的10%~12%[2-4],多影响长骨的骨干,约50%发生在下肢,且主要位于股骨和胫骨[5]。其好发于年轻人,以夜间痛为主要表现,对于疼痛严重和对非甾体抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)无效或者对NSAIDs并发症不耐受者,可选择消融、外科切除等治疗,但总的治疗趋势由“巨创”向微创甚至无创方向发展。鉴于此,我们对下肢骨样骨瘤采用 CT 引导下经皮穿刺微波消融术(microwave ablation,MWA)进行治疗,取得了良好的临床疗效。现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2015年7月至2018年7月在西南医科大学附属中医医院采用CT引导下经皮穿刺MWA治疗的7例下肢骨样骨瘤患者的临床资料,患者均由两名高年资CT诊断医师诊断为骨样骨瘤。男5例,女2例;年龄12~26岁,平均年龄17.6岁;病程3个月至1.5年,平均7个月。临床表现为局部疼痛,夜间疼痛明显,影响睡眠,就诊前因疼痛而服用NSAIDs等药物治疗,但疗效不佳或不耐受。术前疼痛视觉模拟量表(visual analogue scale,VAS)评分为4~8(6.74±1.16)分。术前行X线、CT检查,影像学主要表现为呈圆形或椭圆形的透明缺损,周围有不同程度硬化,呈典型“牛眼征”表现。病灶位置、瘤巢大小、周围硬化程度等情况见图1~图3。
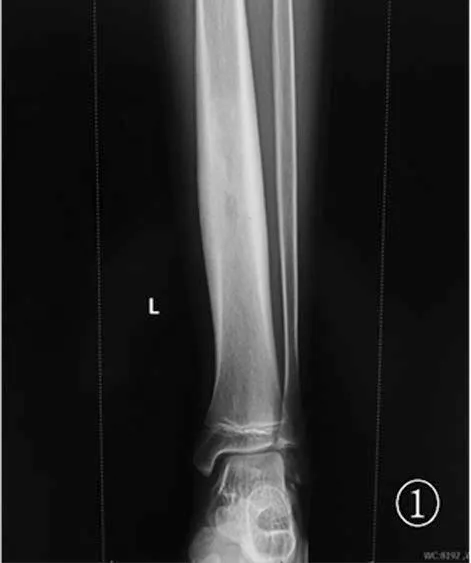
图1 X线平片
(左侧胫骨近内侧缘一卵圆形低密度瘤巢影,骨质增生硬化)

图2 CT平扫矢状位
(左侧胫骨髓腔侧边界清晰卵圆形低密度瘤巢,周围骨质增生硬化,直径约1.4 cm)
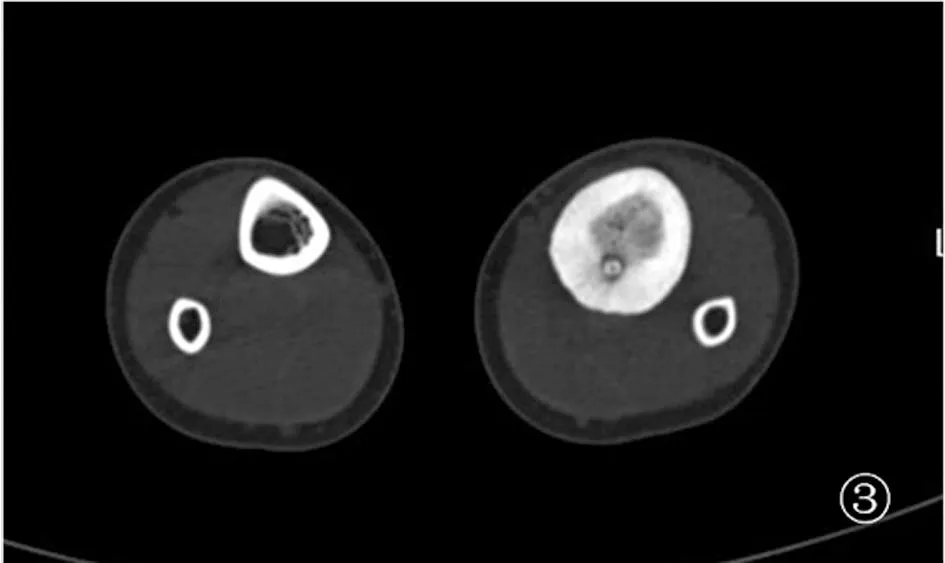
图3 CT平扫轴位
(左侧胫骨髓腔侧边界清晰卵圆形低密度瘤巢,周围骨质增生硬化)
1.2 方法 根据病灶的位置,对7例患者在局麻下合理选择体位(一般多为仰卧位),足部穿“丁”字鞋,穿刺部位肢体加衬垫,避免悬空而影响后续穿刺操作。体表粘贴栅格,对病灶进行薄层CT扫描,根据CT图像确定最佳穿刺点及进针路线(图4~图5)。避开周围神经、血管,穿刺点皮肤取长约3.0 mm切口,骨穿针沿定位方向穿刺,钻透骨皮质直达瘤巢。经骨活检针刮取标本送病理学检查。经骨穿刺通道插入微波消融针直达瘤巢,再次CT 扫描确认后,设置消融参数50 W,治疗持续时间6 min。治疗结束后缓慢取出微波消融针,局部穿刺点包扎。术后行CT 扫描观察穿刺部位有无出血等情况。定期对创口护理,术后第2天患者开始锻炼肌肉收缩,2周内非负重功能锻炼,3个月内避免剧烈运动。
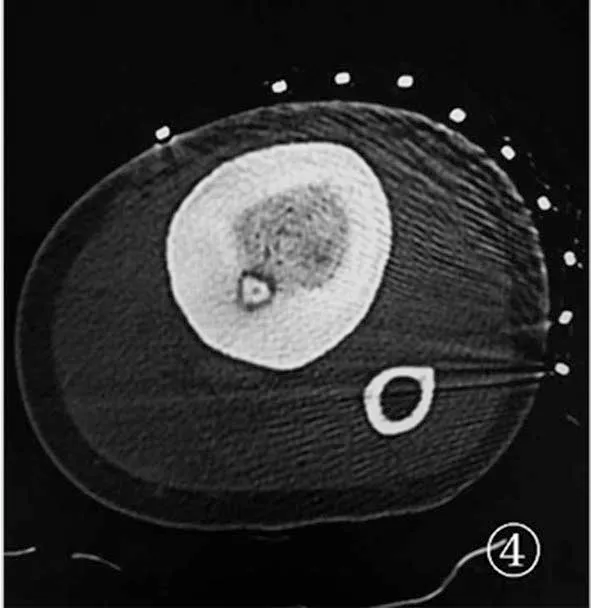
图4 体表贴定位栅定位进针点及穿刺路径
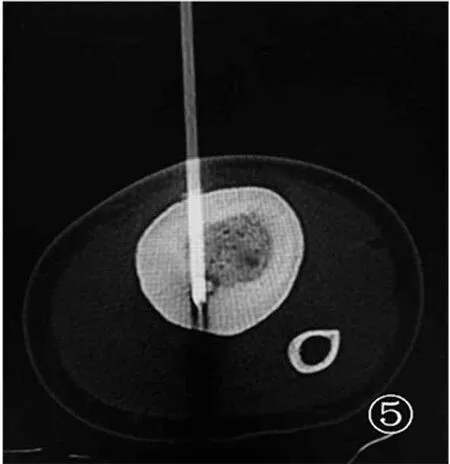
图5 CT扫描确定微波针尖位于病灶中心
1.3 疗效评价 分别于术前、术后1个月、3个月、6个月、12个月对病例进行VAS评分。术后3个月行CT检查,观察消融区骨密度及邻近组织恢复情况,结合VAS评分评估疗效。
1.4 统计学处理 采用SPSS 19.0统计学软件对数据进行处理,术后VAS评分与术前比较采用配对设计资料t检验,以P<0.05 为差异有统计学意义。
2 结 果
本组7例患者均成功实施CT引导下经皮穿刺MWA治疗,其中4例术后病理诊断考虑为骨样骨瘤,HE染色示病灶由骨组织、骨样组织组成,周围见增生纤维组织(图6)。术后1周疼痛明显缓解,均能下地行走,VAS评分较术前明显降低,未见严重并发症。1例患者伤口延迟愈合,经局部换药后完全愈合。术前VAS评分与术后各随访时间VAS评分分别行配对t检验,术前和术后1个月、3个月、6个月、12个月VAS评分分别为(6.74±1.16)、(1.72±1.04)、(0.72±0.54)、(0.68±0.47)、(0.56±0.33)分,术前、术后比较差异有统计学意义(均P<0.05)。术后3个月对患者行CT检查随访:消融区域骨质硬化,大小约2.95 cm×3.33 cm。见图7~图8。

图6 病灶HE染色结果(×20)

图7 CT示消融区域骨质硬化
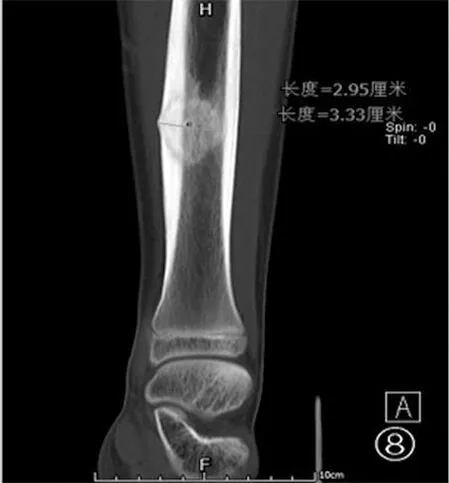
图8 CT示消融区域骨质硬化明显
3 讨 论
骨样骨瘤为良性成骨性骨肿瘤,由成骨细胞及其产生的骨样组织直接构成,好发于青少年,男性多见,男女比例约3 ∶1,可发生于任何部位的骨骼,甚至骨外组织,且多好发于下肢骨,其中以股骨和胫骨多见,占50%~60%[5-7]。影像学表现一般为大小0.2~2.1 cm,瘤巢呈圆形或者椭圆形,边界清楚,边缘有不同程度硬化。临床上骨样骨瘤以疼痛为主要表现,尤以夜间痛为主要症状。对于疼痛严重、影响睡眠、药物疗效不佳或不能耐受药物副作用者,多选择微创消融、外科切除等治疗方式[8]。骨样骨瘤的病灶往往较小(多为0.2~2.1 cm),并且呈局限性,多呈圆形或者椭圆形,这比较适合消融治疗形态,且因消融治疗多适用于直径≤3 cm的病灶,故理论上消融技术适用于骨样骨瘤的治疗。
MWA与射频消融一样,同属热消融范畴,理论上适合射频消融的病灶,基本上也适用于MWA,且疗效及安全性相当[9-10]。但与射频消融相比,MWA治疗具有升温速度快、瘤内温度高、受碳化和血流影响小、消融范围大、操作简单、能实时监控等优点,对于中等或者较大的肿瘤及邻近血管肿瘤,MWA较射频消融更具优势。
既往射频、微波等消融治疗多针对肝脏、肺脏等软组织病灶。骨骼组织有别于软组织,因其组织致密,液体成分相对较少,消融时热辐射传导、分布及安全边界等与软组织有差异。Greenberg等[11]研究发现,当距离超过1.2 cm骨皮质仍未见温度升高。在本研究中,我们亦采用多点消融的办法来扩大消融范围,以降低远期肿瘤复发的可能。
本研究的术后影像随访提示,骨质消融范围直径约3 cm,明显大于Greenberg等研究的1.2 cm,提示本组病例消融过程中远离1.2 cm部位仍受热辐射影响,考虑为病灶位于骨髓髓腔内侧,髓腔内液体较骨质特别是骨皮质多,术中热量经髓腔内液体传导所致;同时也考虑与术中术者为降低肿瘤远期复发率而采用多点消融有关。提示临床实践中需注意体外、体内的不同。
射频、微波消融治疗骨样骨瘤能在保证肿瘤病灶完全灭活的基础上,最大程度的保留自体骨量。在杀灭肿瘤的同时,保存了患侧肢体的力学及生物学功能,使患者术后机体可充分利用灭活段骨质进行骨骼重建,不需要外科手术的植骨、内固定等处理。对于骨肿瘤的治疗,尤其是位置较深的骨肿瘤,其重要性得到了越来越多学者的重视,其安全性、有效性也得到了证实[12-13]。
本研究中,患者术后恢复良好,疼痛评分明显降低,夜间睡眠明显改善,无骨折、患肢功能障碍等严重并发症,治疗效果明显。外科手术治疗是整块切除瘤巢和硬化区,以及植骨、内固定等,由于手术创伤大,患者恢复较慢。而MWA治疗可以多点消融、增加消融时间,亦可达到较广的消融范围,且创伤小,患者恢复快,具有一定优势。
但MWA治疗也存在一定风险,如消融时的热辐射有损伤临近组织和皮肤的危险,术中需要注意预防。本组病例中,1例患者创口延迟愈合,考虑与胫骨前外侧皮肤等软组织覆盖少,术中皮肤保护不足有关。MWA治疗骨样骨瘤的不足之处主要为:(1)术中受骨质钻孔大小限制,且因骨组织坚硬,无软组织可牵拉、延展之特性;(2)病灶一般较小,部分病灶位于骨质髓腔内侧;(3)术中可取出的病灶组织少、标本量少,有时不足以做出明确的病理诊断,故存在误诊的可能。蔡郑东等[14]报道,术中在骨皮质钻孔后射频消融之前,使用骨活检针取病灶组织活检,其中病理证实为骨样骨瘤者38例,其阳性率为88.1%(37/42)。本研究中,虽然所有患者术前均由两位高年资影像医生诊断为骨样骨瘤,但术后仅有4例患者病理诊断为骨样骨瘤,其阳性率约为57.14%(4/7)。骨样骨瘤多发病于儿童、青少年,就显示骨质结构而言,CT检查优于MRI,故CT引导下行病灶消融术利于术中评估。由于CT引导下患者不可避免地会暴露在射线下,因此术中应尽量避免非治疗部位的投照暴露,做好相应防护,特别是敏感部位、敏感器官的防护,最大限度减少潜在辐射损伤。
综上所述,CT引导下经皮MWA治疗骨样骨瘤是安全、有效的方法,具有定位准确、损伤小、并发症少及术后恢复快等优点,其临床疗效良好,值得推广应用。
