基于咔唑供体的敏化染料的合成及其光电性质
2019-02-07翟发亮魏怀鑫刘娅静
翟发亮,侯 燕,张 强,魏怀鑫,刘娅静,黄 甜,赵 鑫
(1.苏州科技大学 化学生物与材料工程学院,江苏 苏州 215009;2.江苏省环境功能材料重点实验室,江苏 苏州 215009;3.绍兴中纺联检验技术服务有限公司,浙江 绍兴 312030)
1 引 言
染料敏化太阳能电池(DSSCs)具有成本低、制作工艺简单、性能稳定、摩尔吸光系数高和光电转化效率较高等优点受到研究者的青睐[1-3]。DSSC 通常由半导体纳米多孔膜,染料敏化剂,氧化还原电解质和对电极等组成[4]。其工作原理主要是通过染料敏化剂来吸收太阳光产生光电子,然后将产生的电子传输到半导体中。由此可知,染料敏化剂在DSSC 中的作用至关重要,研发新型高效的染料敏化剂是目前提高器件效率的最佳方式之一。经典的联吡啶钌N3染料制得的器件效率达到10%[5],而N719染料的器件效率达到有机类染料只有11.8%,显著得到提高[6]。目前金属卟啉类染料已取得很大进展,器件效率超13%[7],但由于金属卟啉类染料具有大的平面结构,容易使染料分子在半导体TiO2表面产生聚集,降低光电转化效率,因此,这类染料的发展受到较大限制[8]。而纯有机类染料因其具有原料来源广泛、成本低廉、摩尔吸光系数较高、分子结构易于修饰调控等众多优点,成为应用前景非常广阔的一类染料敏化剂[9-11]。2014 年Kakiage等[12]合成的咔唑类染料ADEK 在钴类电解质中的转换效率超过12%,特别是获得较大的开路电压达1V,这在DSSC的发展史上是罕见的。经过进一步优化,将ADEK 与其他敏化剂进行共敏化作用,器件的效率达到14.3%[13]。因此,咔唑是一种优异的供体单元,在此基础上开发新型咔唑类敏化染料,并研究其构效关系,提高光电效率,具有重要意义。苯并噻二唑是低带隙单元,具有良好的电荷传输性能,将其作为共轭结构单元,与三苯胺、芴、咔唑等分子给体单元链接,可得到低带隙具有良好光伏性能的共轭化合物[14-15]。基于此,本研究使用供电子性能较强的咔唑为电子供体,氰基乙酸为端基电子受体,在受体与供体之间引入噻吩或苯并噻二唑-噻吩,设计合成了D-Aπ-A 结 构 的 染 料CVBTC 和D-π-A 结 构 的 染 料CVHTC。在结构表征的基础上,研究了染料CVBTC和CVHTC的构效关系、光物理性质、电化学性质和光伏性能。
2 实 验
2.1 主要试剂及仪器
咔唑、正溴己烷、N-溴代丁二酰亚胺、5-醛基-2-噻吩硼酸、联硼酸频那醇酯、Pd(dppf)Cl2和Pd(PPh3)4等为外购,其他相关药品均是分析纯。甲苯和四氢呋喃(THF)均需经过干燥蒸馏除水。N,N-二甲基甲酰胺(DMF)则是通过Na H 进行除水。5-[7-(4,4,5,5-四甲基-[1,3,2]二氧硼杂环戊烷-2-基)-苯并[1,2,5]噻二唑-4-基〕-噻吩-2-甲醛根据文献[16-17]的方法制备。
核磁使用AVANCE Ⅲ型核磁共振仪(400MHz,DMSO-d6为溶剂);紫外吸收光谱采用TU-1901型紫外-可见分光光度计(UV-Vis);光致发光光谱采用LS55荧光分光光度计;电化学测定采用RST 3100型电化学工作站。工作电极、对电极及参比电极分别是金属铂电极、铂片和Ag/AgCl电极,DMF 为溶剂,浓度为0.1 mol/L的四丁基六氟磷酸铵为电解质,扫描速度为100 m V/s。
2.2 有机染料敏化剂的合成
有机染料敏化剂CVBTP、CVTP 的合成路线如图式1所示。
2.2.1 中间体5-(7-溴-苯并[1,2,5]噻二唑-4-基)-噻吩-2-甲醛(M1)的合成 在100m L 的三口瓶中加入4,7-二溴-2,1,3-苯并噻二唑(0.59g,2mmol),5-醛基-2-噻吩硼酸(0.15g,1mmol),24m L THF,6m L 2M K2CO3水溶液,超声震荡3min后,在Ar保护下,加入Pd(pph3)4(0.05g,0.05mmol),70℃下反应27h。反应完毕后,将该混合物倒入装有100m L蒸馏水的烧杯中,用20m L的二氯甲烷溶剂萃取三次,有机相经饱和NaCl溶液洗涤,无水MgSO4除水后,常压蒸馏去除有机相。残余物以石油醚和二氯甲烷(v/v=1/1)为洗脱剂,用硅胶柱色谱法分离提纯,真空干燥后得到黄色固体0.08g,产率:25%。1H NMR(CDCl3,400MHz)δ:10.01(s,1 H),8.22(d,1H),7.95(d,1 H),7.88(t,2H)。
2.2.2 中间体5-[7-(4,4,5,5-四甲基-[1,3,2]二氧硼杂环戊烷-2-基)-苯并[1,2,5]噻二唑-4-基]-噻吩-2-甲醛(M2)的合成 在100m L的三口瓶中加入中间体M1(0.71g,2.2mmol),联硼酸频那醇酯(0.51g,2.0mmol),1,4-二氧六环25m L,CH3COOK(0.98g,10mmol),超声震荡3min后,在Ar保护下,加入催化剂[1,1'-双(二苯基膦基)二茂铁]二氯化钯Pd Cl2(dppf)(0.07g,0.1mmol),70℃下反应,36h。反应结束,降至室温,旋蒸除去有机相。残余物以石油醚、乙酸乙酯和二氯甲烷(v/v/v=4/1/2)为洗脱剂,用硅胶柱色谱法分离提纯,真空干燥后得到橙黄色固体0.25g,产率:42.73%。1H NMR (CDCl3,400MHz)δ:10.01(s,1 H),8.20(d,1 H),7.95(d,1 H),7.87(t,2 H),7.76(s,1H),1.25~1.28(m,12H)。
2.2.3 中间体9-己基咔唑(M3)的合成 在100m L三口瓶中加入咔唑(1.67g,10.0mmol),20m L DMSO,研磨过的KOH(2.81g,50.0mmol),室温搅拌40min后,缓慢滴加正溴己烷(2.06g,12.5mmol)于混合物中,滴加结束,常温搅拌12h。反应结束后,将混合液倒入装有100m L 蒸馏水的烧杯中,静置,用稀盐酸调节p H 值至7左右,用20m L 的二氯甲烷溶剂萃取三次,有机相经过饱和NaCl溶液洗涤,以及无水MgSO4除水后,常压蒸除有机相,残余物以石油醚和二氯甲烷(v/v=5/1)为洗脱剂,用硅胶柱色谱法分离提纯,真空干燥后得到无色液体2.38g,产率:94.57%。1H NMR(CDCl3,400MHz)δ:8.14(d,2H),7.42~7.53(m,4H),7.22~7.30(m,2H),4.33(t,2H),1.85~1.96(m,2H),1.39~1.50(m,2 H),1.28~1.38(m,4 H),0.90(t,3 H)。
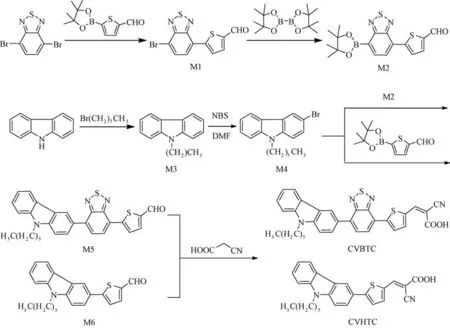
图式1 染料敏化剂CVBTC、CVHTC的合成路线Scheme 1 Synthetic routes of dye sensitizer CVBTC and CVHTC
2.2.4 中间体3-溴-9-己基咔唑(M4)的合成 将化合物M3(1.26g,5mmol)溶于15m L DMF 中,倒入50m L单口瓶中,在0℃避光条件下搅拌30min,后缓慢滴加NBS(1.06g,6mmol)的5m L DMF 溶液,0℃、避光条件下反应12h。反应完毕后,将混合物倒入装有200m L蒸馏水的烧杯中,静置,用稀盐酸调节p H值至7左右,析出白色晶体,抽滤,以无水乙醇进行打浆,过滤后得到白色晶体1.52g,产率:92.14%。1H NMR(CDCl3,400MHz)δ:8.21(d,1H),8.04(d,1H),7.49~7.56(m,2H),7.39(d,1H),7.23~7.28(m,2H),4.21(t,2H),1.79~1.86(m,2H),1.27~1.36(m,6 H),0.89(t,3 H)。
2.2.5 中间体5-[7-(9-己基咔唑-3-基)-苯并[1,2,5]噻二唑-4-基]-噻吩-2-甲醛(M5)的合成 在100m L三口瓶中加入化合物M4(0.73g,2.2mmol),化合物
M2(0.57g,2mmol),24m L THF,6m L 2 M K2CO3
水溶液,超声震荡3min 后,在Ar保护下,加入Pd(pph3)4(0.1g,0.1mmol),70℃下反应27h。反应完毕后,将反应混合物倒入100m L 的蒸馏水中,用20m L的二氯甲烷萃取三次,有机相经过饱和NaCl溶液洗涤多次,无水MgSO4干燥,常压蒸馏除去二氯甲烷后,残余物以石油醚和二氯甲烷(v/v=1/1)为洗脱剂,用硅胶柱色谱法分离提纯,真空干燥后得到红色固体0.67g,产率:67.68%。1H NMR(CDCl3,400MHz)δ:9.83(s,1H),7.70~7.82(m,2 H),7.46~7.50(m,1 H),0.79~0.86(m,6H),1.60~1.72(m,3H),1.95~2.15(m,2H),3.88(t,2H),6.93~7.04(m,4 H),7.11~7.24(m,3 H),7.33(d,1 H)。
2.2.6 目标产物2-氰基-3-{5-[7-(9-己基-咔唑-3-基)-苯并[1,2,5]噻二唑-4-基]-噻吩-2-基}-丙烯酸(CVBTC)的合成 在100m L三口瓶中加入化合物M5(0.49g,1mmol),氰基乙酸(0.85g,10mmol),6m L CHCl3,Ar保护,常温搅拌10min,后缓慢滴加哌啶(1.19g,14mmol)的3m L CHCl3溶液,65℃保温12h。反应结束,减压蒸除有机相,后加入50m L 2 M 的HCl水溶液,抽滤,残余物以甲醇、乙酸乙酯和二氯甲烷(v/v/v=4/1/3)为洗脱剂,用硅胶柱色谱法分离提纯,真空干燥后得到红褐色晶体0.48g,产率:85.23%。1H NMR(CDCl3,400MHz)δ:8.51(s,1H),8.12~8.20(m,2H),7.76~7.87(m,2H),7.38~7.51(m,4 H),7.21~7.29(m,2 H),4.31(t,2 H),1.78~1.97(m,2H),1.37~1.50(m,2H),1.26~1.37(m,4H),0.81~0.98(m,3H)。13C NMR(100Hz,CDCl3)δ:164.32,155.08,151.36,147.54,146.78,141.87,139.48,138.69,134.84,133.98,130.76,129.12,126.12,125.22,124.31,119.50,117.83,117.16,112.06,98.04,55.37,44.15,28.61,26.30,25.68,22.69。Anal.Calcd for C32H26N2O2S2(%):C,68.48;H,4.63;N,9.90;S,11.33。Found:C,68.50;H,4.64;N,9.91;S,11.32。
2.2.7 中间体5-(9-己基咔唑-3-基)噻吩-2-甲醛(M6)的合成 在100m L 三口瓶中加入化合物M4(0.79g,2.4mmol),5-醛 基-2-噻 吩 硼 酸(0.31g,2mmol),24m L THF,6m L 2 M K2CO3水溶液,超声震荡3min后,在Ar保护下,加入Pd(pph3)4(0.1g,0.1mmol),70℃下反应27h。反应完毕后,将反应混合物倒入100m L的去离子水中,用20m L的二氯甲烷溶剂萃取三次,有机相经饱和NaCl溶液洗涤,无水MgSO4干燥后,减压蒸馏除去二氯甲烷,残余物以石油醚和乙酸乙酯(v/v=4/1)为洗脱剂,用硅胶柱色谱法分离提纯,真空干燥后得到黄色固体0.30g,产率:41.78%。1H NMR(CDCl3,400MHz)δ:9.72(s,1 H),8.40~8.45(m,1 H),8.25~8.45(m,1 H),7.82~7.98(m,2H),7.73~7.76(m,1H),7.43~7.54(m,3 H),7.27~7.31(m,1H),4.38(t,2 H),1.85~2.00(m,2H),1.41~1.49(m,2H),1.31~1.38(m,4 H),0.84~0.89(m,3 H)。
2.2.8 目标产物2-氰基-3-[5-(9-己基咔唑--3-基)噻吩-2-基]-丙烯酸(CVHTC)的合成 在100m L 三口瓶中加入化合物M3(0.36g,1mmol),氰基乙酸(0.85g,10mmol),6m L CHCl3,Ar气氛保护,室温条件下搅拌10min,后缓慢滴加哌啶(1.19g,14mmol)的3m L CHCl3溶液,65℃下反应12h。反应完毕后,减压蒸馏除去CHCl3,后加入50m L 2 M 的HCl水溶液,抽滤,后依次经过二氯甲烷、去离子水、甲醇洗涤,得 到 红 色 固 体0.37g,产 率:85.23%。1H NMR(CDCl3,400MHz)δ:8.56(s,1H),8.11~8.23(m,2 H),7.76~7.83(m,2 H),7.38~7.51(m,4 H),7.25~7.32(m,2H),4.33(t,2H),1.71~1.97(m,2 H),1.38~1.52(m,2 H),1.29~1.38(m,4 H),0.79(t,3H)。13C NMR(100Hz,CDCl3)δ:162.18,146.93,140.09,139.24,132.45,129.07,128.32,127.19,125.22,124.07,123.54,121.01,118.73,109.53,108.24,107.15,55.03,37.96, 35.01,31.24,23.93,13.72.Anal.Calcd for C26H24N2O2S(%):C,72.87;H,5.64;N,6.53;S,5.38。Found:C,72.86;H,5.65;N,6.52;S,5.37。
2.3 敏化太阳能电池的制备与检测
双层TiO2纳米粒子膜作为光电极,在FTO 玻璃的四周通过贴胶布的方式来调节介孔TiO2薄膜的厚度。首先在导电玻璃FTO 上印刷一层10μm 厚,粒径为20nm 的TiO2,125℃下干燥5min,然后再涂上一层5μm 厚的200nm 光散射锐钛矿粒子,得到的TiO2薄膜在500℃下煅烧15min,冷却至80℃后,室温下浸入5×10-4mol·L-1的染料乙醇溶液中16h。染料敏化TiO2电极经无水乙醇洗涤后,用N2吹干。Pt对电极的准备,将两滴5×10-4mol·L-1的H2PtCl6乙醇溶液滴加到FTO 玻璃衬底上,然后400℃下干燥退火15min。随后将电解质溶液注进电池夹层,最后对电极的小孔利用Surlyn胶进行密封。组装好的电池以孔径为0.1cm2的锡箔纸遮挡,在标准AM1.5模拟太阳光下(100 m W·cm-2),使用Keithley 2602系统测得电流-电压(J-V)特性曲线。
3 结果与讨论
3.1 紫外-可见吸收光谱
分别将CVBTC和CVHTC 配成浓度为1×10-6M 的DMF溶液,测定它们的紫外吸收光谱,如图1所示,所对应的数据列于表1 中。从图1(a)可见,CVBTC在300~650nm 范围内有三个吸收带,最大吸收峰分别位于318、420和548nm 处,548nm 处的应归属其D-A-π-A 结构的分子内电荷转移(ICT)吸收;CVHTC在300~500nm 范围内只有一个吸收带,最大吸收峰为390nm。从图可知,苯并噻二唑的引入增大了其共轭体系,带隙变窄,增大了CVBTC的光谱吸收范围,这有利于器件获得较高的短路电流。计算得到CVBTC和CVHTC 的最大摩尔吸光系数分别为1.39×104和1.48×104M-1·cm-1。表明CVBTC 和CVHTC在溶液中均具有较强的光吸收能力。
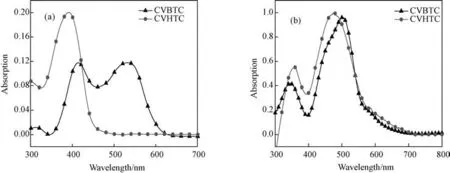
图1 化合物CVBTC、CVHTC的紫外吸收光谱 (a)DMF溶液(1×10-6 M);(b)薄膜状态Fig.1 Absorption spectra of CVBTC and CVHTC in diluted DMF solutions(a)and on TiO2 thin-films(b)

表1 染料敏化剂的光物理和电化学性质Table 1 Photophysical and electrochemical properties of dye-sensitizers
固体薄膜状态下的敏化染料,染料分子的聚集状态对紫外-可见光的吸收有显著影响[18],所以,为了对两种染料在薄膜状态下的吸光性能做进一步研究,测试了两种染料的薄膜紫外光谱,见图1(b)。相对于溶液状态,薄膜状态下染料CVBTC 和CVHTC 的吸收光谱的最大变化是带边均发生显著红移,分别红移约70和240nm,CVBTC和CVHTC 的吸收带边均达到约700nm。这与染料分子薄膜状态能够发生J-聚集有关[19],CVBTC和CVHTC 突出的光吸收能力决定了其优异的光伏性能。值得注意的是CVHTC 红移程度远大于CVBTC,这可能是由于CVHTC 是D-π-A 结构,且分子链较短,因而分子极性更强,在固体薄膜状态发生J-聚集的程度更大所致。
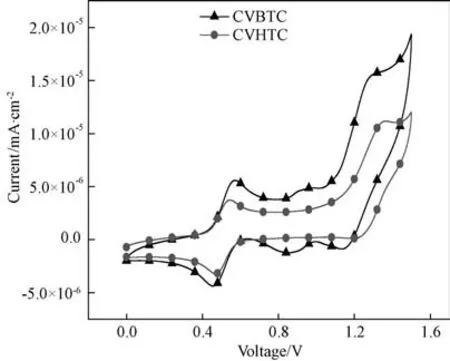
图2 染料CVBTC、CVHTC的循环伏安曲线Fig.2 Cyclic voltammograms of organic dyes CVBTC and CVHTC
3.2 电化学分析
采用循环伏安法(CV)测试电子注入和染料再生性能。工作电极为Pt电极,对电极为Pt片,DMF 为溶剂,浓度为0.1 mol/L 的四丁基六氟磷酸铵为电解质,Ag/AgCl电极为参比电极,以二茂铁(Fc/Fc+)为内标来测试,得到的结果如图2所示。
从图可见,染料CVBTC 和CVHTC 的氧化起始电位分别为0.84V 和1.12V,二茂铁的真空能级为-4.8eV,根据公式EHOMO=-e{EOX+[4.8-E(Fc/Fc+)]}V 可得到分子的HOMO 轨道能级[20]。其中,EOX指染料分子参照于银电极的第一氧化峰的起始电位值,E(Fc/Fc+)为二茂铁参照于银电极的起始氧化电势,实验测得E(Fc/Fc+)= +0.44V。LUMO 能级则是由HOMO 能级与其紫外吸收带边计算出的光学带隙值获得,即ELUMO=(EHOMO+Eopt)eV。相应计算结果及氧化还原参数值列于表1中。CVBTC 和CVHTC 的HOMO 能级分别为-5.24和-5.52e V,相对于电解液中I-/I3-的氧化还原电位(-4.60e V vs vacuum)[21]足够低,说明染料分子能够利用氧化还原电对I-/I3-将氧化态分子还原,进而完成染料再生。CVBTC和CVHTC的LUMO 能级分别为-3.10和-2.88eV,均高于TiO2导带能级(-4.40eV vs vacuum),可满足电子从激发态染料顺利注入到TiO2导带能级上的热力学驱动要求。所以,CVBTC 和CVHTC均具有匹配的HOMO 和LUMO 能级,这表明CVBTC 和CVHTC 均能够作为光敏化染料。在D-π-A 结构中,分子的供体与π桥是影响HOMO 能级的主要因素,而分子的π桥和受体是影响其LUMO能级的主要因素;在D-A-π-A 结构中,则是由供体和附加受体决定HOMO能级,同时附加受体、π桥以及受体决定了LUMO 能级,故而,改变附加受体不但能影响HOMO能级,同时还能调节LUMO 能级[22]。本试验中附加受体苯并噻二唑的引入降低了CVBTC 的LUMO 能级,同时还提高了CVBTC的HOMO 能级,使CVBTC的光学带隙远小于CVHTC,这与两者在溶液中的吸光性能相吻合。但CVBTC的LUMO 能级与TiO2导带的能级差小于CVHTC与TiO2导带的能级差,表明染料CVHTC向纳米TiO2导带注入电子的能力强于CVBTC。这也意味着以染料CVHTC组装的光电池会获得更大的开路电压[23-24],这于之后的电池性能测试(见表2和图3)结果相一致。
3.3 光电转化效率

图3 电池器件的电流-电压(J-V)曲线Fig.3 Current-voltage curves(J-V)of devices
图3是在AM1.5 模拟太阳光(100 m W·m-2)照射下基于染料CVBTC和CVHTCDSSCs的光电流密度-光电压曲线(J-V),表2给出的是电池光伏数据(光电池未进行优化)。同时,为了对该电池的性能进行衡量,购得Z907敏化染料,并且在同一条件下制作光电池,测试光伏性能,得到的结果均列于表2。研究表明,具有D-A-π-A 结构的CVBTC与具有D-π-A 结构的CVHTC相比,CVHTC 具有更高的开路电压和更大的填充因子,而CVBTC具有较高的短路电流密度,且CVBTC 的光电转换效率(η=1.75%)明显高于CVBTP(η=1.12%)。可见苯并噻二唑的引入的确扩展了CVBTC的共轭体系,因而光学带隙变小,光吸收范围拓宽,光吸收能力增强,最终得到了相对较大的短路电流以及电池效率。但具有D-A-π-A 结构的CVBTC,却因苯并噻二唑的引入使电池的开路电压和填充因子小于具有D-π-A 结构的CVHTC,这可能是由于在CVBTC结构中,咔唑与苯并噻二唑构成D-A结构,且因苯并噻二唑的吸电子能力很强,使部分光电子集中在苯并噻二唑环,并发生光生载流子的复合,造成光电子不能有效地通过π 桥向链端的氰基乙酸传递,因而影响了光电子向光阳极纳米TiO2导带的注入所致。

表2 目标化合物CVBTC、CVHTC的光伏性能数据Table 2 Photovoltaic properties of CVBTC、CVHTC based devices
4 结 论
以咔唑作为供体,设计合成了具有D-A-π-A 结构的染料CVBTC 和D-π-A 结构的CVHTC。结果表明,所合成的两种染料均具有良好的吸光性能,但在染料CVHTC的D-π-A 结构链上插入受体苯并噻二唑单元,得到的具有D-A-π-A 结构的染料CVBTP的共轭体系变大,带隙变小,光吸收性能得到明显提升,但CVBTC的LUMO 能级与TiO2导带的能级差小于CVHTC与TiO2导带的能级差,表明染料CVHTC向纳米TiO2导带注入电子的能力强于CVBTC,因而导致染料CVBTC 光电池的开路电压低于染料CVHTC。CVBTC和CVHTC 的HOMO(-5.24和-5.52eV)和LUMO 能级(-3.20和-2.88e V),都能与常见电解质I-/I3-(-4.60eV vs vacuum)以及TiO2导带能级(-4.40e V vs vacuum)相匹配,均可用作DSSCs的敏化染料。基于CVBTC 和CVHTC 的DSSCs的光电转换效率分别为1.75%(短路电流为4.34m A·cm-2,开路电压为0.56 V,填充因子为71.61%)和1.12%(短路电流为2.52m A·cm-2,开路电压为0.6 V,填充因子为74.61%),具有D-A-π-A结构的CVBTP 的光电转换效率和短路电流相比于CVHTC得到明显提升。
