北虫草在鸡蛋内培养与制备研究
2019-02-06赵庆枫高巨董凤华丁壮陈鹏举
赵庆枫 高巨 董凤华 丁壮 陈鹏举

摘要:通过选育北虫草菌种,以0.1、0.3、0.5 mL接种在360日龄无公害鸡蛋尿囊腔和卵黄囊腔内,以喷雾干燥蛋虫草粉质量为指标,考察北虫草在鸡蛋内培养与制备的影响因素。结果表明,在尿囊腔内接种0.3 mL菌种培养18日龄时,菌丝体生长明显,蛋虫草粉质量显著增加。鸡蛋是较好的具备多种营养元素的单一培养基,接种北虫草菌种成功培育蛋虫草,突破真菌微生物在液体、固体培养基的生长模式,简单易行、周期短、产量高,为工业化生产北虫草提供了新的思路和方法。
关键词:北虫草菌种;培养基;尿囊腔;虫草菌丝体;蛋虫草
中图分类号:S831 文献标识码:A 文章编号:1007-273X(2019)12-0010-04
随着畜禽传染病的混合感染、慢性病、免疫抑制性和肿瘤性疾病的发生,免疫增强剂成为临床应用医学领域最活跃的研究之一[1]。北冬虫夏草又名北虫草、蛹虫草,与冬虫夏草的有效成分、营养价值和药理作用相似[2,3],具有调节体液免疫和细胞免疫、抗肿瘤、保肝护肾等作用,将其作为免疫增强剂的研究越来越多[4-6]。鸡蛋内含有大量的营养元素,理论上能满足北虫草菌生长需求[7,8],适合工厂化、规模化生产。
试验通过优化固态和液体培养基,选育北虫草菌种,按照一定剂量将北虫草菌种分别接种在无公害鸡蛋尿囊腔和卵黄囊腔内,在温度、湿度、暗环境下培养一定时期后,根据接种剂量、部位和时间喷雾干燥蛋虫草,以蛋虫草粉重量为考察指标,研究北虫草菌种在鸡蛋内生长发育最优条件,确立合适的培养、制备条件,为工业化生产北虫草提供技术依据和参考。
1 材料与方法
1.1 材料
北虫草菌种来源于河北省科学院微生物研究所食用菌研究室,360日龄无公害鸡蛋由商水县为农养殖专业合作社提供。
1.2 试剂与仪器
高锰酸钾、葡萄糖、KH2PO4、MgSO4、琼脂、蛋白胨、β-环状糊精[9]等均为分析纯,75%乙醇,液体石蜡。
LDZH-100KBS型立式压力蒸汽灭菌器(上海申安医疗器械厂),PV-30/70型超净工作台(荣事达有限公司),SPX-100B-Z型生化培养箱(上海博讯实业有限公司医疗设备厂),SY-6000型小型喷雾干燥仪(上海世远生物设备工程公司)。
1.3 方法
1.3.1 固体及液体培养基配伍 前期经多次配伍试验,优化固体培养基[10,11]为土豆200.0 g、葡萄糖20.0 g、KH2PO4 2.5 g、MgSO4 1.5 g、琼脂20.0 g,补水至1 000 mL,pH为7.0。液体培养基为葡萄糖20.0 g、琼脂20.0 g、蛋白胨10.0 g、KH2PO4 3.0 g、MgSO4 1.5 g,超纯水1 000 mL,pH为7.0。
1.3.2 菌种筛选、复壮与保存 将北虫草菌种在固体培养基斜面上划线,28 ℃培养箱内培养7 d,得到活化的北虫草菌种,重新选择、挑取菌落块接种在固体培养基上,28 ℃培养箱内继续培养7 d,然后挑取菌落块于液体培养基中,三角瓶装液量为300 mL/L,28 ℃、150 r/min培养7~10 d,得到活化的北虫草种子液[12]。
1.3.3 无公害鸡蛋选择 选择同一批360日龄蛋鸡,饲养管理条件相同,鸡蛋收集前15 d鸡群未饲喂药物,环境、饲料、饮水、防疫措施等均符合无公害鸡蛋标准,随机采集180枚鸡蛋。
1.3.4 消毒 鸡蛋表面用无菌纱布擦拭后放入0.1%的高锰酸钾清洗1 min,再用75%乙醇消毒后备用。
1.3.5 接种 鸡蛋打孔后,用1 mL无菌针在尿囊腔和卵黄囊腔内接种北虫草菌种低剂量(0.1 mL)、中剂量(0.3 mL)各2组,在卵黄囊腔内接种高剂量(0.5 mL)菌种1组,对照组鸡蛋不接种菌种,每组30枚鸡蛋。
1.3.6 培养 参考北虫草对生长环境的要求[13,14],鸡蛋尿囊腔或卵黄囊腔内接种前3 d在20 ℃、湿度60%的恒温培养箱光照环境下培养,后3 d在23 ℃、湿度70%恒温培养箱内暗环境下培养。
1.3.7 喷雾干燥 于鸡蛋气室处破壳剥离蛋壳,在培养6、12、18、24日龄时,各取样品50 mL,加入超纯水、粉碎均质后采用4层纱布过滤,根据前期试验优化的工艺标准:进风温度150 ℃、进样量300 mL/h、空氣流量600 L/h、干燥剂比例4%进行喷雾干燥[15-17]、称重,观察试验结果。
1.4 数据处理
试验数据采用SPSS 24.0进行单因素方差分析,各组间数据的平均值采用邓氏多重比较进行差异显著性检验,测定结果以“平均值±标准误”表示,P<0.05表示差异显著。
2 结果与分析
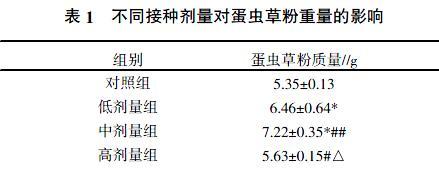
2.1 北虫草菌种接种剂量对蛋虫草粉质量的影响
低、中剂量组喷雾干燥的蛋虫草粉质量比对照组增20.75%、34.95%,差异显著(P<0.05);高剂量组喷雾干燥的蛋虫草粉质量比对照组增加5.23%,差异不显著(P>0.05)。中剂量组比低剂量组增加11.76%,差异极显著(P<0.01)。高剂量组比对照组增加5.23%,差异不显著(P>0.05),比低剂量组减少14.74%,差异显著(P<0.05),比中剂量组减少28.24%,差异显著(P<0.05)(表1)。
2.2 鸡蛋接种部位对蛋虫草粉质量的影响
尿囊腔、卵黄囊腔喷雾干燥的蛋虫草粉质量比对照组增加34.76%、15.70%,差异显著(P<0.05)。卵黄囊腔比尿囊腔喷雾干燥的蛋虫草粉质量减少16.47%,差异显著(P<0.05)(表2)。
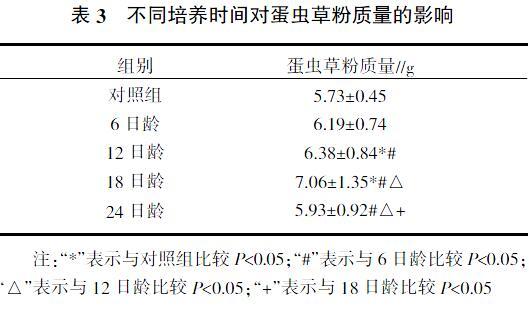
2.3 接种培养时间对蛋虫草粉质量的影响
6日龄喷雾干燥的蛋虫草粉质量比对照组增加8.03%,差异不显著(P>0.05)。12日龄喷雾干燥的蛋虫草粉质量比对照组增加11.34%,差异显著(P<0.05),比6日龄增加3.07%,差异显著(P<0.05)。18日龄喷雾干燥的蛋虫草粉质量比对照组增加23.21%,差异显著(P<0.05);比6日龄增加14.05%,差异显著(P<0.05);比12日龄增加10.66%,差异显著(P<0.05)。24日龄喷雾干燥的蛋虫草粉质量比对照组增加3.49%,差异不显著(P>0.05);比6日龄减少4.38%,差异显著(P<0.05);比12日龄减少7.59%,差异显著(P>0.05);比18日龄减少19.06%,差异显著(P<0.05)(表3)。
3 讨论
3.1 接种剂量对蛋虫草发酵培养的影响
王蓉等[18]研究人工培养北虫草的接种菌种量为2.5~5.0 mL,但在鸡蛋内接种北虫草菌种的研究目前还未见报道。本研究结果表明,在鸡蛋内接种低剂量北虫草菌种,蛋壳膜增厚,鸡蛋内菌丝体生长发育良好,蛋虫草粉质量比普通鸡蛋明显增加,成功培育出蛋虫草,鸡蛋内的氮源、碳源能满足北虫草菌种的生长发育,突破真菌微生物在液体、固体培养基的生长模式。尤其接种中剂量北虫草菌种时,菌丝和蛋壳膜形成一体,菌丝体比低剂量北虫草菌种生长发育更好,蛋虫草粉质量极显著增加,证明鸡蛋内的营养能满足一定剂量菌种的正常生长发育。但当接种剂量过大时,蛋壳膜表现不明显,菌丝体生长发育受阻,蛋虫草粉质量比低剂量、中剂量明显减少,说明鸡蛋内的营养物质数量有限,不能满足足量的菌种生长发育,以接种中剂量时(0.3 mL)生长发育良好(表4、图1、图2)。
3.2 接种部位对蛋虫草发酵培养的影响
接种部位对蛋虫草发酵培养的影响结果和方华舟等[19]研究一致,在北虫草菌种培养中加鸡蛋为外源氮源效果良好,试验和对照组鸡蛋相比较,无论接种在尿囊腔或者卵黄囊腔内,菌丝体在蛋壳膜上生长,蛋壳膜逐渐增厚,蛋壳内环境发生不同程度的改变,北虫草菌种均能生长发育,但以接种在尿囊腔内的菌丝体变化明显,喷雾干燥的蛋虫草粉质量增加显著(表4、图3和图4)。
3.3 培养日龄对蛋虫草发酵培养的影响
通过观察在鸡蛋内接种3日龄后,北虫草菌丝体开始生长发育,蛋壳膜和菌丝膜形成一體、蛋清营养物质吸收稀薄如水样、蛋黄颜色的改变以及喷雾干燥蛋虫草粉重量等综合比较,在试验前生长发育不明显,到12日龄生长发育明显,尤其12~18日龄时生长发育良好。但随着日龄的增加,鸡蛋内的营养物质被菌种消耗殆尽,24日龄和对照组、6日龄、12日龄之间差异不明显,应该是菌丝体逐渐出现自溶现象,与张杨等[20]研究关于北虫草接种时间对培养基的要求基本一致(表4、图5和图6)。
4 结论
北虫草天然资源数量很少,再加上大量采挖已日渐枯竭,传统人工培养基以大米、小麦、高粱、蚕蛹粉等为主,各营养成分有限,对培养条件要求苛刻、工艺复杂、周期长,而鸡蛋中含有丰富的蛋白质、脂肪、碳水化合物,能满足北虫草菌的营养需求,使之开发成具备多种营养的单一培养基质,接种后培养条件简单、周期短、方法简便,同时我国产蛋量大、价廉易得,因此将北虫草菌接种在鸡蛋内培养适合工业化批量生产。
通过试验将北虫草菌种接种在无公害鸡蛋内,以在尿囊腔内接种0.3 mL培养18日龄时,菌丝体变化明显、蛋壳膜和菌丝膜形成一体、蛋清营养物质吸收稀薄如水样,喷雾干燥蛋虫草粉质量增加显著,为北虫草培养新模式提供技术依据和理论基础,为研制北虫草提供新的思路和方法,为新型免疫增强剂的开发提供更多来源。
参考文献:
[1] 杨其莲,韩 冰,祁 红.免疫增强剂的处方使用调查及其合理性评价[J].中国临床药学杂志,2012,21(4):213-217.
[2] KIM H G,SONG H,YOON D H,et a1.Cordycepsproinosaex tractsinduceapo pmsis of HeLa cells by a caspase dependent pathway[J].J E thopharm a col,2010,128(2):342-351.
[3] 王林萍,余 意,冯成强.冬虫夏草活性成分及药理作用研究进展[J].中国中医药信息杂志,2014,21(7):132-136.
[4] 黎 炼.青藤碱诱导未成熟树突状细胞对肾移植大鼠CD4+CD5+调节性T细胞及Fox3表达的影响[D].湖南衡阳:南华大学,2015(1):3.
[5] 朱雅娟,樊丽超.脑脊液ADA和IL-23的测定对结核性脑膜炎的诊断价值[J].中国保健营养(中旬刊),2012(8):309.
[6] 齐 贺,黄竹清,郑剑玲,等.北虫草复合制剂对小鼠免疫功能的影响[J].微生物学杂志,2013,33(3):63-65.
[7] JIN C Y,KIM G Y,CHOI Y H.Induction of apoptosis by aqueousextract of cordyeepsm ilitaris through activation of caspases and inactivelion of Akt in hum an breast cancer MDA-MB-231 cells[J].J Microhiol Bioteehnol,2008,18(12):1997-2003.
[8] CABONI M F,BOSELLI E,MCSSIA M C,et al.Effect of processing and storage on the chemical quality markers of spray-dried whole egg[J].Food chemistry,2005,92(2):293-303.
[9] 廖才智.β-环糊精的应用研究进展[J].化工科技,2010,18(5):69-72.
[10] 赵 润,郭成金.冬虫夏草菌丝体液体培养基的优化[J].天津师范大学学报:自然科学版,2008,28(1):8-11.
[11] 程红艳,郭 伟,常明昌,等.蛹虫草菌丝体液体发酵培养条件的优化研究[J].山西农业大学学报:自然科学版,2011,31(1):66-72.
[12] 申 苗,常尚连.工厂化栽培北虫草高产稳产技术[J].食用菌,2017(1):42-44.
[13] 范志微.蛹虫草優良菌株的筛选及其营养特性的分析[D].哈尔滨:东北林业大学,2013.2-3.
[14] 钱雯婕,袁青锋,魏红英,等.北冬虫夏草人工栽培技术[J].现代农业科技,2015(14):74-75.
[15] 李 洁.正交优选柴芩退热颗粒喷雾干燥工艺[J].江西中医药大学学报,2017(4):63-64,120.
[16] 杨净尧,王仁广,王 畅,等.喷雾干燥研究进展[J].亚太传统医药,2018,14(9):97-99.
[17] 覃兴奇,王熙珍,叶善洋,等.中药配方颗粒猫爪草提取液喷雾干燥工艺的研究[J].药物资讯,2018,7(1):1-6.
[18] 王 蓉,董伟洁,李海薇,等.北虫草人工培养条件的研究[J].安徽农业科学,2014(25):8511-8512.
[19] 方华舟,贾 瑞,程利霞,等.不同培养基原料及配方对北冬虫夏草液体菌种质量的影响[J].贵州农业科学,2011,39(2):105-109.
[20] 张 杨,肖小君,张明月,等.蚕蛹虫草人工培养的关键技术[J].贵州农业科学,2016,44(7):65-68.
