二酪氨酸层赋予酵母孢子抗氧化活性
2019-02-06MUKAMAOmarLEOBemena王晓文高晓冬中西秀树
MUKAMA Omar,LEO Bemena,王晓文,高晓冬,中西秀树
(江南大学 生物工程学院,江苏 无锡 214122)
酿酒酵母的产孢过程是在碳源以及氮源匮乏等饥饿条件下引起的一个连续的过程。在此过程中,酿酒酵母营养细胞的细胞膜转化为孢子膜[1],最终在二倍体细胞中形成四个单倍体孢子。孢子壁由四层结构组成,从内到外依次为:甘露糖层、葡聚糖层、壳聚糖层和二酪氨酸层。相较于营养细胞,孢子可以有效抵抗外界的恶劣环境,该特性主要是由于壳聚糖层和二酪氨酸层的保护作用。孢子壁结构是由内到外依次合成,在壳聚糖层形成后,二酪氨酸层才开始合成[2]。二酪氨酸层主要是由酵母细胞质中两个L-酪氨酸交联形成的二肽(LL-二甲酰基-N,N’-二酪氨酸)为主体的结构,该形成过程分为两步:L-酪氨酸的N-甲酰化以及L-甲酰酪氨酸的二聚化[3]。这两个步骤分别由Dit1 和Dit2 两个蛋白调控完成[4]。随后,LL-二甲酰基-N,N’-二酪氨酸分子通过包括Dtr1 在内的多个转运蛋白协助下,运送到形成过程中的孢子壁上[5],且二酪氨酸层的组装机制目前尚不清楚。
氧化剂可以通过自由基的介导来催化反应,其氧化性会对生物大分子(核酸,蛋白质,糖类和脂类)造成伤害,因此,氧化剂在生物体内有很大的危害。H2O2作为氧化剂,进入细胞后,主要通过抑制ATP 的合成(GAPDH 失活)影响糖酵解途径,并且通过引起氧化应激影响线粒体的氧化磷酸化途径[6]。在过渡金属存在时,即使低浓度的H2O2(20~80 μmol/L)也可以影响烟酰胺腺嘌呤二核苷酸(NAD+)的活性,NAD+对于DNA 修复酶(多-ADP 核糖聚合酶)的活性是十分重要的。羟基自由基会造成不可逆的DNA 链断裂[2,7],以及碱基的羟基化。因此,氧化剂最终会造成细胞的损伤或者死亡。酚类化合物可以通过抑制自由基(如H2O2)与金属离子(如Fe2+)的螯合从而抑制氧化性。在该机制中,自由基夺走酚基的一个氢原子,而酚基可以从抗氧化剂上得到一个电子转变为自由基阳离子[8]。酵母孢子的二酪氨酸是一种酚类化合物.过去的研究显示,相较于营养细胞,酵母孢子对消化酶、乙醚处理、部分有机溶剂及高温等特殊条件具有抵抗能力[9]。本研究目的是研究孢子对外源活性氧的抵抗能力,以及通过酿酒酵母营养细胞合成NN′-二NN′甲酰基二酪氨酸并研究-二甲酰基二酪氨酸的抗氧化特性。
1 材料与方法
1.1 菌株与生长条件
除了另外标注的技术外,本文所提到的基因操作参考文献[10]。所用到的酵母菌株见表1,引物序列表2。
在克隆过程中,大肠杆菌在加入氨苄青霉素(100 μL/mL)的LB 培养基(1%酵母提取物,2%蛋白胨,2%NaCl)中培养。酵母营养细胞是在YPAD(1%酵母提取物,2%蛋白胨,2%葡萄糖,0.033%腺嘌呤)和/或去除某一或某几种特殊氨基酸的氨基酸混合物的完全培养基(营养缺陷型选择培养基)中培养。酵母产孢细胞的培养是在YPACe 培养基(1%酵母提取物,2%蛋白胨,2%乙酸钾)。
为了敲除DIT1,以pFA6a-HIS3MX6[11]为模板,以BLD1 和BLD2 为引物,通过PCR 技术扩增得到一条DNA 片段,将该片段分别融合进单倍体AN117-4B 和AN117-16D,然后将二者融合,得到dit1△二倍体菌株。
表1 本实验所用到的酿酒酵母菌株Table 1 S.cerevisiae strains used in this study

表2 本实验所用的引物Table 2 Primers used in this study
1.2 质粒
本文所用的质粒见表3。pRS424-GAL-DIT1,pRS426-GAL-DIT2 and pRS424-TEF-DTR1 三个质粒是按如下方法构建的。
首先,DIT1,DIT2 和DTR1三个基因是以AN120 酵母菌株的基因组DNA 为模板[12]分别用引物 HXO599 和 HXO600,HXO601 和 HXO602,HXO603 和HXO604 通过PCR 扩增的。得到的扩增片段用SpeI 和XhoI 进行切割,然后将其连接到以同样酶切位点切割的质粒pRS424-GAL,pRS426-GAL 或pRS425-TEF。用醋酸锂转化法将目的质粒转化到酵母YH499 菌株中进行表达[16]。所有构建的质粒均由基因测序确认(BGI,China,Beijing)。

表3 本实验所用到的质粒Table 3 Plasmids used in this study
1.3 酵母产孢
取单菌落在5 mL 的YPAD 中培养过夜,然后将1 mL 菌液转接到200 mL 的YPA 培养基中培养24 h。离心(5 600 g,30 s)收集细胞,并用去离子水洗,然后将其转移到2%的醋酸钾培养24 h。产孢后,离心(5 600 g,30 s)收集孢子,并用6 mol/L NaCl 溶液洗涤2 次。
1.4 点板实验
氧化剂的处理实验是根据文献[17]稍作调整后进行的。当细胞生长到稳定期后,收集菌体处理到105cells/mL,用1 μL 的氧化剂(2 mmol/L FeSO4/2 mmol/L H2O2或者2 mmol/L FeCl3/2 mmol/L H2O2)处理。混合液在30 ℃培养1 h,依次按梯度稀释10 倍后震荡混匀后分别取5 μL 点板到YPAD 培养基上,重复上述实验一次。同样的细胞用去离子水稀释100 倍,分别涂于两块相同的平板上,对生长的菌落计数,取两板的平均值。实验图片是用Image Quant LAS 4 000(GE Healthcare,USA)拍摄的。
1.5 LL-二甲酰基-N,N′-二酪氨酸生物合成
含有空载(对照)和质粒pRS424-GAL-DIT1,pRS426 -GAL -DIT2 和 pRS424 -TEF -DTR1 的YPH499 单菌落在含2%葡萄糖的SD 培养基上培养到指数期,离心(8 560 g,2 min)收集菌体,去离子水洗2 次,然后转入含有2%半乳糖的SD 培养基上培养48 h。培养后含有LL-二甲酰基-N,N′-二酪氨酸的培养基(4 mg/mL)将用于下一步的实验。
1.6 LL-二酪氨酸和LL-二甲酰基-N,N′-二酪氨酸的化学合成
LL-二酪氨酸和LL-二甲酰基-N,N′-二酪氨酸通过[18]所描述的用L-酪氨酸或者N-甲酰基-L-酪氨酸(Sigma-Aldrich)进行氧化反应从而合成。反应过程如下:2 mL 的Tris-HCl(0.3 mmol/L,pH 8.5),1.5 mL 的L-tyrosine 或者N-甲酰基-L-酪氨酸(2 mg/mL),0.1 mL 的过氧化氢(8.82×10-5mol/L),0.5 mL 的过氧化物酶(1 mg/mL,Sangon,Shanghai,China),混合,20 ℃培养1 h。然后进行LC-MS 分析,确认LL-二酪氨酸和LL-二甲酰基-N,N′-二酪氨酸是否合成。
1.7 二酪氨酸的高效液相色谱(HPLC)分析
该样品是用Discovery C18 柱(150 mm×4.6 mm ID,5 μm particles)(Sigma Aldrich,U.S.A)在Waters分离模块e2695 HPLCs 系统(Wexford,UK)进行分析。每组加入10 μL 样品。柱子经过含有100%CH3CN 的0.01 M 三氟乙酸梯度洗脱(0~50%的CH3CN,55 min。样品流速为1 mL/min,紫外荧光检测条件为:激发波长285 nm,发射波长425 nm。
1.8 抗氧化剂实验
DPPH 和ABTS 溶液被用来检测二甲酰基-二酪氨酸的自由基清除能力。DPPH 的用法是根据[19-20]中所描述的方法进行的。在99%甲醇溶液中,加入3.5 mL 的60 mol/L 的DPPH,然后分别加入10,20,50 μL 的含有培养基的LL-二甲酰基-N,N′-二酪氨酸,空质粒,单独的培养基和合成的LL-二甲酰基-N,N′-二酪氨酸。混合溶液在黑暗中室温培养20 min,然后在517 nm(吸光度)下用Ultrospec 2100 pro UV/Visible Spectrophotometer(GE healthcare,Fairfield,USA)读数。清除力的计算如下:

ABTS 工作溶液的制备过程是按照[21-22]中的描述。本实验中,在99%甲醇溶液中,加入3.5 mL 的60 mol/L 的ABTS,然后分别加入10,20,50 μL 的含有培养基的LL-二甲酰基-N,N′-二酪氨酸,空质粒,单独的培养基和合成的LL-二甲酰基-N,N′-二酪氨酸。混合溶液在黑暗中室温培养16 h,然后在734 nm(吸光度)下用Ultrospec 2100 pro UV/Visible Spectrophotometer(GE healthcare,Fairfield,USA)读数。
1.9 统计学分析
本研究至少做了3 次的独立实验,如±SE 所显示的。
2 结果与讨论
2.1 孢子的抗氧化性相对于营养细胞更强
为了测试孢子是否具有抗氧化能力,将营养细胞和孢子分别用2 mmol/L FeCl3/2 mmol/L H2O2或2 mmol/L FeSO4/2 mmol/L H2O2处理。通过氧化反应,FeCl3可以与H2O2反应并产生带超氧阴离子。Fe2+与H2O2反应产生羟基自由基。将细胞在该溶液中培养1 h 后在YPAD 上点板。如图1 所示,用FeCl3/H2O2或FeSO4/H2O2处理的孢子与未处理的孢子生长状况相似。然而,处理后的营养细胞的生存力显著降低。这些结果表明,与营养细胞相比,孢子具有抗氧化能力。

图1 营养细胞和孢子对氧化应激的敏感性Fig.1 Susceptibility of vegetative cells and spores toward oxidative stress
2.2 二酪氨酸层赋予孢子抗氧化能力
本研究评估了二酪氨酸层是否具有抗氧化性。由于DIT1 基因控制合成二酪氨酸,其突变导致二酪氨酸层缺失。如图2(a)所示,dit1△突变株孢子对FeCl3/H2O2和FeSO4/H2O2比野生型孢子更敏感。
如图2(b)所示,经FeCl3/H2O2处理后,dit1△的孢子,野生型孢子和营养细胞的存活率分别降低到28.55%,60%和0,经过FeSO4/H2O2处理,dit1△的孢子,野生型孢子和营养细胞的存活率分别降低到37.43%,90.84%和0。该结果表面二酪氨酸层赋予孢子抗氧化的能力。
2.3 二甲酰基二酪氨酸能够分泌到培养基中
二酪氨酸层主要由二甲酰基二酪氨酸组成。本研究检测了二甲酰基二酪氨酸是否显示出抗氧化活性。为了获得大量的二甲酰基二酪氨酸,本研究采用生物法合成二甲酰基二酪氨酸。

图2 二酪氨酸层的缺失对细胞抗氧化性的影响Fig.2 Effect of the loss of the dityrosine layer on oxidative stress resistance
之前研究表明,即使在增殖期营养细胞中,二甲酰基二酪氨酸也可由DIT1,DIT2 和DTR1 三个基因控制合成的[3-5]。因此,分别构建了在GAL1 启动子下游含有DIT1,DIT2 及DTR1的质粒。在GAL1 启动子调控下,在含有葡萄糖的培养基中抑制基因表达,并通过含半乳糖的培养基来诱导基因表达。
转化构建得到的3 种质粒到酵母菌株YPH499中,挑取单个转化子在含有葡萄糖或半乳糖的培养基中培养48 h。离心除去细胞并将培养基浓缩10倍。二酪氨酸是一种荧光分子:激发波长为380 nm,发射波长为475 nm。在半乳糖培养基中,检测到强烈的二酪氨酸荧光信号。在葡萄糖培养基中,未检测到强烈的荧光信号。表达了空载体的培养基中,未检测到荧光信号。
为了进一步验证培养了表达Dit1,Dit2 和Dtr1细胞的培养基中含有二甲酰二酪氨酸,本实验进行了HPLC 验证。在表达Dit1,Dit2 和Dtr1 细胞用过的培养基中检测到二甲酰基二酪氨酸峰,但在含有空载体的细胞的培养基中没有检测到(图3)因此,实验用过的培养基中含有二甲酰基二酪氨酸。
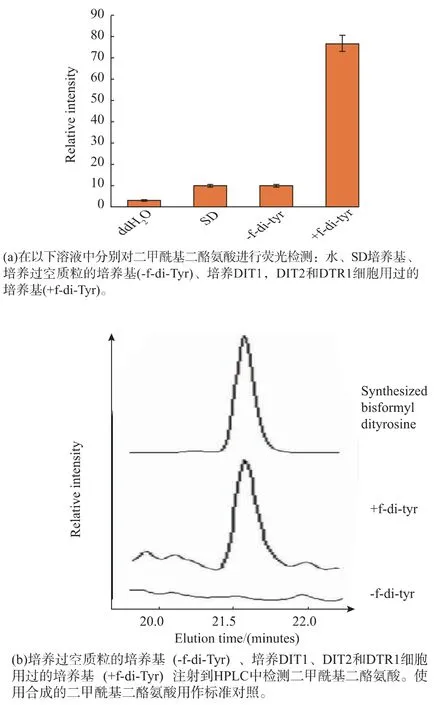
图3 在表达DIT1,DIT2 和DTR1 细胞用过的培养基中检测二甲酰基二酪氨酸Fig.3 Detection of bisformyl dityrosine in spent media cultured DIT1,DIT2,and DTR1 expressing cells
2.4 二甲酰基二酪氨酸具有抗氧化活性
通过使用DPPH 和ABTS 测定,本研究检测了二甲酰基二酪氨酸是否具有抗氧化活性。如图4 所示,两种方法测定显示含二甲酰基二酪氨酸的培养基具有抗氧化活性,而在表达了空载体的细胞培养基中没有观察到这种活性。

图4 二甲基二酪氨酸的抗氧化活性Fig.4 Antioxidant activity of bisformyl dityrosine
3 结语
孢子具有对外界环境的抵抗能力。本研究证实了孢子的抗氧化性比营养细胞更强。由于二酪氨酸层的存在,孢子展示出了部分的抗氧化性。根据实验结果,可证实二甲酰基二酪氨酸对强氧化剂有清除能力,因此具有抗氧化活性。在酿酒酵母中异源表达DIT1,DIT2 和DTR1 可证实二甲酰基二酪氨酸会分泌到培养基中,也可被用作抗氧化剂。因此,二甲酰基二酪氨酸的生产十分便捷。二甲酰基二酪氨酸和孢子未来可以被用作相关的抗氧化材料。
