酿酒酵母中PiggyBac 转座子筛选系统的构建
2019-02-06周林希柳艺石赵神保张慧杰高晓冬藤田盛久
周林希,柳艺石,赵神保,张慧杰,高晓冬,藤田盛久
(江南大学 生物工程学院,江苏 无锡 214122)
酿酒酵母(Saccharomyces cerevisiae)是一种可用于研究真核细胞系统中蛋白分泌和膜运输的模式生物[1]。酿酒酵母具有稳定维持单倍体形态的优点,可以利用这一特性对酵母菌株进行正向和反向的遗传学分析。正向基因筛选经常使用化学诱变或者物理诱变来获取突变株,比如甲基磺酸乙酯和紫外诱变等[2-3]。鉴定导致突变的相关基因时需要表达质粒回补或者定位克隆,这些方法耗时长并且操作困难[4]。与传统诱变方法相比,插入型诱变更具有优势。插入型诱变通过将一段DNA 插入基因,达到破坏基因功能的目的。引发突变的DNA 模块上含有通用序列,可以用这个序列来检测插入位点[5],因此插入诱变能够根据已知序列较容易地分析导致突变的相关基因。目前已有研究在酿酒酵母中使用基于转座子的酵母突变基因组文库进行基因筛选[6]。在这个系统中,转座子在大肠杆菌中通过转座酶被插入含有酵母基因组的质粒文库中。随后将突变的质粒文库转入酵母并替换染色体上的等位基因,由此引起突变[7]。尽管这一方法适用于在酵母体内进行遗传筛选,但仍然存在一些问题,比如整合效率低,筛选覆盖范围有限以及突变文库的保存比较困难。相比之下在酵母细胞内使用转座子进行突变比转座子文库更高效。酵母本身有一种内源性的反转录转座子Ty1 可以高效地进行转座,使用这种转座子进行插入型诱变的方法被称为遗传足迹法[8]。在这个系统中,大量的Ty1 转座子在整个基因组范围内进行插入突变。可以通过比较转座子插入前后,细胞的生长状况,来分析一些特殊的基因是否是细胞生长所必须的[9]。但是这个系统也存在一些缺陷,比如由于大量的Ty1 转座子同时进行插入突变,很难在全基因组范围内对于突变位点进行精确的分析[8]。其他类型的转座子如来源于鲑鱼基因组的Sleeping Beauty(SB)转座子,从初始位点移除并再插入其它位点后会在原始插入位点留下痕迹[10-12],所以大多数的转座子都不适用于在酵母体内进行突变。
PiggyBac(PB)转座子最初来源于鳞翅目昆虫粉纹夜蛾(Trichoplusia ni)[13-14]。PB 转座子通过一种“剪切和粘贴”机制进行基因转座[15]。在PB 转座酶(PBase)的作用下,PB 转座子从宿主DNA 位点被精准地移除,并且这种移除不会留下任何痕迹[14-15]。同时被移除的PB 转座子重新插入其他基因序列中的TTAA 位点。与其他转座子方法相比,PB 转座子系统效率更高,并且PB 在基因组中的插入位点分布比较均匀[16]。因此PB 转座子可以作为一种筛选工具应用于许多生物物种,包括原生动物,裂殖酵母,植物细胞,昆虫和脊椎动物[17-18]。
本文在酿酒酵母中使用PB 转座子构建了一个筛选系统。本研究将3′PB-TEFp-HIS3-5′PB 转座子插入酵母ADE2 基因编码框中,PBase 基因则由另一个游离型质粒上的半乳糖启动子调控表达。在PB转座酶的作用下,PB 转座子可以从原始位点无痕移除并随机插入新的基因位点。PB 转座子在转座过程中保持单一拷贝数,在每个突变细胞中只有一个插入位点。使用限制性内切酶酶切降解基因组,连接接头并进行聚合酶链式反应(PCR)扩增,测序比对序列可快速检测到PB 插入位点。通过对PB 系统的转座效率进行检测,结果表明PB 转座子系统能很好地应用于酿酒酵母菌株中,并可利用这一转座工具进行目的基因的筛选。
1 材料与方法
1.1 质粒和酵母菌株
本文中所用到的质粒如表1 所示。使用YW1和YW2 引物从pCMV-hyPBase 质粒扩增PBase 片段,将片段通过EcoR I 和Xho I 酶切位点插入pRS316-GAL1p 质粒,得到质粒pRS316-GAL1p-PBase。使用YW5 和YW6 引物从pFA6a-HIS3MX6质粒扩增TEFp-HIS3 片段,将片段通过Nhe I 和Spe I 酶切位点插入pPB-R1R2-NP 质粒,得到质粒pPB-TEFp-HIS3。
陈、庄二人诗歌高下之别的争论发轫于二人诗歌特点尤其是庄昶诗歌用字特点的评论。成化二年(1466),陈献章复游太学,与庄昶订交并在诗学宗趣等方面开始趋于一致。二人对彼此诗歌特点互有点评,在给弟子讲授诗法时,陈献章常以庄昶诗歌为范,如批复弟子张诩诗歌时说:“概观所论,多只从意上求,语句、声调、体格尚欠工夫在。若论诗家,一齐要到。庄定山所以不可及者,用句、用字、用律极费工夫。”[6]《批答张廷实诗笺》,75送别童子方祥庆时称赞庄昶之诗,说自己“千炼不如庄定山”[6]《夜坐与童子方祥庆话别偶成》,546。陈献章诗歌的特色,庄昶概括为“自然”,其《读白沙先生诗集》云:
本文中所用酿酒酵母出发菌株为MATa his3Δ1 leu2Δ0 met15Δ0 ura3Δ0 BY4741,购买于Addgene。使用YW3 和YW4 引物从质粒pPB-TEFp-HIS3 上扩增3′PB-TEFp-HIS3-5′PB 片段。通过同源重组[19],将3′PB-TEFp-HIS3-5′PB 转 座 子 插 入 酿 酒 酵 母ADE2 基因编码框,得到实验菌株MATa his3Δ1 leu2Δ0 met15Δ0 ura3Δ0 ade2::PB-HIS3 suc2Δ::hphMX BY4741。
2)酵母基本培养基:SD(0.67%无氨基酵母氮源,2%葡萄糖以及需要的氨基酸),SG(0.67%无氨基酵母氮源,2%半乳糖以及需要的氨基酸)。

表2 本研究所用引物Table 2 Primers used in this study
1.2 细胞培养
1)酵母完全培养基:YPAD(1%酵母提取物,2%蛋白胨,0.003%腺嘌呤,2%葡萄糖)。
患者进入高灌注和高滤过期通常在5年左右,40%~50%的患者在病程5~10年进入运动后微量蛋白尿的阶段,糖尿病10~15年进入持续微量蛋白尿阶段,在病程15~25年时又有一半的患者进入临床蛋白尿期,然后逐步发展至终末期肾病。1型糖尿病发病时间相对明确,诊断5年后进入每年的筛查,每年至少检测微量蛋白尿。2型糖尿病起病相对隐匿,病程不明确,诊断之后就进入每年的定期筛查。
学生是教育的主体,儿童是小学教育的主要参与者,战时知识分子对儿童的成长也提出了种种建议,以使小学教育更好地适应抗战建国的需要。
研究中所用引物如表2 所示。
将质粒pRS316-GAL1p-PBase 转入实验菌株BY4741-ade2::PB-HIS3-suc2Δ::hphMX,得到筛选菌株。在尿嘧啶缺陷型葡萄糖选择性培养基(SDUra)中接种筛选菌株,过夜培养。为使转座酶有足够的时间诱导PB 转座子发生转座,且使诱导后的酵母细胞仍处于对数生长期,转接0.025OD 细胞至25 mL 尿嘧啶缺陷型半乳糖选择性培养基(SGUra),使起始OD 为0.001。30 ℃振荡培养27 h 后,涂布至腺嘌呤和组氨酸缺陷型葡萄糖选择性培养基(SD-Ade-His)。30 ℃静置培养,待平板上出现明显的酵母菌落,随机挑取菌落并在含有5-氟乳清酸(5-FOA)的SD 培养基上再划线,从而移除含有URA3 标签的PB 转座酶表达质粒,得到PB 插入型稳定突变株。
SOB 培养基:2%(W/V)胰蛋白胨,0.5%(W/V)酵母提取物,0.05%(W/V)NaCl,2.5 mmol/L KCl,10 mmol/L MgCl2。
3)大肠培养基:2×YT/Amp 培养基:1.6%(W/V)胰蛋白胨,1%(W/V)酵母提取物,0.5%(W/V)NaCl。氨苄青霉素培养基应在灭菌后的培养基中添加终浓度为100 μg/mL 的氨苄青霉素。
多模态隐喻观认为隐喻不只存在于语言中,还存在于其他媒介中,如声音、音乐、色彩、线条等。“多模态隐喻”是指用两种或两种以上模态来体现源域和目标域映射隐喻现象(Forceville&Urios-Aparisi,2009)。多模态研究主要探讨多种媒介下的图像、音乐等非语言符号在表达意义时的互补性及规律性特征,探讨模态和媒体的关系,以及第二外语课堂中多模态视觉和言语的协同性(Barthes 1977;Kress&Van Leeuwen 2001;Royce 2002)。
SOC 培养基:1 L SOB 中添加10 mL 2 mol/L 葡萄糖溶液。
1.3 PB 转座子系统筛选方法
推荐理由:本书深度回顾了上海改革开放40年历史进程中的40个具有上海特色、全国影响,且涵盖各历史阶段和各领域的重要事件,以讲故事的形式,梳理背景、挖掘细节、分析意蕴,生动展现上海波澜壮阔、荡气回肠的改革开放历程,立体刻画上海“开放、创新、包容”的城市品格,揭示出改革开放何以成就上海。
1.4 巢式聚合酶链式反应验证PB 插入位点
对于物理学科而言,我们学生纠错更应该关注于思维的过程,如力学问题的解决纠错要从画受力图、运动行程图等入手.
1.5 生长曲线测定
已有研究报导PB 转座子能在出芽酵母中进行转座[15]。其将PB 转座子插入游离质粒的URA3 编码框中,用以分析PB 转座活力。然而,在出芽酵母中使用PB 转座子系统进行基因筛选还未有报导。为了在酿酒酵母中使用PB 转座子系统,本研究构建了一个含有3’PB-TEFp-HIS3-5’PB 转座子的质粒pPB-TEFp-HIS3,其中HIS3 基因由TEF 启动子控制,位于两段末端PB 反向重复序列之间(图1)。以这个质粒为模板,使用引物YW3 和YW4 扩增PB 转座子序列,通过同源重组技术,将PB 转座子插入酵母ADE2 基因编码框的TTAA 序列中(图2)。同时构建了表达PB 转座酶(PBase)的质粒,由GAL 启动子调控PBase 的表达。
1.6 PB 转座子移除率和再插入率计算
将筛选菌株接种于SG-Ura 液体培养基,转座酶在半乳糖启动子诱导下表达,诱导PB 转座子发生转座。经过一段时间诱导后,在3 种酵母基本培养基上分别涂布适量的酵母菌。SD 平板上生长的酵母菌包括所有未发生转座及转座子发生移除和再插入的菌株。当PB 转座子发生移除,离开原始插入位点ADE2 基因编码框,这些酵母菌株能在腺嘌呤缺陷型葡萄糖选择性培养基(SD-Ade)上生长。当PB 转座子发生移除并再插入新的基因位点时,这些酵母菌株能在SD-Ade-His 平板上生长。转座子移除率及再插入率为
用酵母基因组DNA 纯化试剂盒(上海生工)提取PB 突变株酵母基因组,样品浓度大于2 μg。并使用Hae III(NEB,#R0108S)限制性内切酶降解基因组DNA,37 ℃酶切反应12~16 h。酶切反应结束后,80 ℃反应20 min 灭活Hae III 限制酶。使用梯度PCR 技术在95 ℃反应5 min,之后每15 s 降温1 ℃直至4 ℃,使接头引物YW7 和YW8 形成发卡结构。将处理后的接头引物与降解的基因组DNA 在4 ℃条件下连接,反应12~16 h。65 ℃加热20 min 灭活T4 DNA 连接酶,将连接产物与溶胶液混合,使用柱式DNA 胶回收试剂盒(上海生工)纯化连接产物。最终得到浓度为5~15 ng/μL 的DNA 产物。通过巢式PCR 技术来扩增被PB 转座子插入的基因片段。使用引物YW9 和YW10 进行第一轮PCR,再用第1 轮PCR 的产物为模板,使用引物YW11 和YW12 进行第2 轮巢式PCR。胶回收PCR 終产物,使用T4PNK 酶将扩增的基因片段产物磷酸化。使用PCR 产物纯化试剂盒(上海生工)纯化磷酸化产物,之后将磷酸化产物与经EcoRV 酶切并用碱性磷酸酶CIAP 处理后的载体pBluescript 相连接。最后将连接产物转入大肠杆菌中培养以扩增质粒,提取质粒并送测序。根据测序结果,与NCBI 酵母基因组数据库进行序列比对,得到PB 插入位点的基因序列。

2 结果与分析
2.1 酿酒酵母菌株中构建PB 转座子系统
将质粒pRS316-GAL1p-PBase 转入实验菌株BY4741-ade2::PB-HIS3-suc2Δ::hphMX,得到筛选菌株。在SD-Ura 液体培养基中接种筛选菌株,30 ℃摇床过夜培养,转接0.025OD 细胞至25 mL SG-Ura液体培养基,使起始OD 为0.001。分别选取0,7,14,24,27,30,34,38,49,55 h 作为取样点。在OD660下测定培养液吸光度,以培养时间为横坐标,吸光度值为纵坐标,绘制生长曲线。

图1 PB转座子结构Fig.1 Structure of the PB transposon
当PB 转座子插入ADE2 基因的编码框后,ADE2 基因不能正常表达,在SD 平板上生长的酿酒酵母菌落会呈红色。当在含半乳糖的培养基中培养时PBase 被诱导表达,部分PB 转座子可以从ADE2基因中移除,此时SD 平板上可以同时观察到白色和红色的菌落(表3 和图3),其中白色酵母菌落中ADE2 基因可以正常表达。而在SD-Ade 平板上,只能观察到白色的酵母菌落,说明3’PB-TEFp-HIS3-5’PB 转座子从ADE2 基因编码框移除。此外,由于其中一些白色酵母菌落中,被移除的3’PB-TEFp-HIS3-5’PB 转座子又再插入到新的基因中,ADE2基因和HIS3 基因均可以正常表达,因此这些菌株还可以在SD-Ade-His 平板上生长(图3)。这些结果说明诱导PBase 表达可使PB 转座子发生转座,并且通过在不同培养基中的培养,监测转座或突变状态的酵母菌株十分简便。证明研究中构建的PB系统可以很好地应用于酿酒酵母中。

图2 酿酒酵母中PB 转座子系统Fig.2 PB transposon system in Saccharomyces cerevisiae

图3 PB转座子在酿酒酵母中进行转座Fig.3 Transposition of PB element in Saccharomyces cerevisiae

表3 菌株生长情况Table 3 Yeast cell growth condition
2.2 转座系统中PB 移除率和再插入率
PB 转座子可以在酿酒酵母菌株中灵活转座,通过诱导PBase 表达,本研究进一步检测PB 转座子被移除和再插入的效率。实验中分析了在SG-Ura培养基中培养的酵母的生长曲线,以及3’PBTEFp-HIS3-5’PB 转座子的移除率和再插入率(图4)。所有数据均进行3 次实验,取平均值。按照测定生长曲线的取样点,当细胞在半乳糖培养基中诱导培养0,7,14,24,27,30,34,38,49 h,在每个时间点分别取300 个细胞涂布于SD 平板,SD-Ade 平板以及SD-Ade-His 平板。根据式(1)和式(2),计算转座子移除率和再插入率。实验结果表明:随着培养时间增加,移除率持续上升(图4(b))。当PBase 诱导27 h 后,转座子再插入率停止增加,之后一段时间内再插入率出现下降,接着再逐渐增加(图4(c))。作者推测已经插入酵母基因组的转座子在PBase 的作用下被再次从插入位点移除,导致再插入率出现下降。之后再次增加是因为被再次移除的转座子又被再次插入基因组,转座子进行二次转座。根据曲线,当PBase 诱导酵母生长27 h 时,移除率达到10.57%,再插入率达到2.59%。从酵母生长曲线可以看出,经过27 h 诱导,酵母处于对数生长期,细胞生长状态良好,且PB 转座子未发生二次转座。因此本研究可以选择27 h 作为PB 转座的诱变时间。
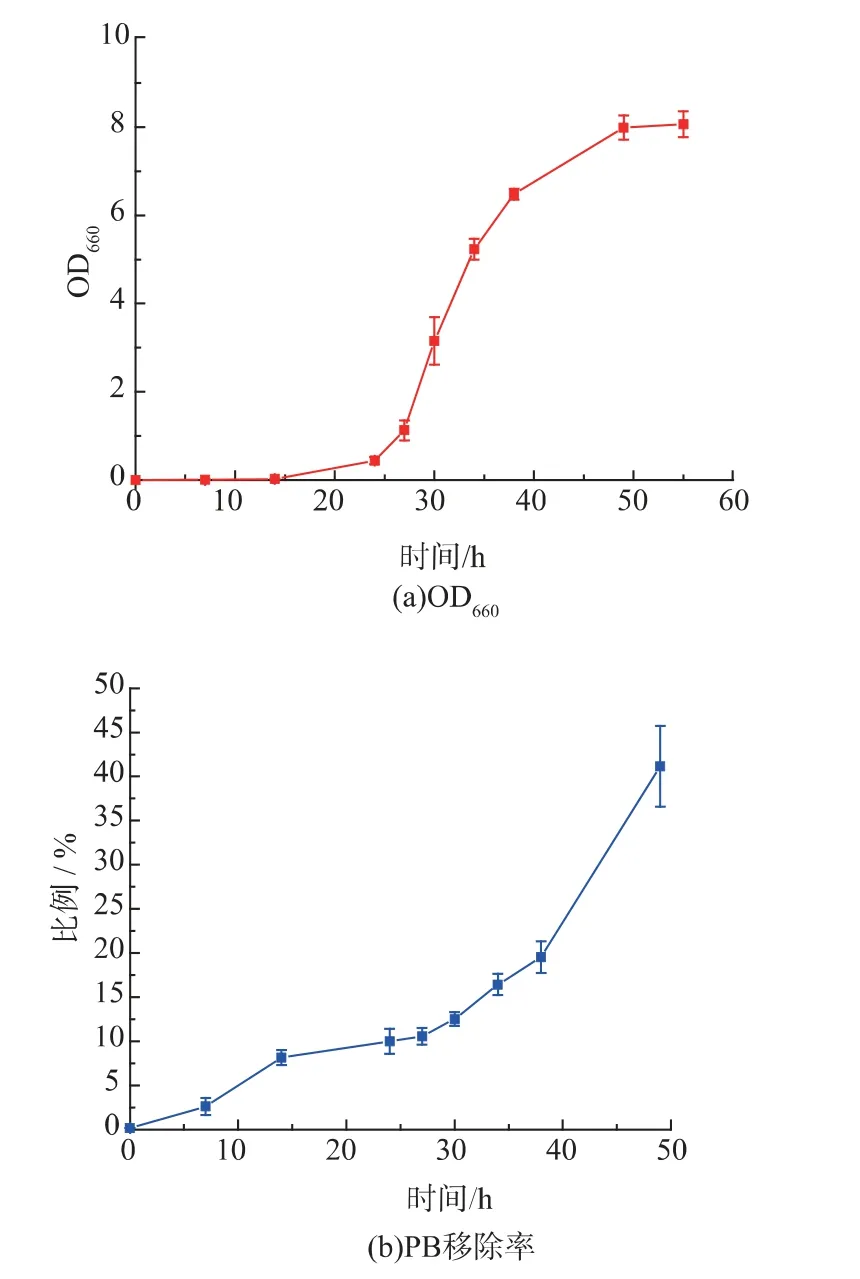

图4 PB转座子的转座效率Fig.4 Transposition efficiency of PB
2.3 转座过程中PB 转座子拷贝数的检测
根据PB 移除率和再插入率曲线,研究中选取27 h 作为菌株诱变时间。酿酒酵母中PBase 诱导PB转座子发生插入突变后,作者在SD-Ade-His 平板上随机挑取了PB 转座子从原始位点移除并进行再插入的43 个酵母菌落,提取每个菌株的基因组,用于检查其中的PB 插入数以及插入基因位点。通过1.4 节中所述的巢式PCR 技术扩增插入PB 转座子的DNA 区域。核酸凝胶电泳结果显示,从这些菌落基因组中可扩增出多种不同大小的片段(图5),说明PBase 诱导后PB 转座子可再次随机插入酵母基因组中。且每个基因组样品均只能扩增出一条DNA片段,说明PB 转座子在转座过程中仍维持初始的单拷贝,不会发生复制。表4 列出了部分PB 转座子插入的基因序列,其中近23%的PB 转座子插入酵母基因编码框中,影响基因功能正常表达,引起突变。且被PB 转座子插入编码框的8 个基因均为非必须基因,说明转座子在诱变时更倾向插入非必须基因。其余77%的转座子可插入基因启动子区域或者终止子区域,通过影响基因表达量改变相应性状。在原始筛选菌株中,PB 转座子位于第15 号染色体的ADE2 基因编码框。经过诱导转座后,PB 转座子可随机插入酵母基因组其他染色体(表4)。这些结果说明使用本研究所构建的PB 转座子系统进行筛选时,在一个酵母菌株中只含有一个转座子插入导致的突变位点,且插入位点随机,均匀分布于酵母基因组,并可快速检测该插入基因,进一步证明此系统可应用于酿酒酵母菌株中的基因筛选。
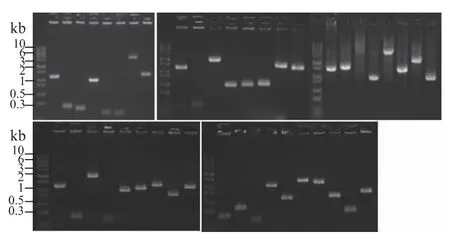
图5 PB插入位点扩增片段Fig.5 Genomic amplified bands of PB insertion sites

表4 突变菌株中PB 插入位点Table 4 PB insertion sites in mutant strains
3 讨论
来源于粉纹夜蛾的piggyBac 转座子可以运用在多种生物中,除了昆虫细胞外,还可应用于酵母,原生动物,植物和脊椎动物等[17]。PB 转座子已被应用为一种基因编辑方法,进行转基因和基因突变。研究昆虫和小鼠基因功能时,可使用PB 转座子实现插入型突变[22-23]。已有研究报道运用PB 转座子在裂殖酵母中进行基因筛选[24-25]。运用PB转座子和同属PB家族来源于棕蝙蝠(Myotis lucifugus)的piggyBat 基因元件,可在酿酒酵母中实现体内、外转座[15,26]。此外,检测PB 转座子移除和插入的分析方法也简便易行。然而,还没有在酿酒酵母体内用PB转座子进行目的基因筛选的报道。本研究在酿酒酵母中构建了PB 转座子筛选系统。首先将PB 转座子插入酿酒酵母ADE2 基因编码框,当PB 转座酶表达时,PB 转座子从原始位点移除并再次插入基因组中的其他位置,发生转座引起插入突变。作者随机挑选了43 个被PB 转座子插入突变的酵母单菌落,并检测其基因组中PB 转座子数目及插入位点。实验发现所有的酵母细胞只含有一个PB 插入位点且插入位点十分随机。有研究表明,PB 转座子在裂殖酵母中进行转座时,由于PB转座发生在细胞分裂S期或者G2 期,8%的酵母细胞中PB 转座子发生复制[25,27]。本研究构建的系统中,原始PB 转座子位于基因组中,在转座过程中不会发生复制仍可维持单拷贝。由于在裂殖酵母的PB 系统中,PB 转座子位于低拷贝的外源质粒上,这一原始位点的差异很可能是造成PB 转座子在两个不同的菌株中拷贝数不同的原因。
利用本研究中构建的PB 转座子系统进行体内突变有以下优势:1)与传统化学诱变相比,诱导PB转座酶表达就可以使转座发生,避免了化学诱变剂的使用,不会对细胞造成其他伤害。2)PB 转座子在一个细胞基因组内只有一个插入位点,突变基因单一有利于细胞突变型的鉴定和分析。3)PB 转座子插入位点的检测通过PCR 技术和基因测序即可实现,简便快速。而鉴定传统诱变导致突变的相关基因需要使用文库进行质粒回补,耗时长并且操作复杂。4)与Sleeping beauty(SB)转座子相比,PB 转座子移除后在原始插入位点不留任何足迹,但SB 转座子被移除后会在原始位点留下3 个碱基,产生移除痕迹[28]。5)在半乳糖启动子的调控下,可以通过再次诱导表达PBase 转座酶,使PB 转座子从插入位点移除,回复突变。
4 结语
本研究中所构建的酿酒酵母piggyBac 转座子基因筛选系统,可有效应用于酿酒酵母进行相关基因筛选。后期可应用该PB 筛选系统对影响酿酒酵母中重要蛋白功能的基因进行筛选。未来还可通过引入下代测序技术扩大检测范围,在全基因组范围内验证突变位点。
