转AM79-EPSPS基因耐草甘膦大豆的获得及功能验证
2019-02-06翁嘉慧楼亿圆徐京何军光张晓丽刘永立
翁嘉慧,楼亿圆,徐京,何军光*,张晓丽,刘永立
(1.浙江新安化工集团股份有限公司,杭州311600;2.浙江大学农业与生物技术学院,杭州310058)
大豆(Glycine maxL.)起源于我国,是我国重要的粮食作物之一。1982 年我国的大豆出口量达到全球出口份额的90%[1]。而自从1996年,美国孟山都公司成功地培育出耐除草剂转基因大豆[2]后,耐除草剂转基因大豆在美国、阿根廷、巴西等国快速普及,其种植面积迅速扩大。根据国际农业生物技术应用服务组织(International Service for the Acquisition of Agri-biotech Applications, ISAAA)公布的数据,2017年全球转基因大豆种植面积达到9 410万hm2,约占转基因作物总种植面积的一半,且其耐除草剂性状一直占主导地位[3]。大量质优而价廉的转基因大豆涌入国际市场,对我国的非转基因大豆造成了巨大的冲击[4],导致我国由大豆第一出口国变成第一进口国[5]。根据中国海关统计的数据,2017年,我国大豆总需求量达到1.107 9 亿t,其中约有86%依赖于进口。一旦大豆出口国遭遇大的自然灾害或调整贸易政策,我国进口大豆的风险就会很大[6]。因此,培育耐除草剂转基因大豆品种、扩大转基因大豆的种植面积,是我国实现大豆供需平衡、保证粮食安全的有效手段之一[7]。
耐除草剂的功能基因主要为Pat(Bar)和EPSPS。根据ISAAA公布的数据,商业化程度最高的2 个大豆品系GTS-40-3-2、NK603 均含有来自cp4菌株的EPSPS耐草甘膦基因。草甘膦作为除草剂,具有良好的内吸收性和低毒性,且对人(Homo sapiens)和动物基本没有毒性[8],是培育耐除草剂作物的优良靶标除草剂。CP4-EPSPS基因是孟山都公司克隆的,并在1994 年申请了相关专利,专利号为US5633435,已于2014 年过期。AM79-EPSPS基因由中国农业科学院林敏的科研团队通过实验获得[9],专利号为CN200710177090.1,是具有我国自主知识产权的新基因。该基因编码的蛋白属于5-烯醇丙酮莽草酸-3-磷酸合成酶(5-enolpyruvylshikimate-3-phosphate synthase, EPSPS),是一种全新的EPSPS 蛋白[10]。动力学参数显示,AM79-EPSPS 蛋白不仅具有较高的草甘膦耐受性,而且保持着与磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)较强的亲和性,能够赋予植物对除草剂草甘膦的耐受性,是培育耐草甘膦转基因作物的极佳选择。REN 等[11]发现,AM79-EPSPS基因可以用于培育抗草甘膦转基因玉米(Zea maysL.),且其在转基因玉米中过表达能够显著提高转基因玉米对草甘膦的抗性。但到目前为止,尚未有AM79-EPSPS在转基因大豆中表达研究的报道。本研究采用农杆菌介导转化方法培育转AM79-EPSPS基因耐草甘膦大豆新品种,通过对其中的关键转化参数进行研究,建立高效的转AM79-EPSPS基因大豆转化体系,从而获得转化体,并验证其对草甘膦的耐受性,旨在为培育具有我国自主知识产权的转基因大豆新品种奠定基础,以提高我国大豆产业的竞争力。
1 材料与方法
1.1 实验材料
1.1.1 大豆受体材料
天隆一号大豆品种,由中国农业科学院惠赠。
1.1.2 菌株及载体
本研究采用农杆菌介导转化方法培育耐草甘膦大豆新品种,所用农杆菌菌株为EHA 105,具有利福平抗性(rifampicin-resistent, Rif),大肠埃希菌菌株为DH5a,无抗性。所用载体为AM79-pC3301,其图谱如图1所示。该载体只含有一个目的基因表达盒(AM79-EPSPS基因),不含标记基因和报告基因。骨架载体为pCAMBIA3301,来源于农杆菌,该载体在国际上已使用多年,没有致病性,也不可能演变为有致病性。
1.1.3 试剂及仪器
实验所使用的主要试剂有胰蛋白胨、酵母提取物(英国OXOID公司),利福平、羧苄西林、肌醇、琼脂粉、卡那霉素(Kanamycin, Kan)[生工生物工程(上海)股份有限公司],替卡西林(Ticarcillin, Ti)(杭州南启生物科技有限公司),蔗糖、6-苄基腺嘌呤(6-benzylaminopurine, 6-BA)、有机缓冲剂2-(N-吗啉)乙醇磺酸[2-(N-morpholino) ethanesulfonic acid,MES]、赤霉素(gibberellic acid,GA3)、L-谷氨酸(L-glutamine,L-Glu)、吲哚乙酸(indole-3-acetic acid, IAA)、α-硫辛酸(α-lipoic acid, LA)、反式玉米素(trans-zeatin, ZT)、吲哚丁酸(indole-3-butyric acid,IBA)、乙酰丁香酮(acetosyringone,AS)[生工生物工程(上海)股份有限公司],植物凝胶、草甘膦粉剂、41%草甘膦异丙胺盐水剂(浙江新安化工集团股份有限公司)等。
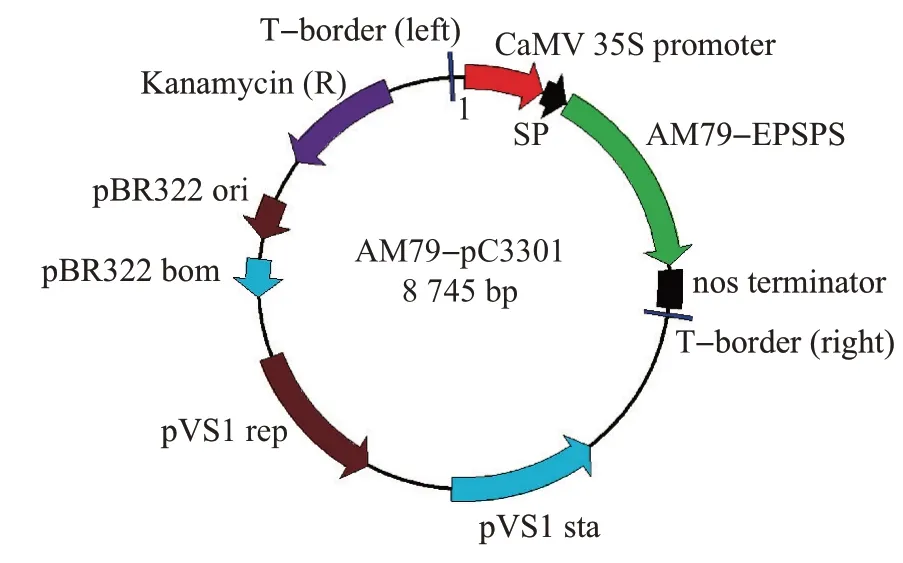
图1 AM79-pC3301载体图谱Fig.1 Carrier map of AM79-pC3301
实验所使用的主要仪器有接种器械灭菌器(北京金博蓝河科技有限公司),超净工作台(江苏省苏州安泰空气技术有限公司),灭菌锅[致微(厦门)有限公司],摇床(上海世平实验设备有限公司),离心机(德国Eppendorf公司),聚合酶链式反应仪(德国Biometra 公司),电热恒温水槽、凝胶电泳仪、恒温箱、凝胶成像系统(美国Bio-Rad公司),化学发光成像系统(美国UVP 公司),高通量组织研磨仪(浙江省宁波新芝生物科技股份有限公司),分析天平(德国赛多利斯公司),pH计(上海仪电科学仪器股份有限公司)等。
1.2 实验方法
本研究通过农杆菌介导转化方法获得转AM79-EPSPS基因大豆,该方法主要在PAZ 等[12]提出的转化方法的基础上进行了优化,并对转化过程中大豆种子消毒时间、侵染及共培养所使用的AS浓度、筛选过程中草甘膦浓度和生根阶段IBA浸没时间等关键参数进行了探究,从而建立农杆菌介导的转AM79-EPSPS基因大豆转化体系,获得转化体。
1.2.1 大豆种子消毒时间的确定
挑选种皮无裂痕且饱满的干豆平铺在无菌培养皿中,然后放入密封状态良好的干燥器中(培养皿开盖放置,将培养皿盖一并竖放在干燥器内);取70 mL次氯酸钠溶液于100 mL小烧杯中,并将它放入干燥器内,然后用移液枪取3 mL浓盐酸于小烧杯中,并迅速盖好干燥器的盖子,密闭消毒0、4、6、8、10、12、24 h 后,接种至预培养的G1 培养基[其组成为:MS 基本培养基(MS 大量、微量、微微量,B5 有机、铁盐)+6-BA 2 mg/L+蔗糖30 g/L+植物凝胶3.0 g/L]上,接种3 d 后,统计大豆种子的萌发率和污染率。每个处理选用50颗大豆种子,设置3个重复。
1.2.2 大豆外植体制备
干豆灭菌结束后,将其接种在G1培养基上,见光预培养18~24 h。挑取无菌、活性好的萌发豆置于无菌瓶中,浸泡2~4 h后,倒掉无菌水,用无菌滤纸吸去多余水分,并用解剖刀从种脐处对半切开,去掉种皮,切掉2/3 下胚轴,并切去一半子叶,留下带有胚的一半置于无菌瓶中,备用。
1.2.3 农杆菌菌液制备
转化前一天在YEP液体培养基(含Rif 50 mg/L和Kam 50 mg/L)中添加菌液,进行活化和扩增,然后在28 ℃、180 r/min 摇床上暗培养15~17 h,接着以5 000 r/min 离心10 min,收集菌体,倒掉上层清液,用浸染液G2液体培养基(其组成为:1/10 MS基本培养基+6-BA 2 mg/L+蔗糖30 g/L+MES 4 g/L+GA30.25 mg/L+LA 25 mg/L+AS)重悬菌体,备用。
1.2.4 草甘膦添加浓度的确定
将1.2.2 中制备好的豆瓣用不含激素及农杆菌的浸染液浸没,常温下放置30 min,每隔10 min 摇一摇,倒掉液体,取出豆瓣,吸去多余的液体,然后将其接种在共培养基G2 固体培养基(G2 液体培养基加琼脂粉12 g/L)上,在培养基上铺一层无菌滤纸。共培养结束后,将子叶节接种到以草甘膦为筛选剂的筛选培养基G3[其组成为:MS基本培养基+MES 0.59 g/L+6-BA 1.11 mg/L+蔗糖30 g/L+草甘膦(由草甘膦粉剂配制)+植物凝胶3.0 g/L]上,同时诱导丛生芽,设置7 个不同的草甘膦浓度(0、40、60、80、100、200、500 μmol/L),3个重复,每个处理49个外植体。见光培养14~15 d 以进行第1 轮筛选,结束后,将子叶节取出并切除长势过于茂盛的芽,移入新鲜的G3培养基上进行第2轮筛选,共培养14~15 d。在第2轮筛选完成后,统计出芽率,并将长出丛生芽的外植体转入伸长培养基G4(其组成为:MS基本培养基+MES 0.59 g/L+谷氨酰胺0.1 g/L+天门冬酰胺0.05 g/L+蔗糖30 g/L+复方替卡西林270 mg/L+IAA 0.1 mg/L+玉米素1 mg/L+GA30.5 mg/L+植物凝胶3.0 g/L)中,培养1~2 个月,统计芽伸长率,其中每隔14~15 d换一次新鲜的培养基。
1.2.5 AS 添加浓度的确定
将1.2.2中制备好的豆瓣用重悬液浸没,常温下放置30 min,每隔10 min摇一摇,倒掉菌液,将豆瓣取出,置于垫有无菌滤纸的培养皿上,吸掉多余的菌液,然后将豆瓣接种在共培养基G2 固体培养基上(培养基上铺一层无菌滤纸)。共培养结束后,转入含草甘膦的筛选培养基G3中培养28~30 d后,统计出芽率,并将长出丛生芽的外植体转入伸长培养基G4中,培养1~2个月,统计芽伸长率,其中每隔14~15 d 换一次新鲜的培养基。设置7 个不同的AS 浓度(0、50、100、150、200、250、300 μmol/L),3个重复,每个处理49 个外植体,于23 ℃暗培养3 d 后,考察AS浓度对大豆外植体出芽率和芽伸长率的影响。
1.2.6 IBA 浸没时间的确定
待芽伸长至2~3 cm后,将芽从基部切下,在其基部蘸1 mg/mL IBA溶液,然后插入生根培养基G5(其组成为:MS 基本培养基+MES 0.3 g/L+蔗糖20 g/L+植物凝胶3.0 g/L)中进行生根培养。设置7 个不同的浸没时间(0、30、60、120、180、300、600 s),3个重复,每个处理10 株,15 d 后统计浸没时间对不定芽生根率的影响。
1.2.7 再生苗炼苗及移栽
待再生苗长出3 条以上根系后进行移栽,先炼苗2~3 d,然后选用杭州锦海农业科技有限公司育苗基质,将幼苗根部培养基洗净,用薄层育苗基质覆盖在根部,周边浇水至浸透,套袋培养2~3 d后,撤去袋子,于弱光处放置1 d后,隔天放于强光下培养。
1.2.8 再生苗基因组DNA 的聚合酶链式反应检测
移栽成活后的幼苗在1 周左右长出新叶,取1片新叶作为检测材料,采用十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide, CTAB)法提取大豆幼苗叶片的基因组DNA,进行聚合酶链式反应(polymerase chain reaction,PCR)鉴定。PCR反应体系(20 μL):基因组DNA 1.0 μL;2×master mix(杭州擎科生物科技有限公司)10.0 μL;AM79-EPSPS-F 0.5 μL;AM79-EPSPS-R 0.5 μL;ddH2O 8.0 μL。PCR 扩增条件:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,30 个循环;最后72 ℃延伸10 min。用Primer 5.0软件设计的引物序列如下。AM79-EPSPS-F:5´-CTGTGACAACAGT CAGCCGT-3´;AM79-EPSPS-R:5´-GGTGTTCCG TCAGGTACTCG-3´。
1.2.9 阳性植株AM79-EPSPS 蛋白表达检测
为了排除假阳性及验证AM79-EPSPS基因的表达情况,对PCR 检测阳性的植株按照AM79-EPSPS转基因速测试纸说明书(上海佑隆生物科技有限公司)检测AM79-EPSPS蛋白表达情况。
1.2.10 转AM79-EPSPS基因大豆植株抗性测试
为了验证转AM79-EPSPS基因大豆植株对草甘膦的抗性,在其T0代阳性苗移栽成活后2 周,对其进行1 倍浓度(普通大田除草剂使用浓度)的41%草甘膦异丙胺盐水剂喷施处理,以未经农杆菌侵染的再生苗作为阴性对照。喷施2 周后统计存活率,并将存活的转AM79-EPSPS基因大豆种植于人工气候室内,继续培养至收种。收获各转化体T1代转基因大豆种子后,于温室内各播种一定量的T1代转基因大豆种子及野生型天隆一号大豆种子(对照),待其长出叶片,按照1.2.8 和1.2.9的方法分别进行再生苗基因组DNA 的PCR 鉴定和阳性植株AM79-EPSPS 蛋白表达检测,继续长至第二复叶期时,喷施1 倍浓度的41%草甘膦异丙胺盐水剂,2 周后统计存活率。收获T2代转基因大豆种子后,重复以上步骤收获各转化体T1代转基因大豆种子。
2 结果与分析
2.1 大豆种子消毒时间的确定分析
利用氯气消毒法对大豆种子进行消毒,通过在萌发培养基上培养,考察不同消毒时间对大豆种子污染率和萌发率的影响,结果如表1 所示。随着消毒时间的延长,大豆种子的污染率降低,消毒时间超过6 h后,大豆种子的污染率差异不显著,均趋近于0。同时发现,过长的消毒时间会抑制大豆种子的萌发,超过8 h后,大豆种子萌发率显著降低。故本实验选择6~8 h作为最佳的消毒时间。
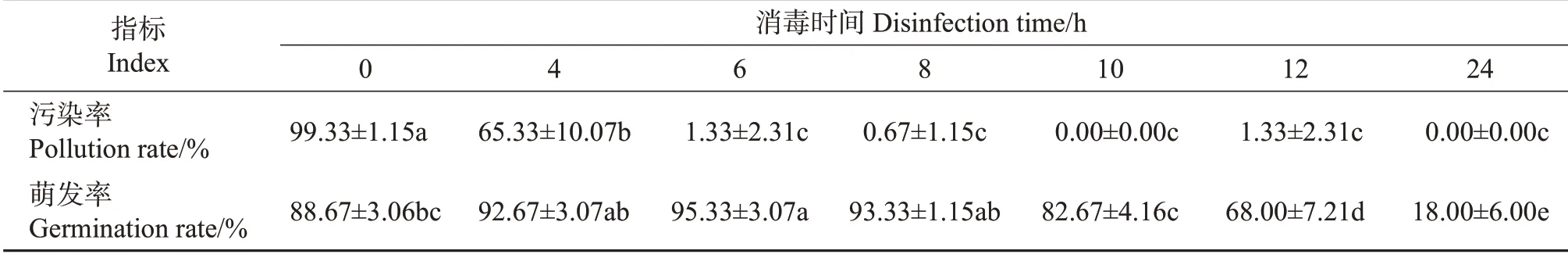
表1 不同消毒时间下大豆种子的污染率和萌发率Table 1 Pollution and germination rates of soybean seeds under different disinfection time
2.2 草甘膦添加浓度的确定分析
本实验研究了7个不同的草甘膦浓度对大豆外植体出芽率和芽伸长率的影响。如图2 所示:当草甘膦浓度为0 μmol/L 时,大豆丛生芽生长茂盛,随着草甘膦浓度的升高,丛生芽生长受抑制程度愈来愈大,且子叶节在草甘膦的作用下开始腐烂;当草甘膦浓度达到200 μmol/L 时,出芽已经十分困难,且生长状态不佳;当草甘膦浓度为500 μmol/L 时,已经无丛生芽长出。同时,如表2所示:当草甘膦浓度为100 μmol/L 时,出芽率明显降低,但仍有10.87%丛生芽伸长;当草甘膦浓度达到200 μmol/L时,虽然还有9.5%的丛生芽长出,但都不能伸长。故本实验选择100 μmol/L草甘膦作为筛选压。

图2 不同草甘膦浓度对大豆外植体出芽率和芽伸长率的影响Fig.2 Effects of different glyphosate concentrations on buddingand bud elongation rates of soybean explants
2.3 AS 添加浓度的确定分析
不同浓度AS对转化过程中大豆外植体的出芽率和芽伸长率的影响如表3所示。当共培养阶段不添加AS时,转化率几乎为0,说明AS在决定外源基因能否导入受体细胞中起到了关键性作用;当AS浓度为150~200 μmol/L 时,出芽率及芽伸长率较为理想,在这个范围内大豆外植体的出芽率为40%左右;当AS 浓度高于200 μmol/L 时,出芽率降低,说明过高的AS 浓度反而起到了抑制作用。同时,考察抗性芽后期的伸长情况发现:AS浓度在100~200 μmol/L范围内时,出芽率之间虽然差异不显著,但是当AS浓度为200 μmol/L时,芽伸长率最高,达到了14.30%。故本实验选择200 μmol/L 作为最佳的AS添加浓度。

表2 不同草甘膦浓度下大豆外植体出芽率和芽伸长率Table 2 Budding and bud elongation rates of soybean explants under different glyphosate concentrations

表3 不同AS浓度下大豆外植体出芽率和芽伸长率Table 3 Budding and bud elongation rates of soybean explants under different AS concentrations
2.4 IBA 浸没时间的确定分析
本研究考察了浸没在1 mg/mL IBA溶液中不同时间对再生苗生根率的影响。结果(表4)显示,在不使用IBA 的情况下,生根十分困难,而使用IBA后,较短的浸没时间有助于提高转基因再生苗的生根率,最高可达96.67%,但当浸没时间较长时,IBA会抑制再生苗的生根。因此,本实验选择在IBA中浸没时间为30 s。

表4 不同IBA浸没时间下再生苗的生根率Table 4 Rooting rate of regenerated seedlings under different IBA immersion time
2.5 再生苗基因组DNA 的PCR 检测结果分析
通过转化获得9 株长势较好的抗性苗,移栽成活后采用PCR 方法检测外源基因是否插入到大豆基因组DNA 中。结果(图3)显示,在事件A1~A9中,除A1、A4、A5外,其余事件均能够扩增到目标片段,而AM79-EPSPS基因目标条带大小为645 bp,说明外源基因已经整合到这6株大豆的基因组中。
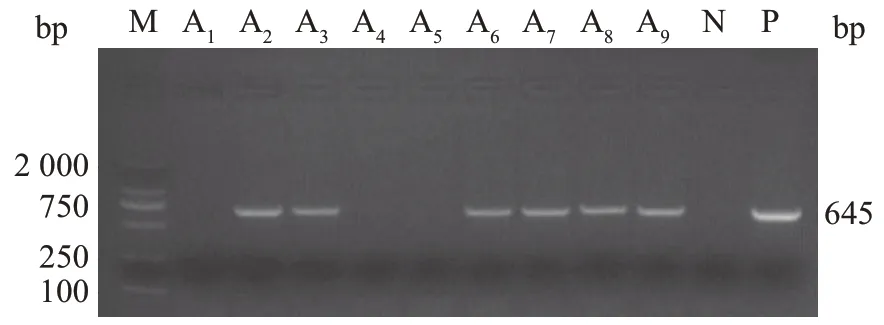
图3 转基因大豆再生苗基因组DNA的PCR检测结果Fig.3 Detection results of PCR for genomic DNA of regenerated transgenic soybean seedlings

图4 T0代阳性植株AM79-EPSPS蛋白表达检测结果Fig.4 Detection results of AM79-EPSPS protein expressionin T0 generation positive plants
2.7 转AM79-EPSPS基因大豆植株抗性测试结果分析
通过喷施1倍浓度的41%草甘膦异丙胺盐水剂对转AM79-EPSPS基因大豆植株进行抗性验证,结果如图5 所示。6 株T0代转AM79-EPSPS基因大豆植株在喷施草甘膦2 周后均能正常生长,而非转基因大豆植株已经枯萎。如表5 所示,这6 个转化体的T0、T1、T2代植株在喷施草甘膦2 周后,转化体的存活率均为100%,而非转基因大豆植株(对照)的存活率均为0。说明转AM79-EPSPS基因大豆植株具有明显的草甘膦抗性且能将此特性正常遗传给后代。

图5 T0代转AM79-EPSPS基因大豆植株抗性测试结果Fig.5 Resistance test results of T0 generation transgenic soybeanplants transformed by AM79-EPSPS gene

表5 T0~T2代转基因大豆植株喷施草甘膦后存活率统计Table 5 Survival rate statistics of T0-T2 generation transgenic plants sprayed with glyphosate
3 讨论
3.1 转AM79-EPSPS 基因大豆转化体系的建立
农杆菌介导的转化方法在大豆转化中的应用已经十分成熟,然而同一作物,导入的基因不同,其转化条件也存在差异[13],AM79-EPSPS在大豆转化中为一个新型的抗草甘膦基因,对转化条件进行研究,对于转化体系的成功建立有着至关重要的作用[14]。本研究分别从大豆种子消毒时间、侵染时使用的AS 浓度、筛选剂草甘膦浓度和生根阶段IBA浸没时间等因素出发,探究并建立了高效的转AM79-EPSPS基因大豆转化体系。
杜升伟等[15]、刘银[16]、李冬梅等[17]都证明了氯气消毒法可以有效地进行大豆种子消毒。孙昕等[18]研究表明,大豆种子氯气熏蒸时间为6~10 h时,种子的污染率和萌发率控制得最好;而白肖飞[19]验证了氯气熏蒸16 h 时大豆种子的消毒效果最佳;翟锐等[20]则报道了氯气熏蒸14~18 h,可在不影响大豆种子活力的同时最大限度地减少污染。本实验结果与上述文献结果稍有出入,这可能与大豆种子本身的质量及其品种有关。
建立高效的耐草甘膦转基因大豆体系,选择合适的筛选浓度对获取阳性苗有着举足轻重的作用[21]。王婉婉[22]研究表明,以草甘膦作为筛选剂进行大豆转化时,草甘膦质量浓度以10~15 mg/L 为宜。陆玲鸿等[23]在进行草甘膦浓度梯度实验时发现,当草甘膦质量浓度为100 mg/L 时,虽然丛生芽的再生率下降了50%~60%,但最终转化效率不受影响。本实验结果与此基本相符。
AS是影响苦豆子[24]、棉花[25]、白杨[26]等多种植物转化率的主要因素。柯丹霞等[27]对大豆转化过程中AS 浓度对丛生芽诱导的影响进行了研究,结果表明,当AS 浓度为100 μmol/L 时其丛生芽的诱导率最高。而皮照兴等[28]、LIU 等[29]的研究结果表明,在共培养液体培养基中添加200 μmol/L AS 最有利于转化,本实验研究结果与其一致。
生根是外植体再生过程中的一个关键性步骤。谢璐遥[30]、代兵兵[31]研究表明,将大豆再生苗基部蘸1 mg/mL IBA 溶液能够促进生根,廖人燕等[32]研究发现,不同IBA浸泡时间对金钱草水插生根的影响不同。说明不同的IBA 浸没时间对于生根的影响亦不一样。赵迪[33]研究表明,将伸长至3~5 cm 的大豆再生芽蘸1 min IBA 后移入生根培养基中,能促进大豆顺利地生根;韩强[34]在大豆芽伸长至3~4 cm时,将其切下,将幼芽底部浸泡在IBA中30 s~l min,然后插入生根培养基中促进其生根。可以看出,上述研究选用的IBA 浸没时间都较短,本实验结果与其基本一致。
3.2 转AM79-EPSPS 基因大豆植株的功能验证
郭文芳等[35]在研究转基因棉花时发现,试纸条检测的准确性高于PCR鉴定和草甘膦测试,并建议将草甘膦和试纸条结合使用。李太强等[36]在研究转基因小麦时发现,试纸条检测方法虽然准确,但成本较高。本研究使用试纸条、PCR 和草甘膦3 种检测方法验证了AM79-EPSPS基因已经导入到6株大豆植株中。
本研究采用普通大田草甘膦使用浓度喷施T0、T1、T2代转AM79-EPSPS基因大豆植株和非转基因大豆植株,对其进行功能验证。结果发现:在本次实验中转AM79-EPSPS基因T0代大豆植株在喷施草甘膦后能正常生长,说明其已具备草甘膦抗性,且受外界因素影响较小;其T1、T2代植株在喷施草甘膦后也均能正常生长;而各世代非转基因大豆植株全部死亡。这充分说明AM79-EPSPS基因能赋予转基因大豆明显的草甘膦耐受性。
4 结论
本研究对转化过程中大豆种子消毒时间、侵染及共培养所使用的AS 浓度、筛选过程中草甘膦浓度和生根阶段IBA 浸没时间等关键参数进行了探究,明确了当种子消毒时间为6~8 h,AS 浓度为200 μmol/L,草甘膦浓度为100 μmol/L,IBA 浸没时间为30 s 时,转化效果最好。本研究建立了高效的转AM79-EPSPS基因大豆转化体系。根据建立的转化体系开展了一批转化,获得的6 株转AM79-EPSPS基因大豆苗在T0、T1、T2代都能检测到AM79-EPSPS 蛋白表达,且都表现出明显的草甘膦耐受性,证明该转化体系是有效的,也说明AM79-EPSPS基因可以用来培育耐草甘膦的转基因大豆。AM79-EPSPS在转基因大豆中的分子特征及在后代中赋予转基因大豆高倍草甘膦耐受性的机制等还需进一步研究。总之,本研究为新基因的功能研究搭建了桥梁,为培育具有国家自主知识产权的转基因大豆新品种奠定了基础,对推动我国生物种业这一战略新兴产业发展起到了关键性的作用,对保障国家粮食安全和国家农业可持续发展有着重要意义。
