某三甲医院392份注射剂说明书的调查分析
2019-01-31蔡婷婷
蔡婷婷
药品说明书是指药品生产企业提供的包括药理学、毒理学、药效学等关于药品安全性、有效性的重要科学数据和结论,用以指导临床正确使用药品的技术性资料[1]。注射剂在《中国药典》一部的定义系“药物制成的供注入体内的无菌溶液(包括乳浊液和混悬液)以及供临用前配成溶液或混悬液的无菌粉末或浓溶液”。虽然注射剂发挥作用快速但其安全性及机体适用性较差,直接迅速进入人体,无人体正常生理屏障的保护,若剂量不当或注射过快,或药品质量存在问题,均有可能给患者带来危害,甚至造成不可估量的后果。因此,注射剂的研发与生产过程固然重要,但也不能忽略说明书指导临床正确使用药品的重要性。加强注射剂说明书的管理规范,完善药品说明书的审批和修订工作,具有重要意义。
1 资料与方法
1.1 一般资料
从广东药科大学附属第一医院药房管理系统中调出注射剂的所有信息,按照需要对已有信息进行加减处理,并重新设计新的统计表格打印出来,可逆性拆开392份针剂包装中的说明书进行相关登记。在中国期刊全文数据库上以“药品说明书”“注射剂”为关键词检索文献。
1.2 方法
对住院药房所有注射剂说明书一一查看,采用Excel表进行统计,对照相关法律法规以及参考相关文献分析并讨论。
《中华人民共和国药品管理法》第五十四条规定:“药品包装必须按照规定印有或者贴有标签并附有说明书。标签或者说明书上必须注明药品的通用名、成分、规格、生产企业、批准文号、执行标准、有效期、贮藏、产品批号、生产日期、有效期、适应证、用法、用量、禁忌、不良反应和注意事项。”
《化学药品和治疗用生物制品说明书规范细则》:明确规定了说明书的书写格式(除《药品管理法》中含有的标注项外还包含特殊人群用药、药物相互作用、药物过量、临床试验、药理毒理、药物代谢动力学)以及说明书各项内容的书写要求。
《中药、天然药物处方药说明书撰写指导原则》:详细的记录了说明书各项内容及撰写的具体要求。
笔者基于上述法定文件,对该院药房注射剂说明书的23项标注项进行统计,从药品分类和厂家分类两个角度统计标注项。并对各标注项的具体内容以及缺失原因进行分析探讨。
2 结果
392份注射剂说明书全部标注明确的项目是药品名称、成分、性状、适应证、规格、用法用量、贮藏、包装、有效期、执行标准、批准文号和生产企业12项。标注不明确或者未标注的有不良反应、禁忌、药物相互作用、药物过量、药物代谢动力学、孕妇及哺乳期妇女用药、儿童用药、老年用药、临床试验、注意事项和药理毒理11项。只有7份说明书所有标注项均齐全且明确,占1.79%。而缺失较严重的是药物相互作用、药物过量、药物代谢动力学、特殊人群用药、临床试验。见表1。
总体上中成药的标注率最低,没有 1份中成药说明书标注项完整;从厂家分类来看,进口药品无论是从单项标准率还是平均标注率均高于国产药品标注率。见表2。
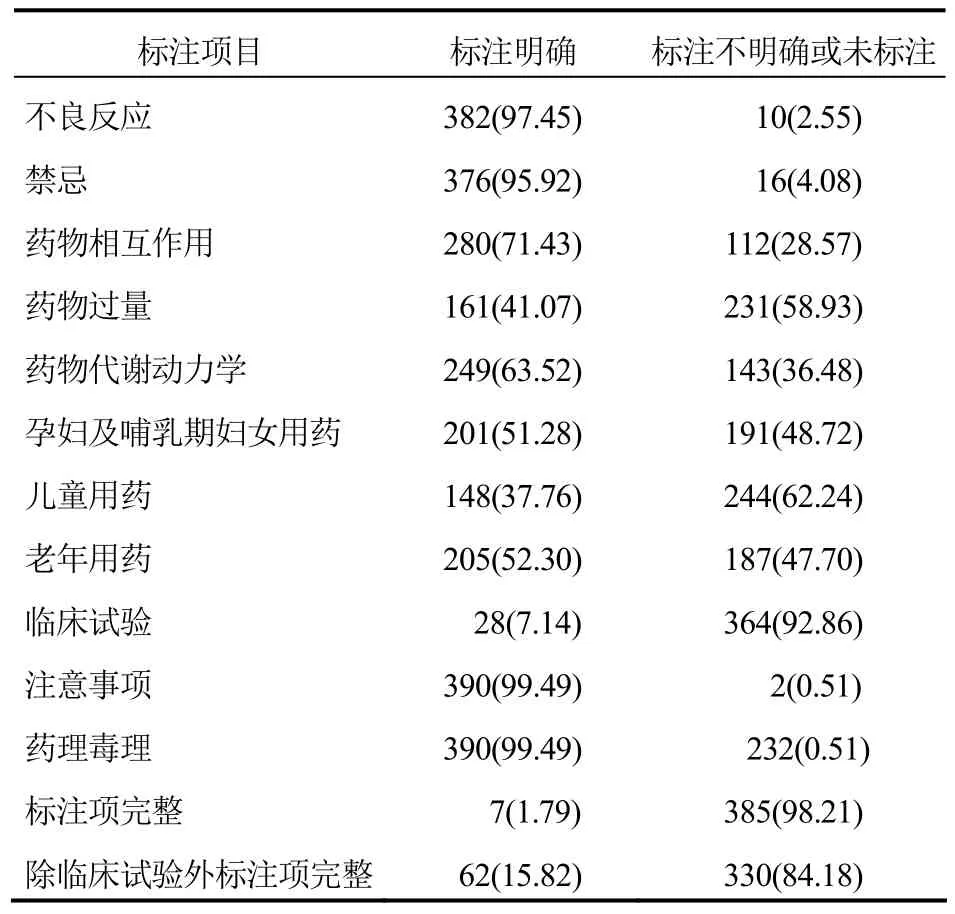
表1 392份注射剂说明书标注项目调查结果[份(%)]
3 分析与讨论
3.1 临床试验
药品说明书需准确、客观地描述药品所进行的临床试验,包括给药方法、研究对象、主要观察指标、结果,结果需包括不良反应等[2]。本研究中只有28份说明书标注,其中5份是抗癌、镇痛类进口药品,5份是心血管类药品,4份是抗感染类药品。
3.2 药物代谢动力学
药物代谢动力学应包括药物在体内吸收、分布、代谢和排泄全过程及其主要的药代动力学参数,以及特殊人群的药代动力学参数或特征[2]。本研究中,吸收、分布、代谢和排泄任一项缺失则统计为标注不明确,36.48%说明书书写不全面。如广州某企业生产的盐酸苯海拉明注射液药品说明书上注明其吸收快而完全,血浆蛋白结合率为 98%,广泛分布于体内各组织,但并无代谢、排泄、半衰期、作用持续时间等药物代谢动力学基本信息。
3.3 特殊人群用药
3.3.1 孕妇及哺乳期妇女用药药品说明书应着重说明该药品对妊娠、分娩及哺乳期母婴的影响,并写明可否应用本品及用药注意事项[2]。本研究中48.72%药品说明书此项标注并不具体或有待研究更新,如武汉某厂生产的重酒石酸去甲肾上腺素注射液:“孕妇应权衡利弊慎用”;天津某企业生产的硫酸阿托品注射液:“有关本品对孕妇的安全性尚不明确”。还有很多类似书写如:“除非紧急情况,孕期妇女不宜使用”“孕妇慎用”“尚无参考文献”等。
3.3.2 儿童用药儿童用药主要包括儿童由于生长发育而对于该药品在药理、毒理或药代动力学方面与成人的差异,并写明可否应用本品及用药注意事项[2]。但大部分药品说明书说明不具体,如四川某厂生产的注射用丙戊酸钠:“参看其他项下的内容或遵医嘱”,但其他项并没有关于儿童用药的说明;还有一些说明书:“用药酌减”而用法用量中只提到“儿童 0.3~0.5单位”。其他类似书写如:“儿童慎用”“婴幼儿慎用”“请遵医嘱”“安全性研究数据尚不充分”等。

表2 392份注射剂说明书的药品种类及厂家分类统计结果[份(%)]
3.3.3 老年用药老年用药主要包括老年人由于机体各种功能衰退而对于该药品在药理、毒理或药代动力学方面与成人的差异,并写明可否应用本品及用药注意事项。未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
说明不详细,如四川某厂生产的注射用丙戊酸钠:“参看其他项”但其他项并没有关于老年人用药的说明。其他类似书写如:“老年患者慎用”“安全性研究数据尚不充分”“参看其他项下的内容或遵医嘱”等。
3.4 药物相互作用
药品说明书应列出与该药品产生相互作用的药品或药品种类,并说明相互作用的结果及合并用药的注意事项[2]。信息不全,需及时更新,如“目前尚无与其他药物相互作用的报道,但为防止药效降低,不宜与其他药物混合静脉滴注”“益处大于风险时使用”等。
3.5 药物过量
药品说明书需详细列出过量应用该药品可能发生的毒性反应、剂量及处理方法[2]。书写不全,上海某厂生产的甲硫酸新斯的明注射液:“过量时可导致胆碱能危象,甚至心脏停搏”仅简单说明过量的症状表现,而并没有提及治疗措施。其他类似的如:“减量减轻”“发现超剂量症状时应采取对症及支持疗法”等。
3.6 不良反应
药品说明书应详细列出该药品不良反应,包括不良反应严重程度、发生频率、临床症状[2]。本研究中10份说明书未标注药品不良反应或标注不明确,包括碘佛醇注射液、注射用盐酸丙帕他莫、多种微量元素注射液、胎盘多肽注射液、注射用磷酸肌酸钠、垂体后叶注射液、氟维司群注射液、肾康注射液等。但笔者在“医脉通”的“用药参考”上发现碘佛醇注射液、注射用盐酸丙帕他莫、氟维司群注射液、肾康注射液却对不良反应项有说明,考虑是纸质说明书没有及时更新。笔者在中国期刊全文数据库(CNKI)查阅胎盘多肽注射液的相关文献,有报道说过敏体质患者易发生发热不良反应。
3.7 禁忌
药品说明书应列出药品禁止应用人群或疾病情况[2]。本研究中16份禁忌不明确或未标注,主要为心血管类药物,抗精神病药物、治疗呼吸系统疾病药物等相对较少。
4 建议
4.1 说明书的外观
《药品说明书和标签管理规定(局令第24号)》第6条:“药品说明书和标签中的文字应清晰易辨,标识清楚醒目,不可以出现印字脱落或粘贴不牢等现象,禁止采用粘贴、剪切、涂改等方式进行修改或补充”。
4.1.1 说明书材料规范问题一些说明书出现掉粉或手接触字迹时脱色现象,其会直接影响医者和患者阅读的效果。
4.1.2 说明书排版格式、字体规范问题笔者也发现所调查的说明书总体上字体格式不规范不统一,有些说明书全文字体加粗,有些只是小标题字体加粗,有些小标题的正文紧跟其后,有些小标题正文另起一行书写,有些甚至上述多种情况交替出现。药品说明书是具有法律效力的文件,但上述现象削弱了药品说明书的可信度和权威性。不同药品说明书字体大小也不完全统一,最小字体八号,最大字体小五,如某厂家生产的注射用头孢呋辛钠、某厂家生产的盐酸帕洛诺司琼注射液等说明书字体大小均为八号字体,某厂家生产的甲磺酸托烷司琼注射液、某厂家生产的复方泛影葡胺注射液等说明书字体为六号字。另外很多说明书整张排版单调细密,重点不突出。药品说明书是指导性和说明性文件,是医者和患者了解药品基本信息最直接的方式,其字体以及相关格式设计应更人性化,可以制定阅读人群可读性研究方面的规定和指导原则,使说明书制定者与说明书阅读人群进行充分的信息沟通,为建立系统且全面的药品说明书制定细则及相应的模板做好充足的准备。
4.1.3 说明书附带问题有些药品包装没有单独附有说明书,而是直接将说明印在外盒上,如天津某厂生产的“复合磷酸氢钾注射液”、山东某厂生产的“氟哌啶醇注射液”、山东某厂生产的“甘草酸二铵注射液”等。其无疑将给医务人员开具处方带来一定影响,造成患者用药不便,甚至误以为没有说明书而主观用药。
在美国,药品包装中不仅仅只有单一的药品说明书。无论是处方药品还是非处方药品均附有额外的药品说明书及标签,针对处方药品,还特别要求药品企业制定不同形式的患者标识等以达到最有效的可读性,比如附有患者说明书、用药指导和使用指导。某种药品若与其他药品有特异处便会带有特有标识,有些药品含有特殊成分,均必须向患者提供载有风险效益信息的文书。使用指导是由企业撰写,由美国食品药品监督管理局(FDA)审批,专门针对复杂给药的药品。而用药指导的目的是为提醒患者用药的严重风险和给予患者有效关切[3]。
4.2 说明书的内观
所调查的注射剂说明书明显欠规范,标注项信息欠详细、指导意见表述参差不齐、更新滞后等问题层出不穷。注射剂说明书内容需随着医学进步不断更新,为减少临床用药风险、临床医师执务风险奠定良好基础。
4.2.1 从上述统计结果来看,最明显的问题就是大部分说明书的标注项目内容只用几个宽泛的字词概括,典型代表词“慎用”,此类表达宽泛含糊不明确。当医务人员没有参考标准时只凭经验给药,这无疑会带来预想不到的风险。这也造成患者用药时对这种表述不明确的信息心存疑虑,往往会影响患者依从性。
4.2.2 本研究结果显示,临床试验项是所有标注项里标注率最低的一项,临床试验无疑是试验药物的疗效与安全性,只有通过了试验阶段,才有可能被批准上市广泛应用于患者。如果一种药物没有高质量的临床研究证实,那么其始终携带着不确定性,不确定的疗效,不确定的安全性,将成为威胁人类合理用药的隐患。
4.2.3 中药注射剂是中药中出现较晚的一种剂型,研究发展并不成熟。近年来,不断出现中药注射剂的不良反应报道,中药成分复杂,当出现不良反应时较难判断到底是哪一种成分导致的不良反应。对中药注射剂的安全性认识还很缺乏,在中药注射剂的研究上还将付出更多努力。现阶段需正视中药注射剂客观存在的问题和不足,有关部门的研究人员应积极引入先进的符合中药注射剂安全性评价特点的研究方法,完善安全性评价体系,企业尤其要进行长期毒性考察,引进先进制备工艺时首先保证生产出的药品质量合格[4]。王鑫和王艳翚[5]指出,中药国际标准的研究制定是必然趋势,应在提高我国中药标准的国际认可度和参与中药国际标准的制定这两个方面多下功夫。另一方面要深入开展中药注射剂的药效物质基础研究。各个部门应当各司其职,严格落实自身责任,不断展开国际深入交流与研讨。
4.2.4 我国药品说明书普遍存在诸多问题,在审批修改药品说明书的基本流程上,也是事项繁琐周期长。虽然《规定》中要求药品说明书应包含药品安全性和有效性的重要科学数据、结论和信息,药品说明书也需要药品生产企业主动跟踪上市后的安全性、有效性情况进行相应的修改,但是问题还是频频出现,包括不同程度的内容简单、安全信息更新缓慢和标注信息不明确等。而美国的药品说明书问题较少,其对药品说明书修改的法律法规更强制、更具体和更严格。对违规处罚的力度大,修改药品说明书的时限具体,条款用语强制性高,这些都将大大提升企业的重视度,重视对药品进行持续性研究,不断评估风险,并及时修改药品说明书[6]。
