抑制ERBB2基因对肝癌HepG2细胞生长及PI3K/AKT信号通路的影响
2019-01-31张新星代小松陈和平
顾 清,张 莉,张新星,代小松,陈和平
四川省医学科学院(四川省人民医院)老年消化科 成都 610072
肝癌是一种常见的癌症,也是全世界癌症相关死亡的第三大原因。研究[1]表明,每年检测到超过60万例原发性肝癌新病例。尽管肝癌患者的5 a生存率有所提高,但肝癌患者的预后较差[2]。由于对目前可用的化疗药物的耐药性和对放射疗法的耐受性,肝癌很容易向其他组织如肺、淋巴结、骨骼和肾上腺等发生转移[3]。因此,需要开发新的和有效的肝癌治疗策略。随着分子生物学的发展,目前已证实[4]肝癌是一系列多基因引发的疾病。从基因层面上探究其发病机制可为肝癌治疗提供有效的作用靶点。ERBB2基因又称HER2基因,具有广泛调节细胞生长、增殖、分化和凋亡的功能[5]。目前研究[6-8]显示,ERBB2基因的过表达与多种肿瘤的发生发展密切相关。ERBB2基因在乳腺癌[6]、卵巢癌[7]、胰腺癌[8]等多种肿瘤组织中异常高表达。靶向抑制ERBB2表达能够抑制乳腺癌细胞的生长和侵袭[9]。多种因素能够通过下调ERBB2表达诱导胃癌细胞发生凋亡,抑制细胞增殖和生长[10-11]。多项研究[12-13]显示,ERBB2能够通过调控PI3K/AKT通路调控癌细胞增殖和侵袭等生物学过程。PI3K/AKT信号通路与肿瘤的发生和发展密切相关,抑制该信号通路能够抑制癌细胞增殖,促进细胞凋亡[14]。近期研究[15]发现,ERBB2在肝癌组织中呈高表达,提示ERBB2可能参与肝癌的发生和进展。但目前国内外关于ERBB2在肝癌发生发展中的功能研究仍较少,因此本实验通过RNA干扰技术抑制人肝癌细胞HepG2中ERBB2的表达,进一步探究其对肝癌细胞生长的影响及机制。
1 材料与方法
1.1材料人肝癌细胞系HepG2(中国科学院上海细胞库);RPMI 1640培养基(美国Gibco公司);胎牛血清、胰蛋白酶(杭州四季青生物工程材料有限公司);由上海吉玛制药有限公司构建ERBB2 siRNA(序列为5’-GATCCGAGATCACAGGTTACCTATTTCAAGCGAATAGGTAACCTGTGATCTCTTTTTT GGAAA-3’);PI/RNase染色试剂盒(美国BD公司);Lipofectamine 2000(美国Invitrogen公司);CCK-8试剂(日本同仁化学研究所);Trizol试剂、SYBR Primix Ex Taq(大连宝生物工程有限公司);反转录试剂盒(德国Thermo Fisher公司);增殖细胞核抗原(PCNA)抗体、AKT抗体和p-AKT抗体(美国CST公司);PVDF膜、HRP标记的二抗(北京康为世纪生物科技有限公司);ECL显色试剂(北京中杉金桥生物技术有限公司);RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒(上海碧云天生物技术研究所)。
1.2细胞培养人肝癌细胞HepG2培养在含体积分数10%胎牛血清的RPMI 1640培养基中,置体积分数为5%CO2、饱和湿度、37 ℃培养箱中,每隔1~2 d更换1次新鲜培养液,待细胞融合度达约90%时,采用2.5 g/L胰蛋白酶进行消化传代,每1~2 d传代1次,取对数生长期的HepG2细胞进行后续实验。
1.3细胞转染和分组转染前1 d将肝癌HepG2细胞以胰蛋白酶消化,种植在6孔板中,种植密度为4×105个/孔,在37 ℃培养箱中继续培养。待细胞融合度约为60%时进行转染,ERBB2 siRNA和siRNA对照的转染均采用Lipofectamine 2000,转染过程严格按照转染试剂说明书进行操作。将转染ERBB2 siRNA的HepG2细胞记为ERBB2-siRNA组,将转染siRNA 对照的HepG2细胞记为Con-siRNA组,将不经任何处理的HepG2细胞记为空白对照组。转染后置37 ℃培养箱中继续培养24 h,然后进行相应检测。
1.4qRT-PCR检测细胞中ERBB2mRNA表达水平转染24 h后分别收集各组HepG2细胞,以Trizol试剂提取各组细胞中总RNA,测定RNA浓度和纯度后,选取合格的RNA进行反转录,反转录过程加样及程序设置均按照试剂盒说明书进行操作。以反转录合成的cDNA为模板,采用SYBR Primix Ex Taq进行PCR扩增。ERBB2引物序列:上游引物5’-TGGAGGACAAGTAATGATCTCCTGG-3’,下游引物5’-AAGAGAGACCAGCAGCCCAGACCTG-3’;内参β-actin引物序列:上游引物5’-CATCTCTT GCTCGAAGTC-3’,下游引物5’-AAGGATTCCTAT GTGCCC-3’。实验采用20 μL反应体系。反应程序:95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 30 s,40个循环。反应结束后统计Ct值,采用2-ΔΔCt法计算ERBB2 mRNA相对表达量。实验重复3次。
1.5Westernblot测定细胞中ERBB2、PCNA、AKT和p-AKT蛋白表达水平分别收集转染24 h后各组细胞,加入适量RIPA蛋白裂解液置冰上提取细胞中总蛋白。采用BCA法测定提取蛋白的浓度,加入上样缓冲液与蛋白混合,沸水浴15 min使蛋白变性,取等量蛋白样品行SDS-PAGE电泳,电泳结束后以半干法电转至PVDF膜上,用100 g/L脱脂奶粉液封闭2 h。分别用一抗4 ℃过夜杂交:ERBB2抗体1∶1 000稀释,PCNA抗体1∶500稀释,AKT抗体1∶800稀释,p-AKT抗体1∶800稀释。TBST洗膜3次,二抗(1∶5 000稀释)室温杂交1 h。TBST洗膜3次,ECL化学发光显色。以GAPDH标定,采用Image J图像分析软件计算各组细胞中ERBB2、PCNA、AKT和p-AKT蛋白相对表达量。实验重复3次。
1.6CCK-8法检测细胞增殖能力取对数生长期的肝癌HepG2细胞,以每孔3×103个细胞接种于96孔板中,置37 ℃培养箱继续培养24 h,待细胞贴壁生长融合度为50%~60%时进行转染,同时设置Con-siRNA组和空白对照组,转染6 h后更换含体积分数10%胎牛血清的RPMI 1640培养基,在37 ℃培养箱中继续培育,分别在24、48、72、96 h时在每孔细胞中添加10 μL CCK-8试剂,于37 ℃培养箱孵育1 h,用酶标仪检测450 nm处细胞光密度值(OD值),实验重复3次,根据测得的OD值绘制细胞生长曲线。
1.7细胞克隆形成实验用软琼脂将6孔细胞培养板进行铺板,置培养皿中待用。分别收集转染24 h后的各组HepG2细胞,胰蛋白酶消化并计数,以液态软琼脂重悬细胞,种植于6孔板中,置37 ℃培养箱继续培养2~3周,待培养皿中出现肉眼可见的克隆时终止培养,用纯甲醇固定15 min,加适量的Giemsa染色液染色20 min,洗去染色液后干燥,在低倍显微镜下观察并计数大于10个细胞的克隆数。实验重复3次。
1.8流式细胞仪检测细胞周期各组HepG2细胞转染后24 h,用预冷的PBS洗涤细胞2次,离心后收集1×105~5×105个细胞,用PBS重悬细胞,分别在每组细胞中加入0.5 mL PI/RNase 染色液,轻轻混匀,在室温下避光反应10 min,随后上流式细胞仪检测并分析细胞周期。实验重复3次。
1.9统计学处理采用SPSS 21.0进行数据分析。空白对照组、Con-siRNA组、ERBB2-siRNA组间ERBB2 mRNA和蛋白相对表达量,克隆形成数,细胞周期及PCNA、AKT和p-AKT蛋白相对表达量的比较均采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1转染ERBB2siRNA对肝癌HepG2细胞中ERBB2表达的影响结果见图1和表1。可知,与空白对照组、Con-siRNA组比较,ERBB2-siRNA组HepG2细胞中ERBB2 mRNA和蛋白表达水平均下调;与空白对照组比较,Con-siRNA组HepG2细胞中ERBB2 mRNA和蛋白表达水平差异无统计学意义。
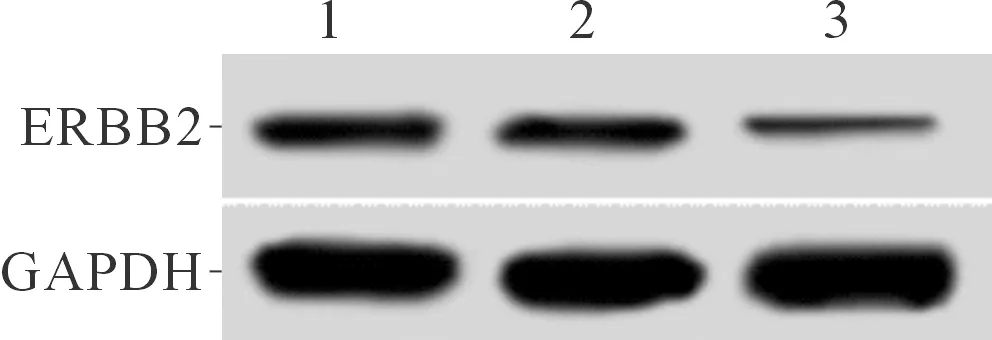
1:空白对照组;2:Con-siRNA组;3:ERBB2-siRNA组

组别ERBB2 mRNAERBB2蛋白空白对照组1.00±0.100.22±0.02Con-siRNA组0.96±0.090.20±0.02ERBB2-siRNA组0.28±0.03*0.03±0.01*F77.558 109.000 P<0.001 <0.001
*:与空白对照组、Con-siRNA组比较,P<0.05
2.2转染ERBB2siRNA对肝癌HepG2细胞增殖和克隆形成能力的影响结果见图2。空白对照组、Con-siRNA组、ERBB2-siRNA组HepG2细胞克隆形成数目分别为(42.66±5.04)、(43.10±4.86)、(15.14±2.16),3组比较,差异有统计学意义(F=43.008,P<0.001)。与空白对照组、Con-siRNA组比较,ERBB2-siRNA组细胞增殖受到抑制,且克隆形成数目减少(P<0.05)。
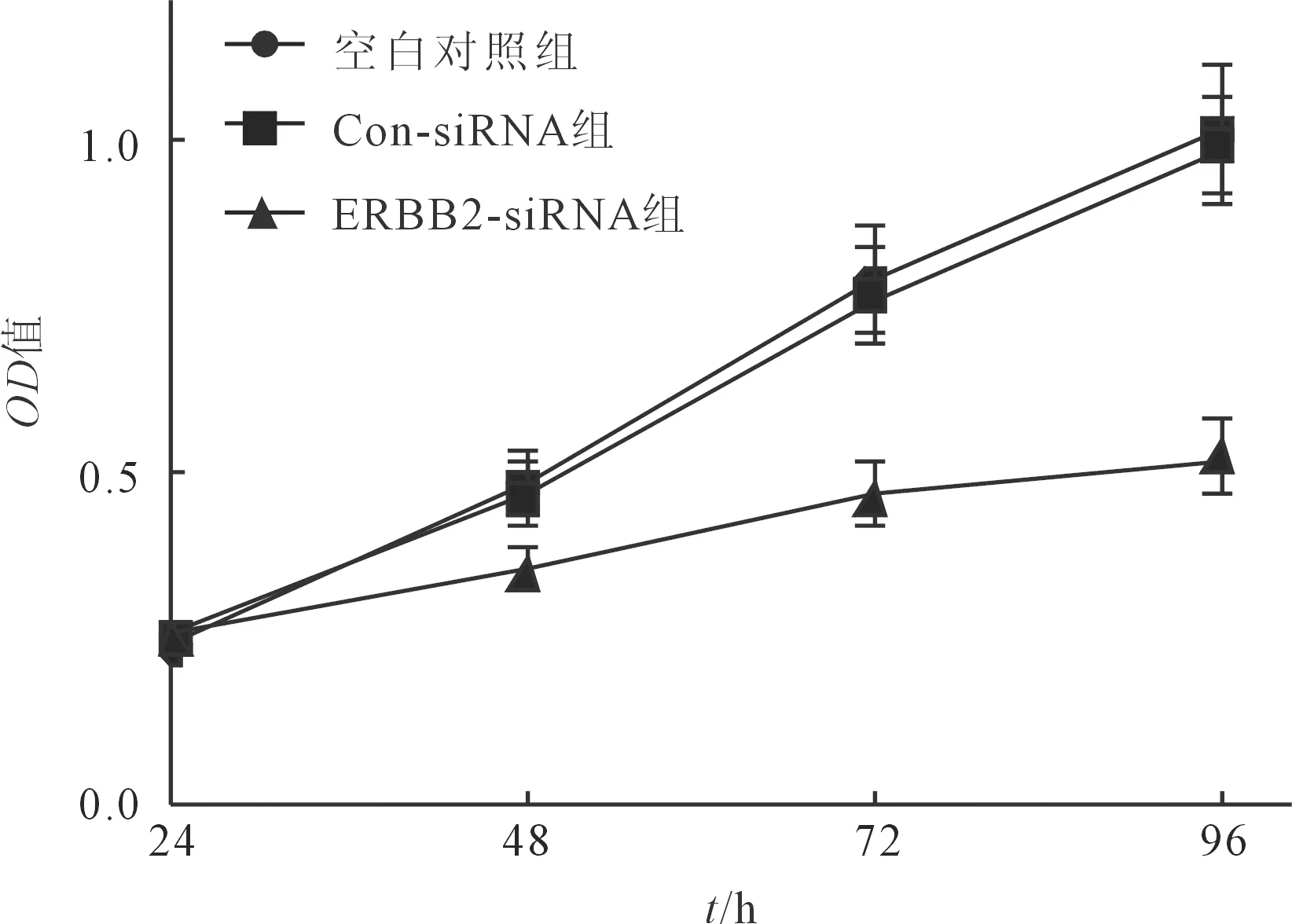
图2 各组HepG2细胞生长曲线
2.3转染ERBB2siRNA对肝癌HepG2细胞周期的影响结果见表2。可知,与空白对照组、Con-siRNA组比较,ERBB2-siRNA组G0/G1期细胞增多, S期细胞减少。
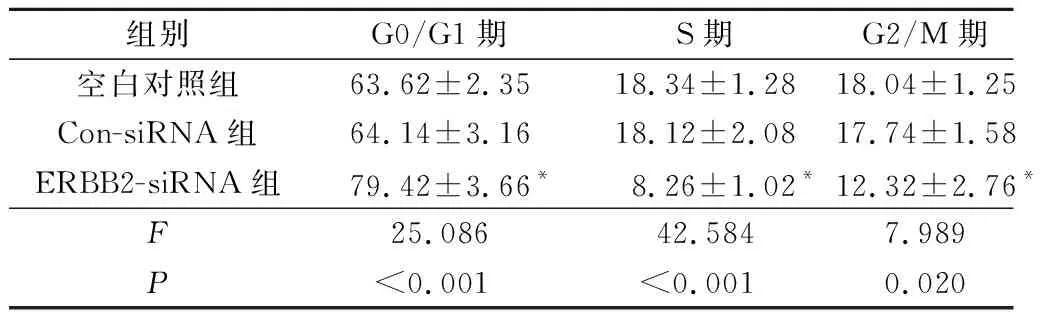
表2 各组HepG2细胞周期的比较(n=3) %
*:与空白对照组、Con-siRNA组比较,P<0.05
2.4转染ERBB2siRNA对肝癌HepG2细胞中PCNA、AKT和p-AKT蛋白表达的影响结果见图3和表3。可知,与空白对照组、Con-siRNA组比较,ERBB2-siRNA组HepG2细胞中PCNA、AKT和p-AKT蛋白表达水平下调。
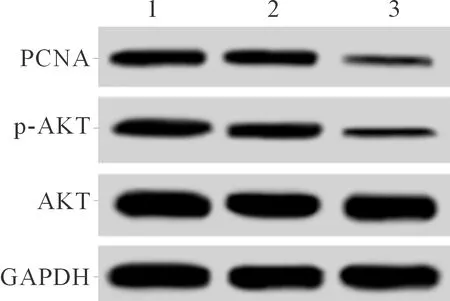
1:空白对照组;2:Con-siRNA组;3:ERBB2-siRNA组
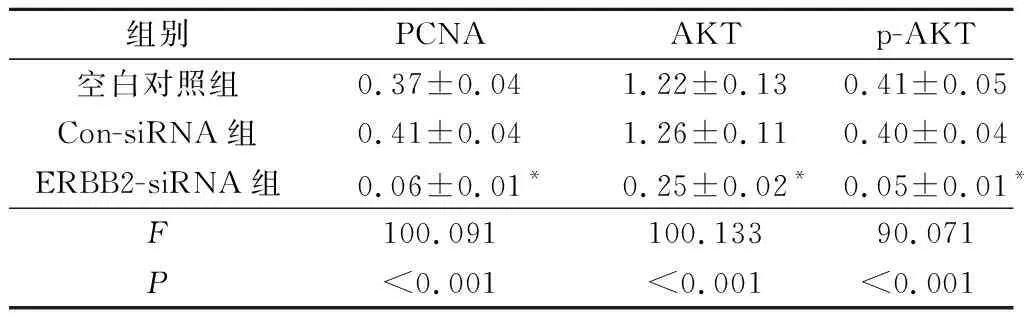
组别PCNAAKTp-AKT空白对照组0.37±0.041.22±0.130.41±0.05Con-siRNA组0.41±0.041.26±0.110.40±0.04ERBB2-siRNA组0.06±0.01*0.25±0.02*0.05±0.01*F100.091100.13390.071P<0.001<0.001<0.001
*:与空白对照组、Con-siRNA组比较,P<0.05
3 讨论
肝癌是临床上最常见的实体瘤,也是一种发病率和病死率增长较快的恶性肿瘤,是癌症相关死亡的第三大原因,中国每年约有11万人死于肝癌。肝癌早期主要通过外科手术治疗,然而,肝癌患者中只有不到50%是在早期诊断出来的。晚期肝癌对当前的化学和放射疗法具有很强的抵抗性,存活率较低,为40%~50%,预后极差,5 a复发率大于60%。随着科学技术的发展,基因靶向治疗在一定范围内改善了肝癌患者的存活率。因此探讨肝癌发病机制以及寻找新的治疗靶点对肝癌的治疗具有非常重要的意义。目前研究[16]证实,ERBB2基因在肝硬化患者血液和组织中呈高表达,该基因多态性与肝癌的发生和发展密切相关,提示ERBB2基因可能成为肝癌治疗的潜在靶标。本实验通过RNA干扰技术在肝癌HepG2细胞中转染ERBB2 siRNA,经qRT-PCR和Western blot检测转染效率,结果发现转染ERBB2 siRNA能够显著抑制HepG2细胞ERBB2 mRNA和蛋白表达。分别采用CCK-8法和克隆形成实验检测细胞增殖和克隆形成能力,结果显示,抑制ERBB2基因后细胞增殖能力和克隆形成能力均明显受到抑制。
PCNA在细胞周期G1晚期大量表达,在S期达到最高峰。PCNA是一种保守的核蛋白,参与调控细胞复制和DNA修复过程。由于PCNA仅存在于处于增殖状态的细胞核内,因此将其作为评价细胞增殖状态的指标。目前研究[17]表明,PCNA可作为反映肿瘤细胞增殖状态的重要指标。本实验中抑制ERBB2基因的表达后,采用Western blot法检测PCNA的表达水平,结果显示肝癌细胞中PCNA蛋白水平显著下调,提示肝癌细胞增殖受到抑制。此外本实验采用流式细胞仪检测细胞周期变化,发现ERBB2基因表达下调后G0/G1期细胞比例增多,S期细胞比例减少,细胞周期阻滞于G0/G1期,这与先前的研究[18-20]结果一致。
PI3K/AKT信号通路广泛在人类肿瘤中异常表达,AKT被PI3K磷酸化而激活,进而促进肿瘤细胞增殖,调控细胞周期进程,抑制细胞凋亡。研究[21-22]显示,PI3K/AKT信号通路在肺癌、宫颈癌等多种肿瘤中异常表达,参与调控肿瘤的发生发展。抑制PI3K/AKT信号通路可以通过抑制肿瘤细胞的增殖、诱导细胞凋亡,阻碍肿瘤的进展。本实验在肝癌细胞中抑制ERBB2基因,经蛋白水平检测发现,PI3K/AKT信号通路中AKT蛋白磷酸化水平显著降低,说明下调ERBB2基因的表达能够抑制PI3K/AKT信号通路的活化,进而抑制肝癌细胞生长,这与Li等[23]研究结果相似。以上实验结果证明,下调ERBB2基因的表达可通过抑制PI3K/AKT信号通路的激活抑制肝癌细胞的生长。
总之,本研究结果表明,抑制ERBB2基因可以抑制肝癌细胞生长并阻滞细胞周期进程,相关机制需要进一步研究。
