独活寄生汤抑制炎症介导软骨细胞基质降解的机制研究
2019-01-30李慧马玉环王圣杰许丽梅许云腾曾建伟王丽丽李西海叶蕻芝
李慧 马玉环 王圣杰 许丽梅 许云腾 曾建伟 王丽丽 李西海 叶蕻芝
【摘 要】目的:探討独活寄生汤抑制炎症介导软骨细胞基质降解的机制。方法:取4周龄SD大鼠10只,采用机械-Ⅱ型胶原酶消化法建立软骨细胞体外培养体系。在光学显微镜下观察软骨细胞形态,用Ⅱ型胶原免疫组化鉴定软骨细胞。将第2代软骨细胞随机分为空白对照组、模型对照组、中药组,3组均连续干预培养8 h。采用酶联免疫吸附法(ELISA)检测干预后各组软骨细胞培养液中白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)含量。采用Western blot检测干预后各组软骨细胞中蛋白多糖1(PGS1)、基质金属蛋白酶(MMP)-13、MMP-9、MMP-3、蛋白聚糖酶(ADAMTS)-4、ADAMTS-5蛋白表达量。结果:①软骨细胞免疫组化鉴定:第2代软骨细胞胞浆呈棕黄色,细胞核不着色,具备软骨细胞的典型特征。②ELISA检测结果:与空白对照组比较,模型对照组IL-1β、TNF-α含量明显升高(P < 0.05);与模型对照组比较,中药组IL-1β、TNF-α含量均明显下降(P < 0.05)。③Western blot法检测结果:与空白对照组比较,模型对照组PGS1蛋白表达量明显降低(P < 0.01),MMP-13、MMP-9、MMP-3、ADAMTS-4、ADAMTS-5蛋白表达量均明显升高(P < 0.01或P < 0.05);与模型对照组比较,中药组PGS1蛋白表达量明显升高(P < 0.05),MMP-13、MMP-9、MMP-3、ADAMTS-4、ADAMTS-5蛋白表达量均明显降低(P < 0.05)。结论:独活寄生汤可以通过调控IL-1β、TNF-α、PGS1、MMP-13、MMP-9、MMP-3、ADAMTS-4、ADAMTS-5表达,明显抑制脂多糖介导软骨细胞的炎症反应,改善软骨细胞基质稳态失衡,从而延缓软骨退变。
【关键词】 骨关节炎;独活寄生汤;软骨细胞;炎症因子;软骨基质;大鼠
Study on the Mechanism of Duhuo Jisheng Tang(独活寄生汤)Inhibiting Inflammation Mediated Matrix Degradation of Chondrocytes
LI Hui,MA Yu-huan,WANG Sheng-jie,XU Li-mei,XU Yun-teng,ZENG Jian-wei,WANG Li-li,LI Xi-hai,YE Hong-zhi
【ABSTRACT】Objective:To explore the mechanism of Duhuo Jisheng Tang(独活寄生汤)inhibiting inflammation mediated matrix degradation of chondrocytes.Methods:Ten four-week-old SD rats were chosen to establish the chond-
rocyte culture system in vitro by mechanical-Ⅱcollagenase digestion method.The morpho-
logy of chondrocytes was observed under the optical microscope,and chondrocytes were identified by type-Ⅱcollagen immuno-
histochemistry.The generation-Ⅱ chond-
rocytes were randomly divided into three groups:the blank control group,the model control group and the Chinese medicine group.ELISA was used to detect the contents of IL-1β and TNF-α in the chondrocyte culture medium of each group.Western blot was used to detect the protein expressions of PGS1,MMP-13,MMP-9,MMP-3,ADAMTS-4 and ADAMTS-5 in chondrocytes.Results:①Immunohistochemical identification of chondrocytes showed that the cytoplasm of the generation-II chondrocytes was brownish yellow and the nucleus was not stained,having typical characteristics of chondrocytes.②ELISA results showed that compared with the blank control group,the contents of IL-1β and TNF-α in the model control group increased significantly(P < 0.05);compared with the model control group,the contents of IL-1β and TNF-α in the Chinese medicine group decreased significantly(P < 0.05).③Western blot results showed that compared with the blank control group,the protein expression of PGS1 in the model control group decreased significantly(P < 0.01),and the protein expressions of MMP-13,MMP-9,MMP-3,ADAMTS-4 and ADAMTS-5 increased significantly(P < 0.01 or P < 0.05);compared with the model control group,the protein expression of PGS1 in the Chinese medicine group increased significantly(P < 0.05),and the protein expressions of MMP-13,MMP-9,MMP-3,ADAMTS-4 and ADAMTS-5 decreased significantly(P < 0.05).Conclusion:Duhuo Jisheng Tang can obviously inhibit the inflammatory response of chondrocytes mediated by lipopolysaccharide,improve the matrix homeostasis of chondrocytes and delay the degeneration of cartilage by regulating the expressions of IL-1β,TNF-α,PGS1,MMP-13,MMP-9,MMP-3,ADAMTS-4 and ADAMTS-5.
【Keywords】 osteoarthritis;Duhuo Jisheng Tang(独活寄生汤);chondrocytes;inflammatory factors;cartilage matrix;rats
骨关节炎(osteoarthritis,OA)是在力学和生物学的共同作用下,导致软骨细胞、细胞基质以及软骨下骨三者合成与降解失衡为特征的一种长期、慢性关节疾病[1-2]。软骨退变是OA最主要的病理特征,软骨细胞基质合成与分解代谢失衡是诱发软骨退变的关键原因之一[3]。为充分了解复方中各味中药之间的协同效应及配伍机制,根据中药的作用特点,选用独活、桑寄生、防风、秦艽、细辛、肉桂等6味具有祛风湿、止痹痛的中药,探讨独活寄生汤抑制炎症介导软骨细胞基质降解的作用机制[4]。基质金属蛋白酶(MMPs)和蛋白聚糖酶(ADAMTS)是参与软骨基质破坏的主要蛋白酶家族,在驱动软骨退变的过程中起重要作用[5-6]。当炎症发生时,白细胞介素-1β(IL-1β)及肿瘤坏死因子-α(TNF-α)参与软骨基质降解的过程,通过联系多个信号通路,促进MMP-13、MMP-9、
MMP-3、ADAMTS-4及ADAMTS-5表达,导致蛋白多糖1(PGS1)丢失,加剧OA病情[7-8]。本研究以炎症介导软骨细胞基质降解为切入点,建立由脂多糖(LPS)诱导的OA细胞模型,深入探讨独活寄生汤抑制炎症反应的作用机制。
1 材料与仪器
1.1 实验动物 清洁级4周龄SD雄性大鼠10只,购于上海斯莱克实验动物有限责任公司,实验动物合格证号SCXK(沪)2012-0001。清洁级医学实验动物环境设施:福建中医药大学实验动物中心,使用许可证号SYXK(闽)2009-0001。实验方案通过医学动物实验伦理委员会批准。
1.2 实验药物 根据独活寄生汤复方配比(独活、桑寄生、秦艽、防风、肉桂、细辛比例为3∶2∶2∶2∶2∶2)称取相应质量的药材(均购于福建中医药大学承创堂),加入相应质量体积分数为70%的乙醇回流提取2次,每次1.8 h,合并滤液,浓缩、干燥。精密称取独活寄生汤提取物500 mg放至15 mL离心管中,加入10 mL含质量分数为10%的胎牛血清(FBS)的培养基(DMEM),超声10 min,0.22 μm无菌型微孔滤膜过滤,置于4 ℃冰箱保存。
1.3 实验试剂 羊抗兔(北京中杉金桥生物技术有限公司);FBS、双抗、DMEM(美国Hyclone公司);磷酸盐缓冲液(PBS)、胰蛋白酶(美国Hyclone公司);Ⅱ型胶原酶(美国Sigma公司);DAB检测试剂盒(北京博士德公司);IL-1β酶联免疫吸附法检测试剂盒、TNF-α酶联免疫吸附法检测试剂盒(美国R&D公司);RIPA裂解液、BCA蛋白浓度测定试剂盒(强)(碧云天公司);PVDF膜(美国Millipore公司);PGS1抗体(美国Sigma公司);CollagenⅡ、MMP-3、MMP-13、MMP-9抗体(美国Abcam公司);ADAMTS-4、ADAMTS-5抗体(美国Santa Cruz公司);TBST、电泳液(北京普利莱公司);转膜液(Thermo Fisher Scientific);显影液(碧云天公司)。
1.4 实验仪器 光学显微镜(Olympus,日本TKO光学仪器株式会社);低温高速离心机(64R型,美国BECKMAN公司);全自动酶标仪(BIO-TEKELX80O型,美国Bio-Tek公司);化学发光成像系统(美国Bio-Rad公司)。
2 方 法
2.1 软骨细胞分离、培养及鉴定 取4周龄清洁级SD雄性大鼠10只,脱颈椎处死;用手术剪刀截取膝关节,无菌条件下分离膝关节,切取表面软骨,PBS漂洗3次;用刀片将软骨切碎约1 mm3大小,置于含有质量分数为0.2%的Ⅱ型胶原酶培养皿中消化,每隔2 h吸取一次上清液;放入离心机以1000 r·min-1离心5 min,加入质量分数为10%的FBS DMEM培養液,轻轻吹打至细胞悬浮,接种于培养瓶中,放入CO2培养箱原代培养,重复4次。细胞长满至培养瓶底80%~90%时,传第1代软骨细胞;继续培养并传代,获得第2代软骨细胞。取第2代生长良好的软骨细胞接种于含有细胞爬片的6孔板中,加入2 mL质量分数为10%的FBS DMEM培养液;培养48 h后,PBS洗3次,用质量分数为4%的多聚甲醛固定30 min;体积分数为0.5%的曲拉通X-100破膜处理15 min,PBS洗3次;质量分数为3%的H2O2处理10 min,蒸馏水洗3次;质量分数为5%的BSA封闭1 h;阳性组滴加兔抗CollagenⅡ(一抗,1∶200)孵育,阴性对照组用PBS代替,4 ℃过夜,PBS洗3次;加入山羊抗IgG(二抗,1∶1000)室温孵育30 min,PBS洗3次,DAB显色10 min后自来水漂洗,苏木素复染,自来水漂洗、晾干、中性树脂封片,光学显微镜下观察软骨细胞形态。
2.2 软骨细胞分组 取第2代生长良好的软骨细胞按1×105个·mL-1接种于6孔板中,细胞贴壁后随机分为空白对照组、模型对照组、中药组,其中空白对照组以含质量分数为10%的FBS DMEM培养;模型对照组以含浓度为10 ng·mL-1 LPS的质量分数为10%的FBS DMEM培养;中药组以含浓度为400 μg·mL-1独活寄生汤和10 ng·mL-1LPS的质量分数为10%的FBS DMEM培养。3组均连续干预培养8 h。
2.3 ELISA法检测软骨细胞培养液中IL-1β、TNF-α含量 干预8 h后,吸取各组软骨细胞培养液,放入离心机以3000 r·min-1离心5 min,吸取上清液。按照ELISA试剂盒说明书处理细胞培养液样品,用多功能酶标仪以450 nm波长检测样品中IL-1β、TNF-α的含量。
2.4 Western blot法检测软骨细胞中PGS1、MMP-13、MMP-9、MMP-3、ADAMTS-4、ADAMTS-5蛋白表达水平 各组弃去培养液,PBS洗3次,加入200 μL蛋白裂解液(RAPI∶PMSF = 100∶1),置于4 ℃冰箱30 min后用细胞刮刀刮去裂解物,收集至EP管中。采用BCA法测定各组蛋白浓度,加入蛋白上样缓冲液,加热变性。根据定量结果,每孔上样20 μg,以质量分数为12%的十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳分离,转移至PVDF膜上,TBST洗涤;加入封闭液室温孵育2 h,TBST洗涤;再分别加入PGS1、MMP-13、MMP-9、MMP-3、ADAMTS-4、ADAMTS-5、β-actin抗体,4 ℃孵育过夜;TBST洗膜3次,加入二抗,室温孵育1 h,TBST洗膜3次;加入ECL显影液曝光、显影。应用Image Lab图像处理软件对显影后的蛋白条带灰度值进行分析。
2.5 统计学方法 采用SPSS 20.0软件进行统计分析。计量资料以表示,3组软骨细胞炎症相关的基因和蛋白表达水平采用单因素方差分析,组间两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
3 结 果
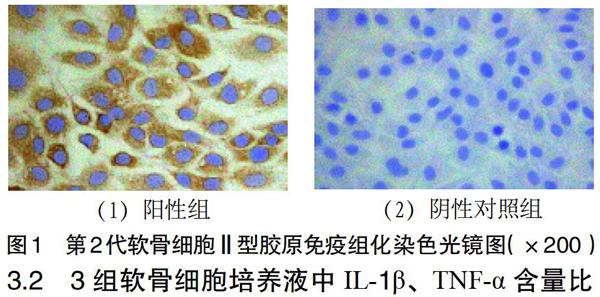
3.1 软骨细胞鉴定 第2代软骨细胞胞浆被染为棕黄色,细胞核呈圆形不着色,具备软骨细胞典型的生物学特征。见图1。
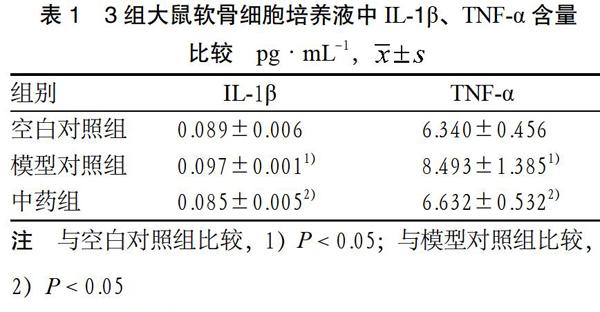
3.2 3组软骨细胞培养液中IL-1β、TNF-α含量比较 干预后,与空白对照组比较,模型对照组软骨细胞培养液中IL-1β、TNF-α含量明显升高(P < 0.05);与模型对照组比较,中药组软骨细胞培养液中IL-1β、TNF-α含量均明显下降(P < 0.05)。见表1。
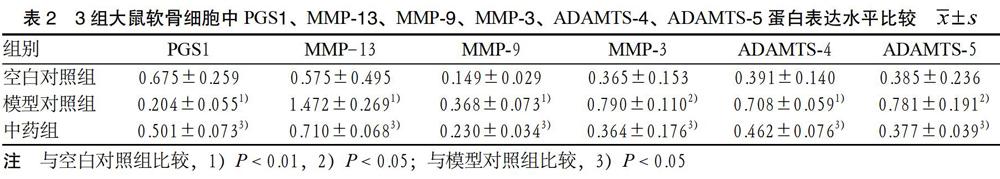
3.3 3组软骨细胞中PGS1、MMP-13、MMP-9、MMP-3、ADAMTS-4、ADAMTS-5蛋白表达水平比较 干预后,与空白对照组比较,模型对照組软骨细胞中PGS1蛋白表达量明显降低(P < 0.01),而MMP-13、MMP-9、MMP-3、ADAMTS-4、ADAMTS-5 蛋白表达量均明显升高(P < 0.01或P < 0.05);与模型对照组比较,中药组软骨细胞中PGS1蛋白表达量均明显升高(P < 0.05),而MMP-13、MMP-9、MMP-3、ADAMTS-4、ADAMTS-5蛋白表达量均明显降低(P < 0.05)。见表2。
4 讨 论
OA的核心病机为本痿标痹,以肝肾亏虚为本,风寒湿邪侵袭、痹阻筋络为标,故治疗以补肝肾为主、祛湿寒为辅[9-10]。独活寄生汤是临床上治疗OA的经典方剂,它可以通过调控炎性细胞因子、促进软骨细胞增殖以及介导软骨细胞凋亡等过程获得较好的结果,同时可以补肝益肾、祛除风寒湿邪、止膝关节痹痛,标本兼治,效果显著。方中独活具有祛深伏骨节之风寒湿邪的作用;桑寄生补肝肾,壮筋骨,祛风湿;防风疏风除湿,透邪外出;秦艽搜筋肉之风湿,通经止痛;细辛、肉桂辛散寒湿,温通经脉而止痛[11-13]。以上诸药均具有祛风止痛的功效。
炎症在OA发展过程中起决定性作用[14-15]。IL-1β和TNF-α是参与关节软骨破坏以及软骨基质降解最主要的炎症因子[16]。IL-1β和TNF-α可以使关节软骨合成一氧化氮,并促进MMP-3的合成;MMP-3不仅可以降解细胞外基质中PGS1、胶原等成分,而且可以激活MMP-9、MMP-13,进而诱导ADAMTS-4、ADAMTS-5生成,加快关节软骨的破坏[17-18]。ELISA结果显示,独活寄生汤可以降低由LPS诱导的炎症软骨细胞培养液中IL-1β、TNF-α含量。Western blot结果显示,独活寄生汤可以促进PGS1蛋白表达,抑制MMP-13、MMP-9、MMP-3、ADAMTS-4、ADAMTS-5蛋白表达。提示独活寄生汤治疗OA的作用机制可能是通过调控IL-1β和TNF-α表达水平,降低炎症刺激,改善软骨细胞内微环境,保护关节软骨。
本研究结果显示,独活寄生汤能够降低LPS诱导的软骨细胞炎症反应,维持软骨基质降解与合成平衡,延缓软骨退变。但具体的作用靶点尚未清晰,之后我们应对炎症相关信号通路做进一步探讨,可以更加明确独活寄生汤对OA的抑制作用。
5 参考文献
[1] 何晓娟,郑文伟,贾良良,等.跳骨片调控Wnt/β-catenin信号通路延缓骨关节炎关节软骨退变的机制研究[J].风湿病与关节炎,2019,8(2):5-9.
[2] MELROSE J,FULLER ES,LITTLE CB.The biology of meniscal pathology in osteoarthritis and its contribution to joint disease:beyond simple mechanics[J].Connect Tissue Res,2017,58(3/4):282-294.
[3] 郑文伟,马玉环,林平冬,等.跳骨片水提物对体外大鼠关节软骨细胞活性的影响[J].风湿病与关节炎,2017,6(1):5-8.
[4] 郑春松,陈春蓉,林平冬,等.基于分子对接研究独活寄生汤作用MMP-1、MMP-3的药效物质基础[J].福建中医药,2017,48(3):37-39.
[5] 曹峻岭.蛋白聚糖与软骨结构、功能及骨关节病的关系[J].西安交通大学学报(医学版),2012,33(2):131-136.
[6] YANG CY,CHANALARIS A,TROEBERG L.ADAMTS and ADAM metalloproteinases in osteoarthritis-looking beyond the "usual suspects"[J].Osteoarthritis Cartilage,2017,25(7):1000-1009.
[7] 刘宏潇,殷海波,王海南.白介素-1在骨关节炎发病机制中的研究进展[J].中国骨伤,2012,25(2):175-178.
[8] 张荣,张向东,赵明宇.膝骨关节炎发病机制及治疗进展[J].风湿病与关节炎,2019,8(5):68-72.
[9] 李照辉,梁珪清,刘伯龄,等.骨关节炎“本痿标痹”内涵探讨[J].風湿病与关节炎,2015,4(7):37-39.
[10] 侯朝铭,王延之,武志佳,等.杵针治疗膝关节骨性关节炎的疗效观察[J].成都医学院学报,2018,13(2):166-168.
[11] 田镭,钟琴,马武开,等.独活寄生汤治疗膝骨关节炎的研究进展[J].风湿病与关节炎,2019,8(1):66-68,72.
[12] 刘发元,李西海,叶蕻芝,等.独活寄生汤干预骨关节炎软骨细胞凋亡的机制[J].中华中医药杂志,2014,29(7):2165-2168.
[13] 潘彩彬,冯阳,刘献祥.独活寄生汤的内涵与外延探讨[J].风湿病与关节炎,2013,2(6):39-41.
[14] 林平冬,马玉环,陈后煌,等.独活寄生汤调节炎症反应抑制骨关节炎软骨退变的作用机制探讨[J].风湿病与关节炎,2016,5(1):51-54.
[15] GU H,JIAO Y,YU X,et al.Resveratrol inhibits the IL-1beta-induced expression of MMP-13 and IL-6 in human articular chondrocytes via TLR4/MyD88-dependent and -independent signaling cascades[J].Int J Mol Med,2017,39(3):734-740.
[16] 章海凤,陈树涛,冒姣娜,等.热敏灸对膝骨性关节炎兔模型IL-1β、TNF-α、MMP-13的影响[J].中华中医药杂志,2018,33(9):3913-3917.
[17] 黄庆恩,黎金焕,文立春,等.膝骨关节炎炎性细胞因子的研究进展[J].风湿病与关节炎,2016,5(11):74-76.
[18] WANG J,MARKOVA D,ANDERSON DG,et al.
TNF-alpha and IL-1beta promote a disintegrin-like and metalloprotease with thrombospondin type I motif-5-mediated aggrecan degradation through syndecan-4 in intervertebral disc[J].J Biol Chem,2011,286(46):39738-39749.
收稿日期:2019-06-06;修回日期:2019-07-25
