完全腹腔镜下经自然腔道取出标本的胃癌根治术+直肠癌根治术1例报告
2019-01-30山东大学齐鲁医院孙国瑞汤小龙何庆泗于文滨
山东大学齐鲁医院 曲 辉,孙国瑞,汤小龙,邵 林,陈 成,何庆泗,于文滨
胃癌与直肠癌同时发生的病例很少,同时根治性切除是治疗的最佳选择,两种手术均可通过腹腔镜完成[1],这为微创技术进行两种手术提供了手段。经自然腔道取出标本手术(natural orifice specimen extraction surgery,NOSES)是先进的外科手术,加强了腹腔镜手术的优点。腹腔镜下切除的标本经口、阴道或经肛门途径取出,无需增加额外腹部切口提取标本,减少了手术切口并发症、与切口相关的疼痛问题的风险[2]。然而,对于同时存在两处肿瘤的病例,NOSES的可行性尚不清楚。本病例旨在探讨同时性直肠癌及胃癌患者行全腹腔镜下根治性NOSES的可行性。山东大学齐鲁医院胃肠外科收治胃癌合并直肠癌患者1例,行NOSES胃癌根治术+直肠癌根治术,现将体会报道如下。患者男,67岁,与2018年8月10日因大便次数增多半年余入院。2型糖尿病病史10余年,无肿瘤家族史。外科检查:腹平,无瘢痕及疝,未见胃肠型及胃肠蠕动波,腹壁无静脉曲张。腹软,无压痛及反跳痛,全腹未触及明显包块,肝脾肋下未触及,Murphy(-)。叩诊轻度鼓音,移动性浊音(-),肝肾区无叩痛,肠鸣音3~4次/min,无气过水声,未闻及血管杂音。双下肢无凹陷性水肿,双侧锁骨上、腹股沟区触诊未触及肿大淋巴结。直肠指诊:胸膝位,进指5 cm可触及一环周生长质硬肿物,退指指套无染血。实验室检查CEA:22.15 ng/mL,CA19-9:407.1 ng/mL。电子纤维结肠镜示:距肛缘5~10 cm可见环周生长新生物,凹凸不平,表面糜烂、溃疡及出血,管腔明显狭窄,病理示(中分化)腺癌。电子胃镜显示:胃窦环幽门口可见约3 cm×3 cm大新生物,表面糜烂出血,取活检,幽门口无狭窄,病理示(胃窦)低分化腺癌。胸腹盆腔强化CT示:符合支气管炎、肺大泡CT表现,左肺上叶前段纤维灶,左侧乳腺增大建议超声检查,胃幽门管区壁局限性增厚,考虑直肠上段及乙状结肠癌,直肠周围多发淋巴结。PET-CT示:(1)结合病理,提示胃窦Ca;(2)结合病理,提示直肠Ca伴上述区域淋巴结转移,F18-FDG PET-CT全身检查(颅脑至股上段)未发现其他明显异常。见图1、图2。考虑肿瘤较晚,无手术根治条件,建议行术前化疗。患者于2018年8月18日行SOX方案化疗2周期。10月8日再次入院,复查实验室检查CEA:19.05 ng/mL,CA19-9:97.09 ng/mL。胸腹盆腔强化CT示:双肺大泡,双肺少许纤维灶,左肺少许炎症,心包少量积液,胆囊炎,双侧肾上腺增粗,请结合临床,胃壁增厚,胃窦壁僵直;直肠及乙状结肠壁厚并周围淋巴结肿大,请结合胃镜及肠镜检查,前列腺增生,膀胱壁厚,炎症不除外。体格检查:基本同前。术前电子胃镜下行纳米炭混悬注射液标记病变。术前诊断:(1)胃癌;(2)直肠癌;(3)新辅助化疗后;(4)2型糖尿病。于2018年10月22日在全身麻醉下行腹腔镜腹部无辅助切口的胃癌根治+直肠癌根治术。术中探查见腹腔无腹水,肝脏盆腔无转移结节。根据术前纳米炭标记,胃肿瘤位于胃窦,约2 cm×2 cm大,未侵透浆膜(图3);直肠肿瘤位于直肠近腹膜返折处,约5 cm×4 cm,质硬,未侵透浆膜(图4),肠系膜下动脉根部可见肿大淋巴结。结合术前检查,决定行腹腔镜腹部无辅助切口的胃癌根治+直肠癌根治术。沿横结肠上缘打开胃结肠韧带,剥离横结肠系膜前叶,清扫No.14组淋巴结。游离结扎切断胃网膜右动静脉,清扫No.6淋巴结。游离胃大弯侧,结扎切断胃网膜左动静脉,清扫No.4组淋巴结。游离胃脾韧带,Hem-o-lok夹闭并切断部分胃短血管,剥离胰腺前被膜,清扫No.8组淋巴结,解剖显露胃左动静脉,Hem-o-lok夹闭并切断结扎,清扫No.7、9组淋巴结。沿脾动脉清扫No.11p组淋巴结。游离小网膜,于肝脏下缘切开小网膜,Hem-o-lok夹闭并切断胃右动静脉,清扫No.5组淋巴结;切开肝十二指肠韧带,清扫No.12组淋巴结。离断小网膜,清扫No.1、3组淋巴结。直线切割闭合器距幽门右侧约3 cm处切断十二指肠,间断全层缝合数针。直线切割闭合器距肿瘤上方约6 cm断胃,切除远端胃约60%,将切除标本置入无菌保护套内,置于盆腔(图5)。距Treitz韧带15 cm处上提空肠,以直线切割闭合器与胃大弯侧后壁行侧侧(毕Ⅱ式)吻合(图6),闭合共同开口,可吸收线连续缝合加固吻合口;直线切割闭合器行输入输出袢肠管的侧侧吻合,闭合共同开口,可吸收线连续缝合加固吻合口。提起乙状结肠,拉向左侧,沿乙状结肠系膜左侧根部剪开侧腹膜,游离肠系膜下动脉及左结肠动脉,清扫周围淋巴结,于左结肠动脉下方结扎切断肠系膜下动脉。提起乙状结肠,锐性分离直肠后间隙达尾骨尖平面。向后上提起直肠,分离两侧直肠侧韧带,游离至肛提肌平面;距肿瘤远端约5 cm裸化肠壁,距肿瘤近端约10 cm裸化肠壁,碘伏棉球消毒直肠,超声刀切开远端肠壁裸化处,经肛置入抵钉座,于近端肠壁裸化处反穿刺置入抵钉座,直线切割闭合器闭合切断近端肠管。经肛置入无菌保护套及卵圆钳,夹持肠管断端,经肛拖出胃标本及直肠标本(图7~图9)。直线切割闭合器闭合远端肠管断端,经肛置入吻合器行直肠乙状结肠端端吻合(图10)。冲洗盆腔,检查无活动性出血,留置腹盆腔引流管及肛管,逐层关腹。手术顺利,术后患者安返病房。标本送病理。术后常规病理:(胃窦)低分化腺癌,部分为印戒细胞癌,Lauren分型:弥漫型,肿瘤切面积4.5 cm×1 cm,侵达深肌层,查见神经束侵犯,上、下切缘及网膜组织未查见癌;小弯侧淋巴结18枚,其中2枚查见转移癌(2/18);大弯侧淋巴结6枚,其中1枚查见转移癌(1/6)。(直肠)中-低分化腺癌伴局部黏液腺癌,溃疡型,肿瘤切面积9 cm×1.4 cm,侵透肌层达周围脂肪结缔组织,脉管内查见癌栓。上、下切缘,吻合器切缘及环周切缘未查见癌;肠周淋巴结29枚,其中18枚查见转移癌(18/29)。另送黏膜组织脉管内查见癌栓。免疫组化:胃腺癌:CK19(+),E-Cad(+),Her-2(0),P53(-),Ki-67阳性率70%;MSH2:无缺失(正常);MSH6:无缺失(正常);MLH1:无缺失(正常);PMS2:无缺失(正常)。 直肠腺癌:Her-2(0);MSH2:无缺失(正常);MSH6:无缺失(正常);MLH1:无缺失(正常);PMS2:无缺失(正常)。备注:肿瘤细胞呈DNA错配修复基因MSH2、MSH6、MLH1、PMS2正常染色模式,提示肿瘤为散发性。
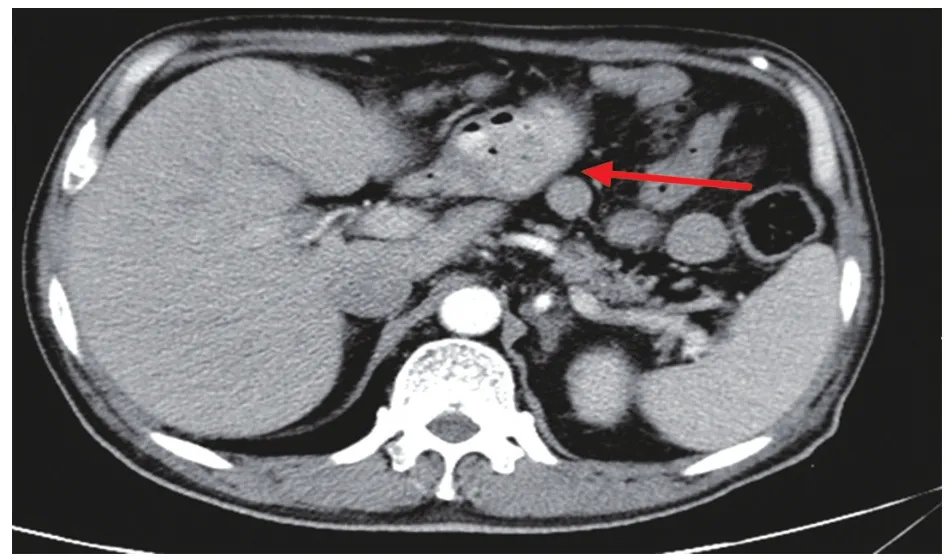
图1 箭头所指为胃肿瘤位置

图2 箭头所指为直肠肿瘤位置

图3 箭头所指为卡纳琳标记的胃肿瘤位置

图4 箭头所指为直肠肿瘤位置

图5 切除的胃标本置入无菌保护套

图6 空肠与胃大弯侧后壁行侧侧(毕Ⅱ式)吻合
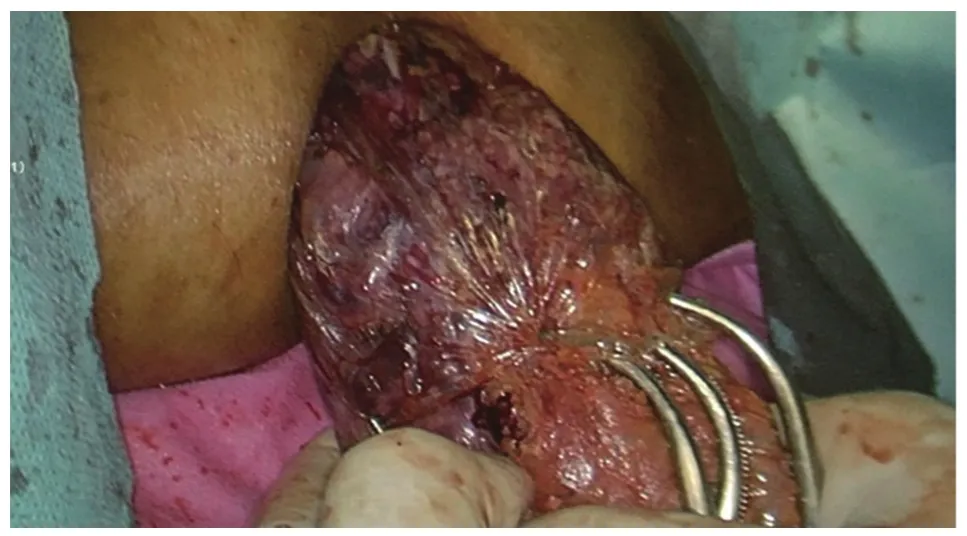
图7 经肛门拖出直肠肿瘤标本

图8 经肛门拖出胃肿瘤标
讨 论 对于晚期胃肠道肿瘤患者,快速的术后康复是至关重要的。晚期癌症患者需要术后辅助放化疗,并且由于并发症导致的术后时间延长可能导致术后辅助治疗延迟,如切口相关的并发症[3-4]。胃癌同时合并直肠癌的开腹手术,通常需要自剑突至耻骨联合上的切口,增加了患者术后出现切口疼痛、切口感染、切口疝等并发症的可能,影响下一步治疗进程。传统腹腔镜应用于胃癌及结直肠癌的外科治疗已非常成熟。但传统腹腔镜下胃癌或结直肠癌手术仍需要在腹部做辅助切口用于标本取出,再置入吻合器抵钉座完成消化道重建。而NOSES只通过腹壁5~12 mm切口进行腹腔镜下的操作,而无需任何腹部辅助切口。因此,与传统腹腔镜手术相比,NOSES因避免了取标本额外的腹部切口,从而减少了传统腹腔镜手术可能出现的术后切口疼痛、切口感染、切口疝等;术后腹部几乎无手术疤痕,美容效果较好。腹部无辅助切口减小了患者身体及心理创伤,加快了恢复进程,且NOSES由于腹壁创伤小,术后患者疼痛明显减轻,也为其早期下床活动提供了有利条件,促进了术后胃肠道功能的恢复,减少因长期卧床带来的肺部感染、静脉血栓等相关并发症的发生。此技术在标准腹腔镜手术方面的优势已在各种研究中得到证实[5-7]。
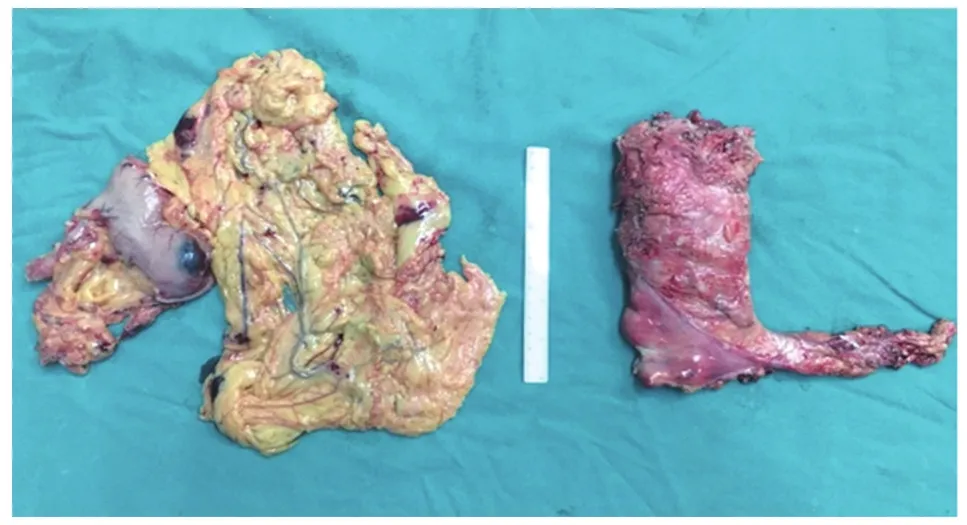
图9 全腹腔镜经肛门取出的胃+直肠肿瘤标本

图10 箭头所指为直肠乙状结肠端端吻合口
NOSES有四种可能的标本取出途径:经口、经肛、经尿道、经阴道。直肠肿瘤经肛门取出标本已得到较多应用,被认为是可行的,但考虑到感染及肠瘘的风险,经肛门胃标本取出鲜有尝试。而经尿道并不适合胃、肠等较大的病变标本。经口取出可能会伤及食道,而且只适合早期的体积较小的病变。经阴道取出只适合标本大小合适的女性患者,如果胃癌合并直肠癌,切除直肠肿瘤后,可同时经肛门拖出胃及直肠标本[8-10]。术后括约肌功能障碍、肿瘤体积较大不能经肛门途径取标本,这是其缺点。研究表明,经肛门取出标本过程中采用合适的技术可避免术后肿瘤扩散或括约肌功能损伤。本例通过经肛置入保护套分别将胃、直肠病变标本及其系膜取出,避免了与肛管直接接触,从而成功地取出标本。
NOSES结合了腹腔镜良好的操作性优势,将切除的标本经自然腔道取出,避免了腹部小切口,从而避免了传统腹腔镜手术可能出现的术后切口疼痛、切口感染、切口疝等并发症。完全腹腔镜下经自然腔道取出标本的胃癌根治术+直肠癌根治术在胃癌合并直肠癌的手术治疗中是可行的。
