动态增强磁共振成像不同药代动力学模型预测子宫肌瘤高强度聚焦超声消融效果的比较
2019-01-30周微吕富荣肖智博刘柳恒李佳
周微,吕富荣,肖智博,刘柳恒,李佳
重庆医科大学附属第一医院放射科,重庆 400016; *通讯作者 吕富荣 lfr918@sina.com
高强度聚焦超声(high intensity focused ultrasound,HIFU)消融是子宫肌瘤安全、有效的治疗方法,并在临床上广泛应用[1]。子宫肌瘤的消融效果多用消融率(non-perfused volume ratio,NPVR)的高低判断。有学者发现部分肌瘤不能达到满意的消融效果[2-3],影响消融效果的一个重要因素是肌瘤的微环境[4-5]。动态增强磁共振成像(dynamic contrastenhanced magnetic resonance imaging,DCE-MRI)是一种可以定量评估肿瘤组织微血管性质的技术[6],其基于药代动力学模型的定量分析,具有可重复性、标准化的优点[7]。DCE-MRI定量分析中可选择的药代动力学模型较多,但不同部位的病灶以及不同时间、空间分辨率情况下需要选择的最佳模型有所不同[8]。目前,已有研究采用 DCE-MRI定量分析中的Extended Tofts相关模型预测子宫肌瘤的HIFU消融疗效[9-10];同时也有研究将Reference Region(RR)模型应用于子宫肌瘤的定量分析中[11]。因此,确定适合子宫相关疾病的最佳模型成为临床正确诊断与治疗的保障。本研究拟对ETL模型和RR模型所得子宫肌瘤定量参数进行对比,以确定更加适合子宫肌瘤的模型,为临床预测HIFU的消融效果提供参考。
1 资料与方法
1.1 研究对象 收集2015年8月-2017年8月重庆医科大学附属第一医院收治的56例经超声与MRI共同诊断为子宫肌瘤的患者,年龄 24~48岁,平均(41.7±5.2)岁。所有患者行HIFU术前均行DCE-MRI检查。纳入标准:①>18岁;②绝经前或围绝经期女性;③既往无相关手术或药物治疗史;④不伴其他子宫或附件疾病;⑤未处于月经期;⑥肌瘤直径≥1 cm。排除标准:①存在MRI检查及对比剂注射禁忌证;②肌瘤严重坏死区体积≥1/2;③阔韧带肌瘤及宫颈肌瘤;④妊娠及哺乳期女性。
1.2 仪器与方法 采用GE 3.0T MR仪,8通道腹部线圈,扫描中心线位于尺骨联合上2.0 cm处。术前常规扫描以下序列,轴位T1WI:TR 150 ms,TE 1.8 ms,层厚5 mm,层间距1 mm,视野(FOV)40 cm×28 cm;T2WI:TR 4380 ms,TE 106 ms,层厚 5 mm,层间距 1.5 mm,FOV 28 cm×22.4 cm;矢状位T2WI:TR 3040 ms,TE 107.3 ms,层厚6 mm,层间距1 mm,FOV 28 cm×22.4 cm。DCE-MRI扫描:采用LAVA序列:TR 4.2 ms,TE 1.9 ms,层厚5 mm,层间距0 mm,FOV 38 cm×30.4 cm,结合轴位及矢状位T2WI图像,选取最大肌瘤的中心为扫描中心,上下共扫描44 幅图像/每期。每个多翻转角(3°、6°、9°、12°、15°)序列采集1期,动态增强扫描时先采集2期平扫作为基线期,单期时间分辨率7 s,然后以3 ml/s经肘静脉注入欧乃影(0.2 mmol/kg),再以相同速度注射生理盐水(20 ml)冲洗管道,共采集40期。延时期:轴位、矢状位LAVA序列:TR 3.8 ms,TE 1.8 ms,层厚2 mm,层间距0 mm,FOV 38 cm×30.4 cm。术后次日行MRI扫描:常规扫描同前。轴位LAVA增强包含整个盆腔,连续4期扫描,TR 4.2 ms,TE 1.9 ms,层厚2 mm,层间距0 mm,FOV 40 cm×32 cm。
1.3 超声消融治疗 患者术前禁食12 h并导泻1次,治疗当天清洁灌肠。采用JC200型聚焦超声肿瘤治疗系统(重庆海扶技术有限公司)进行治疗,声功率100~400 W,引导超声频率为3.5 MHz。患者取俯卧位,治疗前建立静脉通道、备皮、脱脂及留置导尿管,将肠道推离声通道,实施镇静镇痛。焦点置于病灶足侧面,采用超声监控肌瘤变化。当病灶出现团块状灰度变化时,根据患者耐受情况及灰度变化调整焦点位置与治疗强度;当灰度变化基本覆盖大部分治疗区域、超声造影提示消融基本满意时,停止治疗。术后常规口服抗炎药物3~5 d,并监测不良反应。
1.4 影像分析与后处理方法 将多翻转角和动态增强数据分别导入Omini Kinetics软件,先于左侧髂外动脉勾画15~30 mm2的圆形感兴趣区(ROI)作为动脉输入函数(arterial input function,AIF),然后选择ETL模型计算。平病灶最大层面勾画肌瘤轮廓,避开明显坏死、囊变、出血区,上下层面共3层得到不同参数值,包括容量转移常数(Ktrans)、速率常数(Kep)、血管外细胞外容积分数(Ve)、血浆容积分数(Vp),取平均值作为最终参数值。然后采用相同病灶ROI情况下,以相同范围的臀大肌作为AIF,尽量避开血管,选择RR模型计算得到ROI的平均参数值RR Ktrans、RR Kep、RR Vp。根据公式(1)、(2)[12]。横轴位测量肌瘤最大横径、矢状位肌瘤最大前后径和上下径。既往研究发现,HIFU术后即时消融率≥80%的肌瘤3个月后体积减少更显著[13]。故本研究中以术后肌瘤消融率达到80%为标准,将研究对象分为高消融率组和低消融率组。
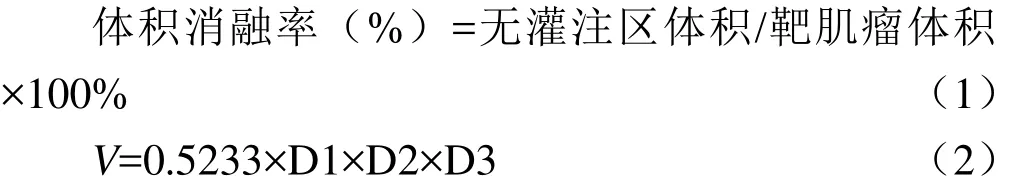
1.5 统计学方法 采用SPSS 19.0软件,对RR模型、ETL模型所得各定量参数值使用单样本Kolmogorov-Smirnov拟合优度检验分析连续数据各参数值是否为正态分布。非正态分布的计量资料采用中位数(四分位间距)表示,正态分布的计量资料以表示。采用Wilcoxon符号秩和检验比较两组对应参数的差异;各参数与肌瘤消融率间的相关性采用Pearson相关分析;高消融率组与低消融率组间各参数值的差异采用Mann-WhitneyU检验分析,P<0.05表示差异有统计学意义。采用受试者工作特征(ROC)曲线分析不同模型有意义的参数值预测肌瘤 80%消融率的曲线下面积(AUC)、最大约登指数、最佳阈值及敏感度、特异度。
2 结果
2.1 消融率及各参数的相关性分析 本组患者肌瘤消融率为 31.9%~98.5%,平均(71.00±18.28)%。Ktrans、Kep、Ve、Vp和 RR Ktrans、RR Kep、RR Vp均与消融率呈负相关(P<0.05),见图1。
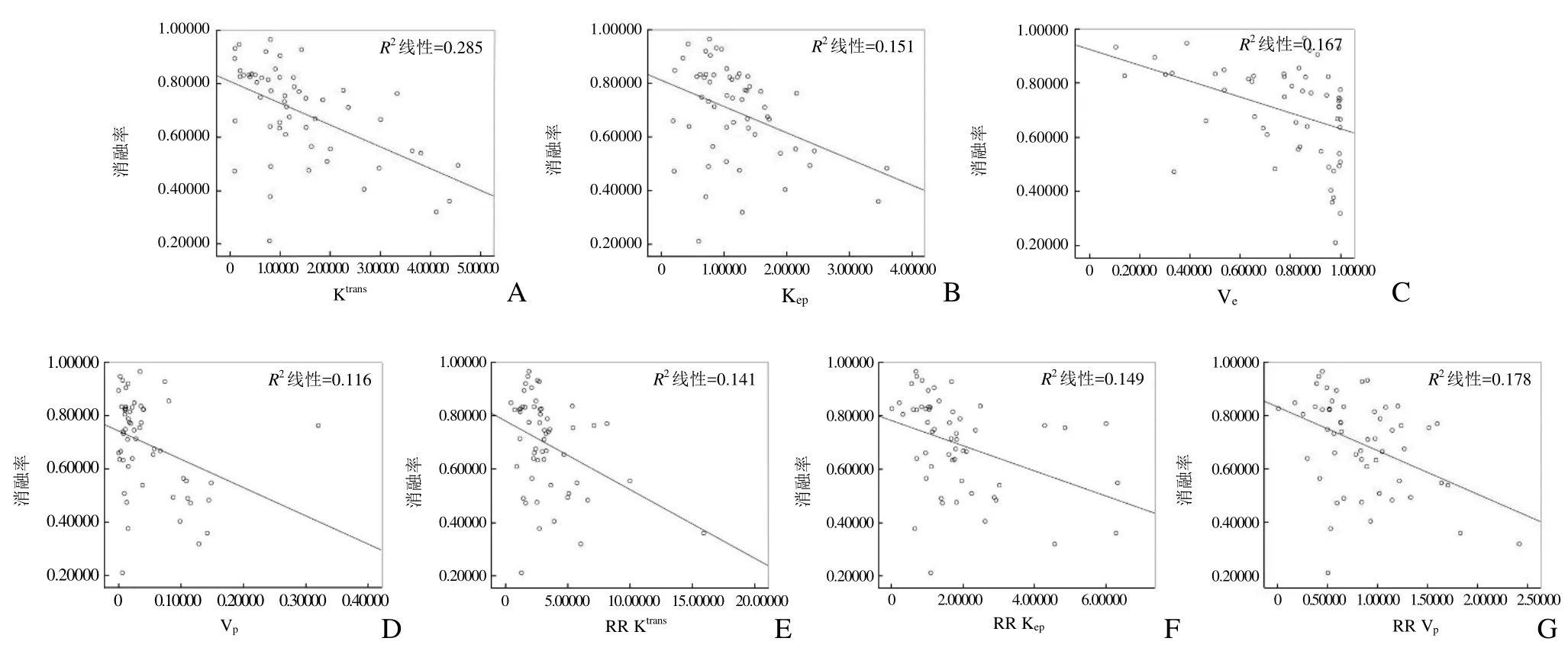
图1 ETL与RR模型中各参数与子宫肌瘤HIFU消融效果的相关性。A~G分别为Ktrans、Kep、Ve、Vp、RR Ktrans、RR Kep、RR Vp与消融率的相关曲线
2.2 不同消融率组各参数比较 高消融率组与低消融率组 Ktrans、Kep、Ve、RR Ktrans、RR Kep、RR Vp比较,差异均有统计学意义(P<0.05);两组Vp差异无统计学意义(P>0.05),见表1。
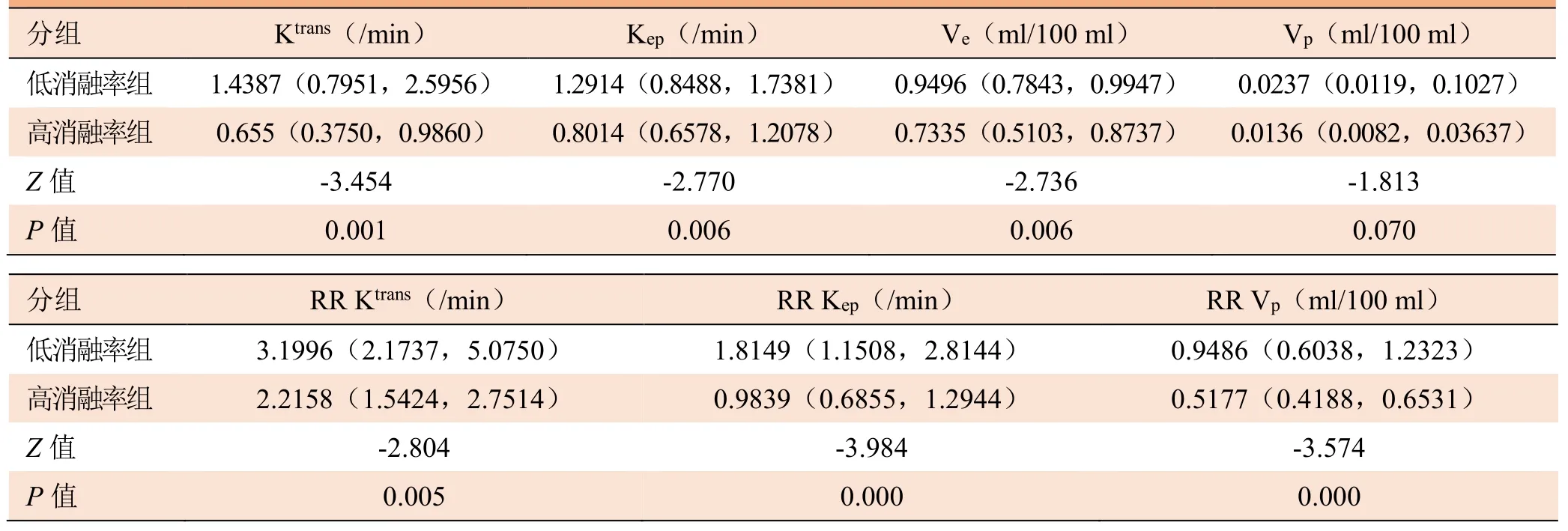
表1 高消融率与低消融率两种模型定量参数比较[中位数(四分位间距)]
2.3 不同参数的诊断效能比较 组间差异有统计学意义的参数值预测子宫肌瘤HIFU消融80%消融率的诊断效能见表2、图2,其中RR Kep曲线下面积及最大约登指数均最大。
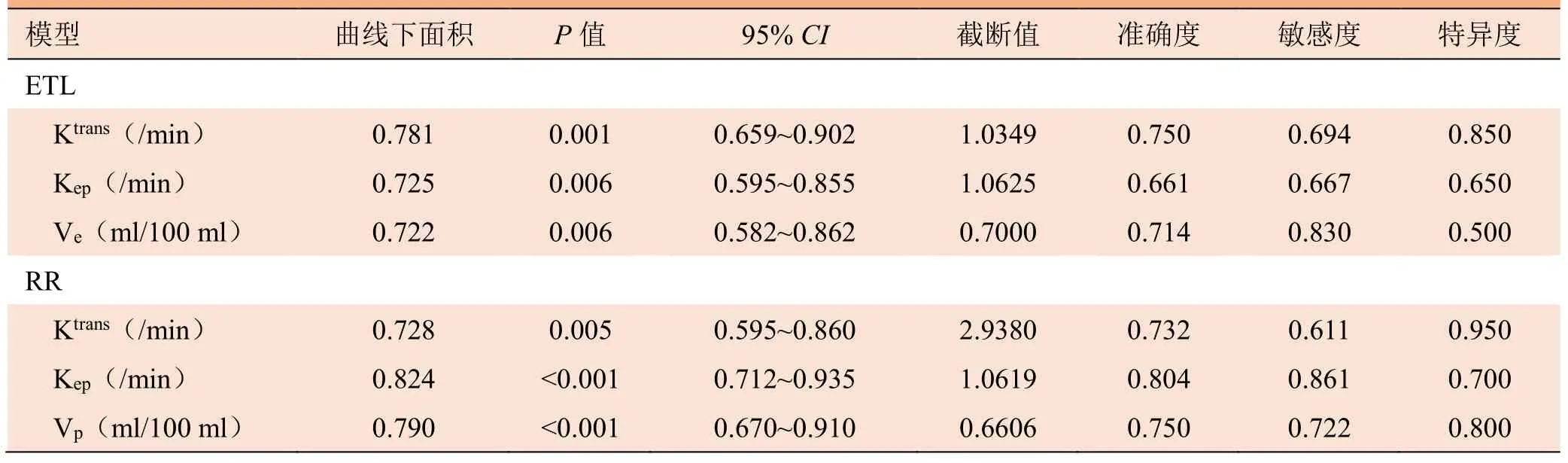
表2 不同模型的DCE-MRI定量灌注参数鉴别子宫肌瘤不同消融率的诊断效能
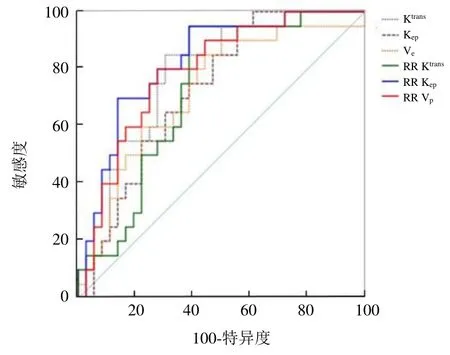
图2 两种模型定量参数值预测子宫肌瘤 80%消融率的ROC曲线
3 讨论
DCE-MRI定量分析是一种可以通过各种参数值和参数图反映组织血流动力学情况的方法[14],其可选择的药代动力学模型较多,但不同模型各自的特点与适用的疾病不同,临床需要选择最适合的模型以确保诊断的可靠性。目前,用于子宫肌瘤研究的主要模型包括ETL和RR模型。本研究发现,这两种模型均可用于预测子宫肌瘤HIFU消融效果,但各参数的诊断效能存在差异。
本研究结果显示,ETL模型和RR模型参数Ktrans与RR Ktrans、Kep与RR Kep、Vp与RR Vp之间差异均有统计学意义,可能是由于ETL模型属于血管模型,而RR模型属于肌肉参考模型,两种模型选择的AIF不同,对时间、空间分辨率要求也不同。AIF曲线的斜率和峰值决定计算模型中的输入参数,AIF的选择至关重要[15]。ETL模型是选取同一层面病灶旁血管的时间-浓度曲线作为AIF,其对时间、空间分辨率的要求均较高(通常要求≤6 s);而RR模型使用参考区域的时间-浓度曲线代替动脉输入函数,得到相对较血管更为平滑的曲线,从而得到ROI相对于参考区域的渗透性参数,其最大优势是可用于低时间分辨率(通常<40 s)情况下的定量分析[16]。通常较高的时间分辨率可提供更准确的肿瘤内部血流信息;较高的空间分辨率则利于观察较小肿瘤灶的形态特点。由于时间分辨率和空间分辨率相互制约,在临床工作中需要一种可以兼顾准确观察肿瘤内部血流信息及较小肿瘤特征的要求,故本研究采用时间分辨率为7 s。本研究结果显示,Ktrans、Kep、Vp和 RR Ktrans、RR Kep、RR Vp均与消融率呈负相关,且上述参数在高消融率组和低消融率组间差异均有统计学意义。以上参数均可反映病灶组织内部的血流信息。Kim等[5]报道,血流丰富的肌瘤组织可因血流带走聚焦超声产生的热量而影响消融效果。其中,Ktrans反映了对比剂由血管内向血管外细胞外空间(extravascular extracellular space,EES)的渗透速率,而RR Ktrans是ROI相对于参考组织对比剂从血浆渗透到 EES的渗透速率,是反映肿瘤组织的微血管状态,其数值由组织血容量、内皮细胞表面积和渗透性共同决定[17]。多数实体肿瘤的营养来源于新生血管,这些新生血管的病理生理状态使得肿瘤组织具有不同的渗透性[18]。Ktrans、RR Ktrans值越高,表明肌瘤渗透性越高,其消融率越低,与既往研究结果一致[5]。Kep值由Ktrans衍生而来,是对比剂由EES向血管内反流的速率,RR Kep为ROI相对于参考组织渗透到 EES内的对比剂分子回渗入血管的速率,同样可以反映血管渗透性。肌瘤Kep与RR Kep值越高,表明其血管密度、渗透性较高,其消融率越低。Vp和 RR Vp即对比剂的血浆容积,反映平均增强血管密度,对灌注血管敏感[19]。本研究发现,RR模型所得RR Vp在高消融率组与低消融率组间差异有统计学意义,但两组Vp差异无统计学意义,考虑可能与样本量较小有关。ETL模型中Ve值表示细胞外血管外对比剂容积。徐曦等[20]在前列腺相关研究中发现,肿瘤细胞的数目多则EES小,Ve值也相应地减小。王苏波等[21]研究认为 Ve在不同病理亚型的子宫肌瘤间无明显差异,可能与病变周围水肿相关。Mills等[22]研究发现,肿瘤组织内部囊变、坏死、纤维化、水肿等可以影响Ve值的测量;而本研究结果显示Ve值与消融率呈负相关,且 Ve在高消融率及低消融率肌瘤中差异有统计学意义,可能是由于本研究在勾画ROI时尽量避开坏死、水肿等区域,并取包括病灶上、下两层共3层参数值的平均值作为最终参数值,从而尽可能地排除上述因素的影响。
本研究发现,RR模型中RR Kep值预测肌瘤80%消融率的诊断效能ROC曲线下面积及最大约登指数均最大,其敏感度和特异度分别为0.861、0.700,表明在上述有意义参数中RR Kep的预测效能最佳。RR模型中RR Vp值的ROC曲线下面积次之,敏感度和特异度尚可,提示RR Vp的预测效能较好。RR模型中 RR Ktrans的 ROC曲线下面积小于 ETL模型中Ktrans,但 Ktrans的敏感度稍高,RR Ktrans的特异度稍高,预测效能较RR Vp低。ETL模型所得Ve值的敏感度较高,但特异度偏低。本研究在特定时间和空间分辨率情况下计划与实施;后续研究将进一步探讨在其他时间、空间分辨率的情况下,不同模型的诊断效能及重复性。
总之,基于ETL模型和RR模型的DCE-MRI定量分析技术能有效预测子宫肌瘤HIFU的消融效果。动态增强ETL模型和RR模型定量分析预测子宫肌瘤高强度聚焦超声消融的疗效中,由RR模型计算所得RR Kep的预测效能最佳。
