有氧运动训练中补充Apelin对骨骼肌AMPK活化及线粒体能量代谢的影响
2019-01-30李铁瑛张缨
李铁瑛,张缨
有氧运动训练中补充Apelin对骨骼肌AMPK活化及线粒体能量代谢的影响
李铁瑛,张缨
(北京体育大学 运动生物化学教研室,北京 100084)
目的:探讨有氧运动训练补充apelin对骨骼肌AMPK活化及线粒体能量代谢的影响。方法:1)细胞实验部分采用小鼠骨骼肌C2C12细胞系作为研究对象,将靶向AMPKα基因的小干扰RNA(AMPKα siRNA)或阴性对照小干扰RNA(Control siRNA)通过脂质体介导转染细胞。转染48 h后,进行6 h的饥饿处理,而后在完全培养基中加入apelin-13(100 nmol/L)或者同体积的PBS与细胞孵育6 h。按转染siRNA和加apelin-13情况,实验分为Control siRNA+PBS组、Control siRNA+apelin组、AMPK siRNA+PBS组与AMPK siRNA+apelin组。完成干预后,采用Seahorse细胞能量代谢分析系统,测定细胞线粒体基础呼吸、ATP生成和呼吸功能变化。2)动物实验部分采用C57BL/6J小鼠做为研究对象,将40只小鼠随机分为安静未注射组、安静注射apelin组、运动未注射组和运动注射apelin组,每组10只。注射apelin组小鼠连续4周腹腔注射apelin-13(0.1 μmol /kg体重/天)。运动组采用75%左右最大摄氧量强度(1~2周坡度5º,速度15 m/min;3~4周坡度5º,速度20 m/min)、1 h/天、6天/周、持续4周的跑台运动。最后一次运动后休息48 h,脱颈处死,取两侧股四头肌。Western Blotting测定骨骼肌apelin、APJ、AMPKα、p-AMPKα(Thr172)和COX Ⅳ蛋白表达。结果:1)细胞实验,Control siRNA+apelin组与Control siRNA+PBS组相比,细胞基础呼吸率、线粒体ATP生成和最大呼吸率均显著增加;而AMPK siRNA+apelin组与Control siRNA+apelin组相比,线粒体ATP生成和最大呼吸率显著降低。2)动物实验,安静注射apelin组与安静未注射组相比、运动注射apelin组与运动未注射组相比,小鼠骨骼肌apelin、APJ、COX Ⅳ蛋白表达和p-AMPKα/AMPKα比值均显著增加。结论:外源性补充apelin可显著增加C2C12细胞AMPK介导的线粒体呼吸功能,并提高有氧运动训练小鼠骨骼肌apelin/APJ、AMPKα磷酸化和COX IV蛋白表达,提示,有氧运动训练补充apelin可能对骨骼肌的apelin-AMPK通路及其介导的线粒体能量代谢有一定的积极促进作用。
apelin;AMPK;有氧运动;线粒体;骨骼肌
骨骼肌作为机体最大的能量消耗器官,在运动中发挥重要的能量代谢调节作用。Apelin是G蛋白偶联受体APJ的内源性配体(O'Dowd et al.,1993;Katugampola et al.,2001),广泛表达于人和鼠的脂肪、心脏和骨骼肌等组织器官中(Masri et al.,2005;De Falco et al.,2002),在调节心血管功能、胰岛素分泌、食物和水摄取等方面具有多种生物学效应(Gilbert,2017;Taheri,2002)。近年来apelin/APJ在机体(特别是骨骼肌)能量代谢调节中的作用引起了人们的关注(Indrakusuma et al.,2015;Bajer et al.,2015)。已有研究报道,急性或者慢性补充apelin可以促进骨骼肌葡萄糖利用、脂肪酸氧化和线粒体生物合成(Isabelle et al.,2011)。并且一些学者认为,apelin是细胞能量感受器——腺苷酸活化蛋白激酶(AMPK)的上游调节者。通常磷酸化AMPKα(p-AMPKα(Thr172))蛋白表达量表示AMPK激活程度或活性(Li et al.,2017)。Apelin可通过激活AMPK,增加p-AMPKα(Thr172)蛋白表达,提高骨骼肌的线粒体生物合成、糖吸收和脂肪酸氧化(Dray et al.,2008)。但也有报道认为,外源性补充apelin促进骨骼肌线粒体能量代谢物调节并非依赖于AMPK(Frier et al.,2009)R1765。
运动缺乏是导致肥胖、2型糖尿病和心血管疾病等的重要风险因素(Booth et al.,2012)。长期有氧运动产生的健康效益至少部分取决于肌肉因子的产生(Son et al.,2018)。新近研究发现,运动训练可增加人体骨骼肌apelin mRNA的表达,apelin被认为是运动产生的肌肉因子(Besse et al., 2014)709-710。然而,在有氧运动训练中补充apelin对骨骼肌apelin/AJP表达、AMPK活化和线粒体能量代谢的影响,以及AMPK在其中的调节作用,目前尚未见相关报道。
因此,本研究试图首先采用C2C12骨骼肌成肌细胞系,通过小干扰RNA(small interfering RNA,siRNA)转染沉默细胞中的AMPKα,观察给予apelin对细胞线粒体呼吸功能的影响;而后通过动物实验,给予小鼠4周有氧训练并腹腔注射apelin,观察骨骼肌中apelin、APJ、p-AMPKα和细胞色素C氧化酶亚基IV(COX IV)蛋白表达的变化。本研究将深入探讨有氧运动训练介导apelin调控骨骼肌能量代谢及与AMPK的关系,为有氧运动促进健康的效应机制提供进一步理论依据。
1 材料与方法
1.1 细胞实验
1.1.1 研究对象与方法
C2C12小鼠骨骼肌成肌细胞系,购自于上海中乔新舟生物科技有限公司。
1.1.2 采用AMPKα siRNA转染C2C12细胞
使用含10% Gibco FBS(Thermo Fisher,USA)的DMEM高糖培养基(HyClone,USA),于5% CO2细胞培养箱中培养C2C12细胞。待细胞生长至80%融合度,PBS清洗3遍,加入0.25%胰蛋白酶消化液,待细胞消化完全,加入2mL新的10% FBS完全培养液制成悬浊液,终止消化。将细胞悬浊液转移至15 mL离心管内,1 000 rpm转离心3 min。弃去上清,加入2 mL新的10% FBS完全培养液制成悬浊液,计数,将悬浊液稀释成20×104个/mL的密度,按照每孔2.5 mL的量种板至6孔板中。待细胞生长至60%~80%汇合时,按照LipofectamineTMRNAiMAX(Thermo Fisher,USA)操作步骤进行转染。细胞被分为Control siRNA和AMPKα siRNA组。6孔板每孔RNAiMAX转染试剂和Control siRNA(SC-37007, Satan Cruz)或AMPK siRNA(SC-45313,Satan Cruz)试剂用量比例为1:1:1,均为9 μL。
1.1.3 C2C12细胞线粒体呼吸功能测定
细胞转染48 h后,按上述步骤消化细胞,制成细胞悬液;计数,用新的完全培养基稀释成密度为16×104个/mL(正常种板密度的80%)的细胞悬浊液。进而,细胞种板到美国Seahorse XFe细胞能量代谢分析系统(Seahorse Bioscience,USA)配套特制的96孔板中,室温放置1 h后放回培养箱中继续培养。待细胞生长至80%左右,将培养板中的完全培养基换成DMEM,进行6 h细胞饥饿处理。之后,将Control siRNA和 AMPK siRNA组细胞进一步分为加入PBS和apelin-13(Sigma,USA)组。PBS和apelin-13组每孔内分别加入20 ul PBS和20 ul apelin-13溶液(浓度为100 nmol/L),孵育6 h。6 h后取出96孔板,按照Seahorse说明书步骤操作,测定C2C12细胞线粒体呼吸功能。其中采用的药品浓度分别为:寡霉素(Oligomycin,2μmol/L)、三氟甲氧基苯腙羰基氰化物(FCCP,1μmol/L)、抗霉素(Antimycin,1μmol/L) 和鱼藤酮(Rotenone,1μmol/L)。
1.2 动物实验
1.2.1 对象与分组
健康8周龄的C57BL/6J小鼠40只[购自北京维通利华实验动物技术有限公司,动物许可证:SCXK(京)2015-0001],体重18±2 g。将小鼠随机分为安静组和运动组,进一步再分别分为未注射apelin组(No apelin,N)和apelin-13(Sigma,USA)apelin注射组(Apelin,A),每组10只。
Apelin注射组采用腹腔注射方式给予apelin,注射剂量为0.1μmol/kg体重/天。注射时间为每天11:00,持续28天。运动组采用75%左右最大摄氧量强度(1~2周坡度5º,速度15 m/min;3~4周坡度5º,速度20 m/min),1 h/天,6天/周,持续4周的跑台运动。安静组不施加任何运动负荷,正常饲养。
小鼠分笼饲养,每笼3~4只,室内温度20℃~25℃,相对湿度50%~70%,光照12 h/天(7:00~19:00),采用国家标准啮齿类动物饲料饲养,自由进食和饮水。最后一次运动后休息48 h,脱颈处死。取两侧股四头肌,迅速称量,锡纸包裹,标记编号,立刻投入液氮。取材完成后,转入-80℃冰箱,保存待用。
1.2.2 Western blotting测定蛋白表达
取50 mg骨骼肌加入500 μL含有蛋白酶和磷酸酶抑制剂(Thermo Fisher,USA)的RIPA裂解液(碧云天,中国)中。使用匀浆机充分匀浆,于冰上静置30 min,其间每隔10 min涡旋振荡10 s;4℃、12 000 rpm离心30 min;取样品上清即为总蛋白,于-20℃冻存备用。
采用BCA蛋白浓度试剂盒(Thermo Fisher,USA)测定骨骼肌的总蛋白浓度。按照每个样品上样蛋白总量20 μg,计算上样体积。采用Bolt 4%~12% Bis-Tris Plus凝胶(Life technologies,USA),电泳分离目的蛋白及内参。而后,采用转膜胶(iBlot®2 NC Regular Stacks,USA)于iBlot Gel Transfer System(Life technologies,USA)转膜。5%的脱脂牛奶封闭1 h,加一抗于层析柜中孵育过夜。一抗稀释比例依次为apelin(1:1 000,Satan Cruz,SC-33823),APJ(1:1 000,Satan Cruz,SC-29341),AMPKα(1:500,Satan Cruz,SC-74461),p-AMPKα(Thr172)(1:1 000,Satan Cruz,SC-33524),COX Ⅳ(1:2 000,Abbkine,A01060),内参β-actin(1:1 000,Santa Cruz,SC-47778)。次日,1×TBST洗膜3次,每次10 min。之后加1×TBST稀释的二抗,二抗稀释比例:羊抗兔(1:40 000,Thermo Fisher,31460)、羊抗小鼠(1:40 000,Thermo Fisher,31430)。室温摇床摇晃孵育1 h。1×TBST洗膜3次,每次10 min。条带加ECL western blot substrate(Life technologies,USA)发光液,放入曝光机(Bio-Rad ChemiDocTMXRS+,USA)曝光。用仪器自带分析软件,读取条带相对灰度值,计算结果。其结果计算公式如下:

1.3 统计方法
使用 SPSS 17.0 统计软件对实验数据进行处理,采用双因素方差分析数据,实验结果用±表示。<0.05表示统计学上有意义,<0.05表示有显著性;<0.01表示有非常显著性。
2 实验结果
2.1 细胞实验
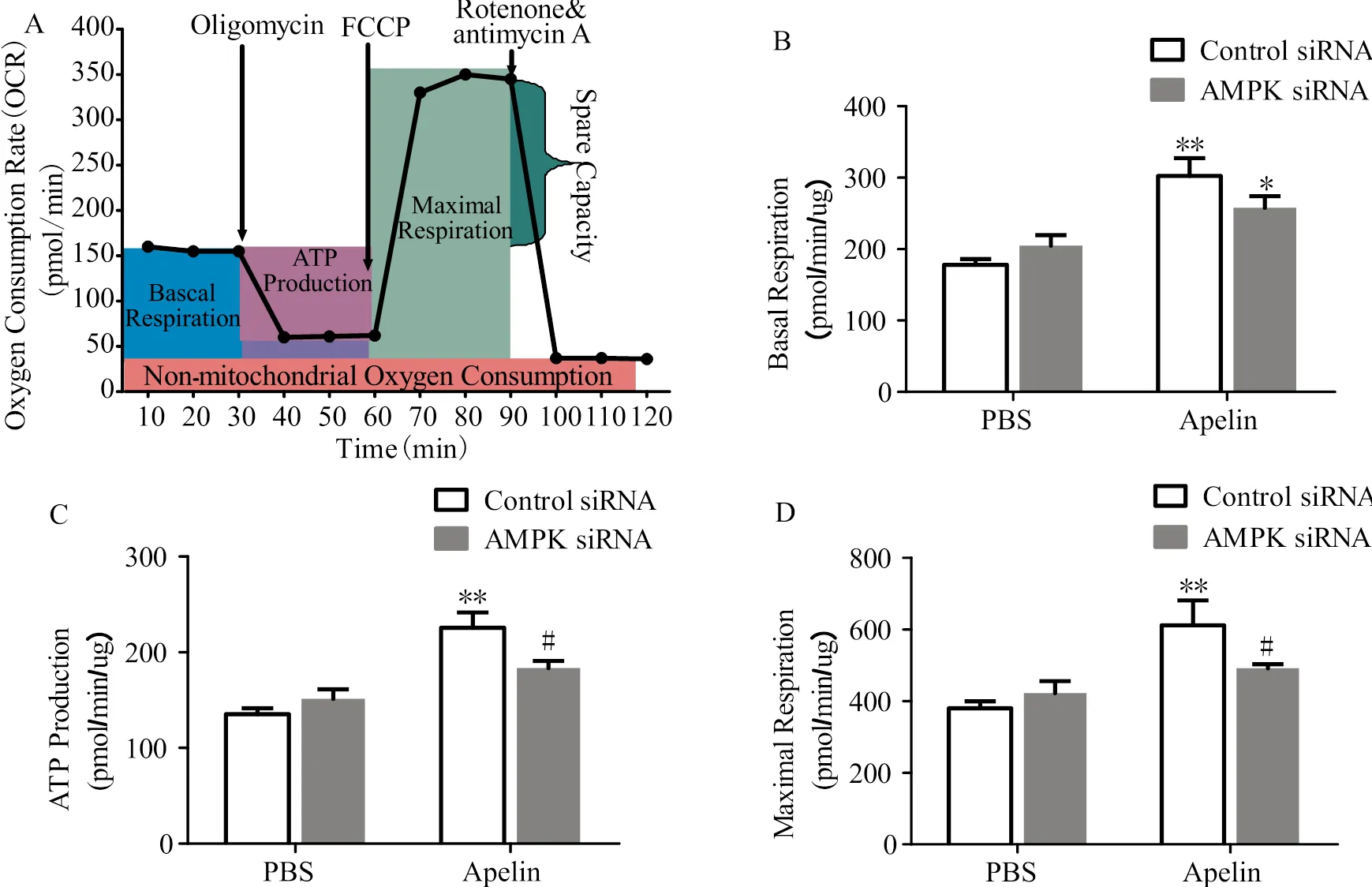
图1 各组细胞线粒体呼吸功能
Figure 1. Mitochondrial Oxygen Consumption Rate
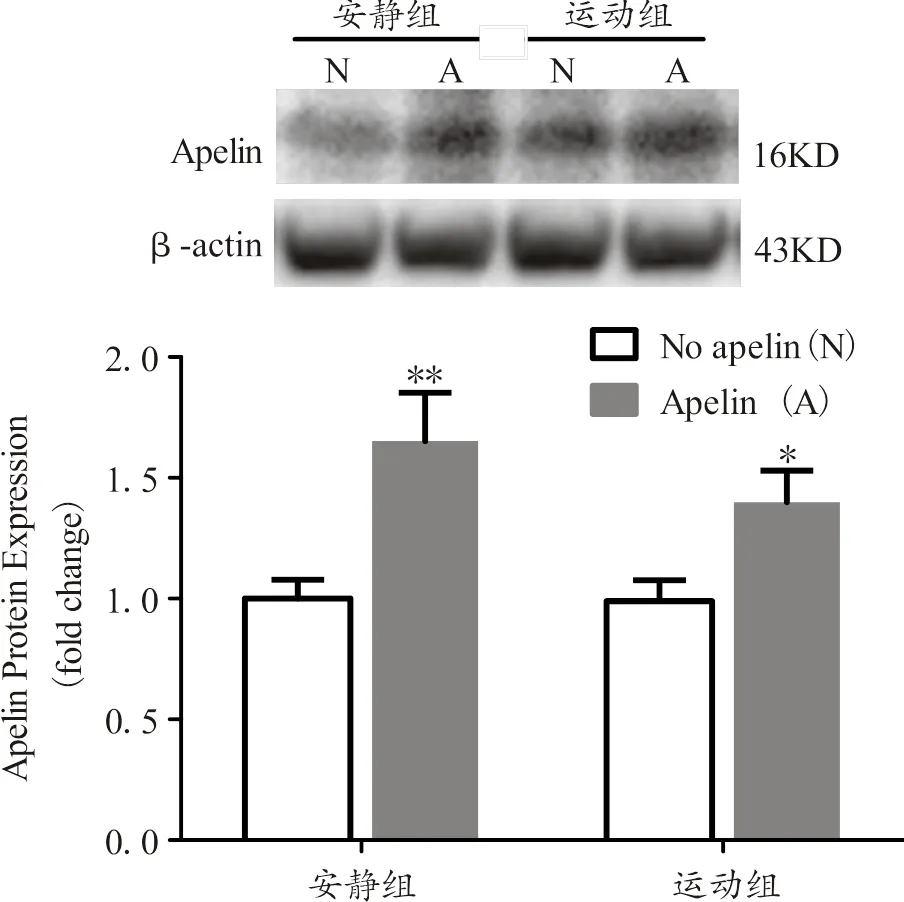
注:*和**分别表示与相应未注射组相比P<0.05和P<0.01;下同。
Figure 2. Apelin Protein Expression in Skeletal Muscle of Mice
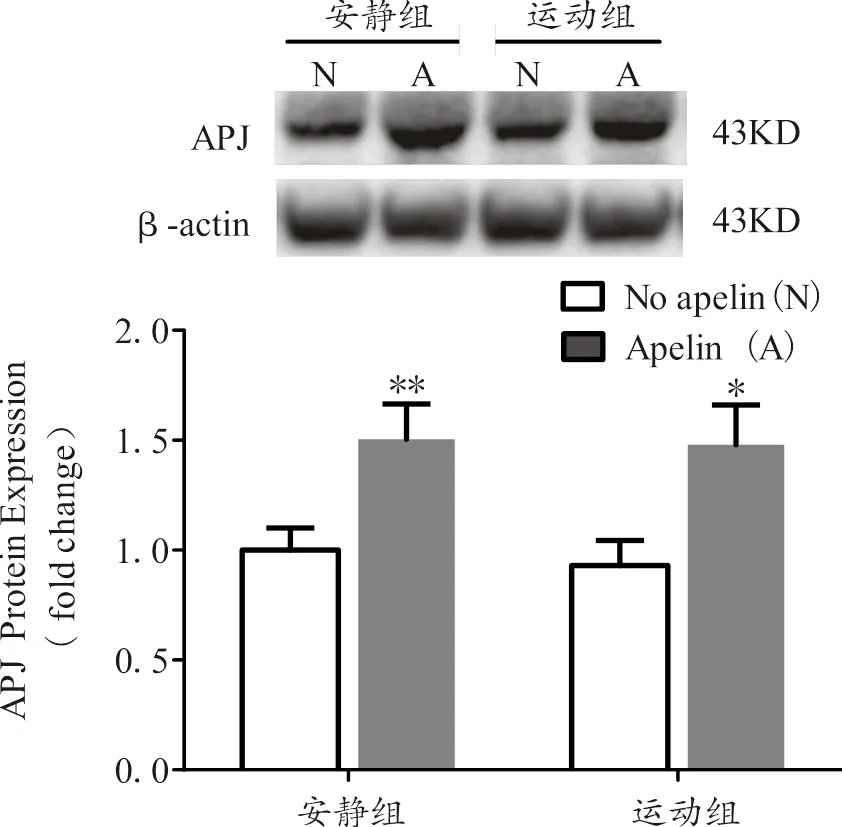
图3 各组小鼠骨骼肌APJ蛋白相对表达量
Figure 3. APJ Protein Expression in Skeletal Muscle of Mice
图1A是Seahorse测定线粒体氧化速率过程示意图。由图1B可知,Control siRNA+apelin组与Control siRNA+PBS组相比,线粒体基础呼吸率显著增加;AMPK siRNA+apelin组与AMPK siRNA+PBS组相比,基础呼吸率显著增加。由图1C、D可知,Control siRNA+apelin组与Control siRNA+PBS组相比,线粒体ATP生成和最大呼吸率均显著增加;且AMPK siRNA+apelin组与Control siRNA+apelin组相比,线粒体ATP生成和最大呼吸率均显著降低。
2.2 动物实验
2.2.1 骨骼肌apelin蛋白相对表达
由图2可知,安静注射apelin组与其未注射组相比,小鼠骨骼肌apelin蛋白表达显著增加;运动注射apelin组与其未注射组相比,小鼠骨骼肌apelin蛋白表达也显著增加。
2.2.2 骨骼肌APJ蛋白相对表达
由图3可知,安静注射apelin组与其未注射组相比,小鼠骨骼肌APJ蛋白表达显著增加;运动注射apelin组与其未注射组相比,小鼠骨骼肌APJ蛋白表达显著增加。
2.2.3 骨骼肌AMPKα、p-AMPKα蛋白相对表达及其比值
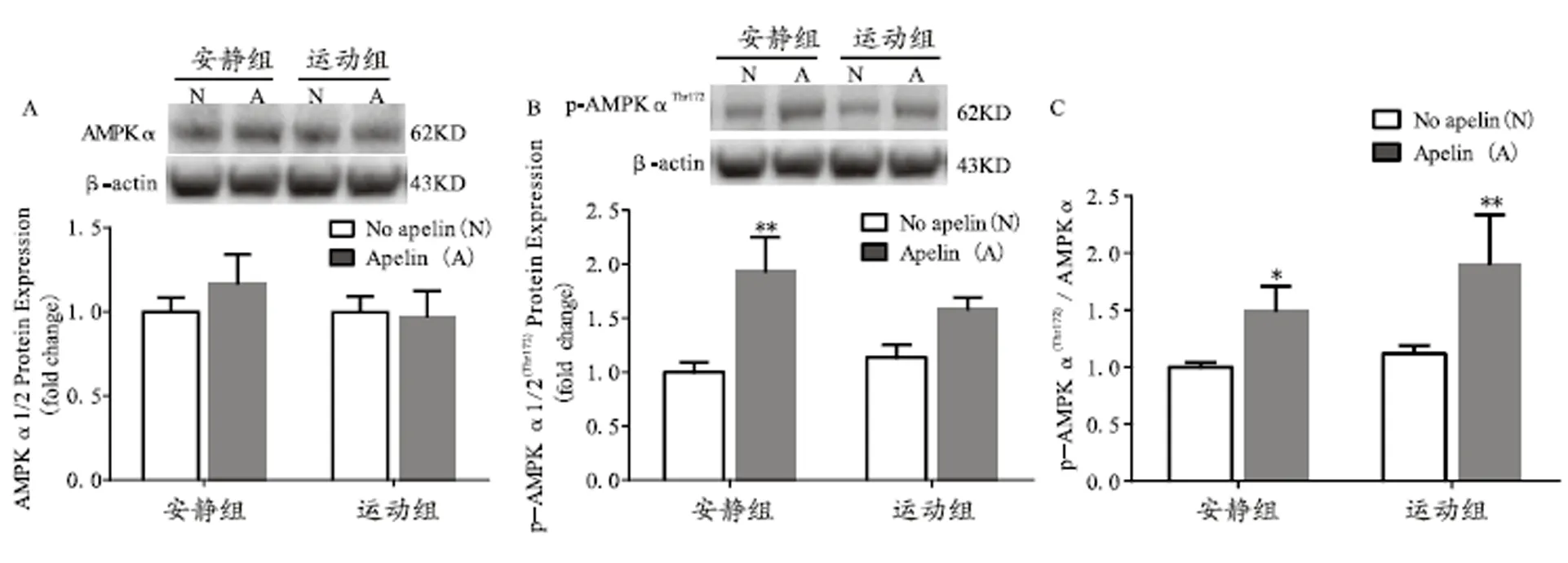
图4 各组小鼠骨骼肌AMPKα、p-AMPKα蛋白相对表达量及其比值
Figure 4. AMPKα、p-AMPKα Protein Expression and their Ratio in Skeletal Muscle of Mice
由图4C可知,安静注射apelin组与其未注射组相比,小鼠骨骼肌p-AMPKα/AMPKα比值显著增加;运动注射apelin组与其未注射组相比,小鼠骨骼肌p-AMPKα/AMPKα比值显著增加。
2.2.4 骨骼肌 COX Ⅳ蛋白相对表达
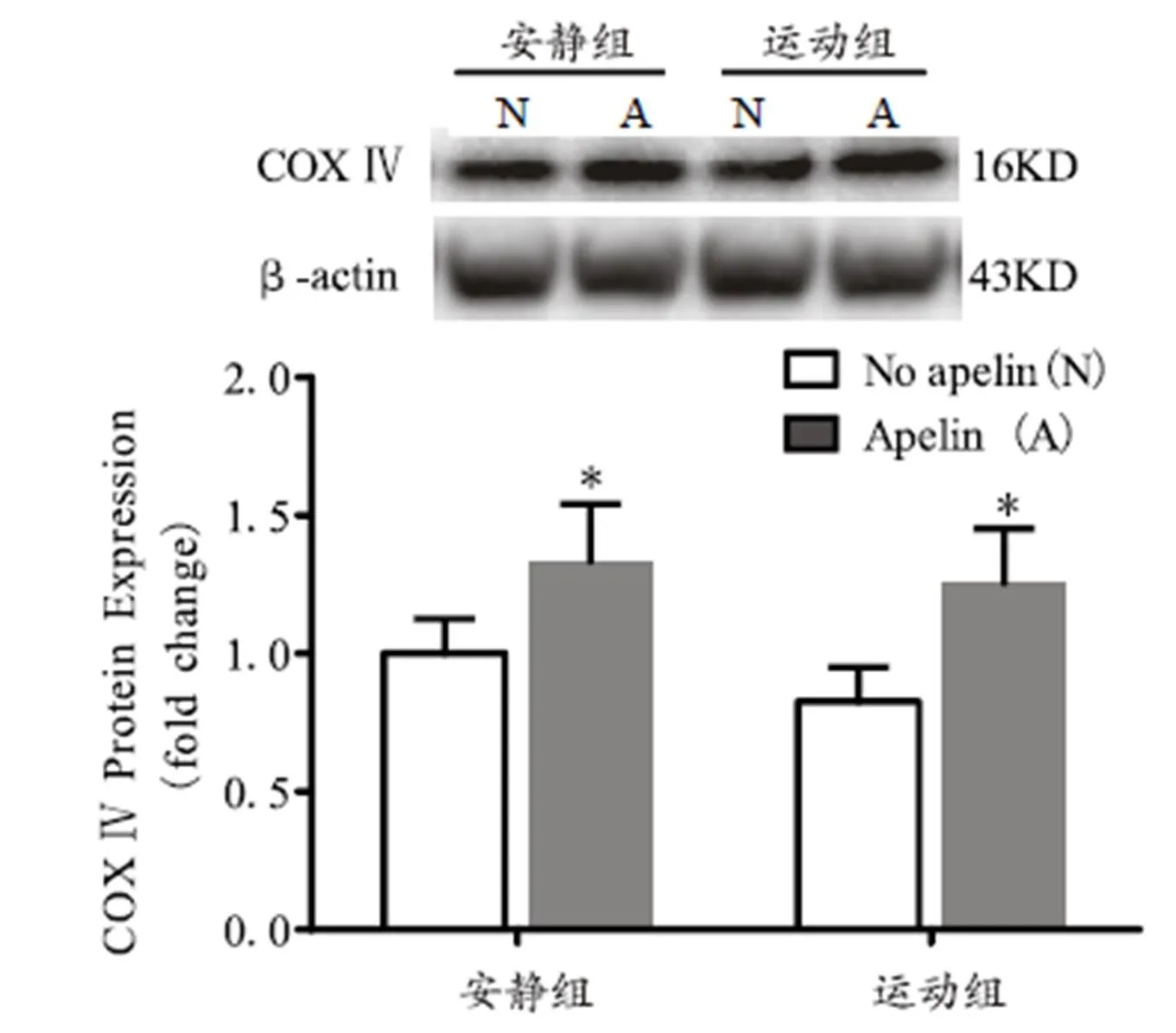
图5 各组小鼠骨骼肌COXⅣ蛋白相对表达量
Figure 5. COX Ⅳ Protein Expression in Skeletal Muscle of Mice
由图5可知,运动注射apelin组与其未注射组相比,小鼠骨骼肌COX Ⅳ蛋白表达显著增加。
3 分析讨论
3.1 AMPK在apelin调节C2C12细胞线粒体呼吸功能中的作用
Apelin能够调节骨骼肌中的线粒体氧化能力及其生物合成。实验表明,apelin 能够增强线粒体能量代谢。高脂饮食小鼠连续腹腔注射apelin-13(0.1 μmol/kg体重/天)28天后,离体测定小鼠离体的比目鱼肌氧耗量。结果表明,apelin注射组的氧耗量显著高于PBS组(Attane et al.,2012)。1 μmol/L的apelin孵育24 h后,脂肪细胞中的PGC-1α、COX I和SDHA等线粒体生物合成相关蛋白表达显著增加(Than et al.,2014)。采用普通大鼠连续2周腹腔注射apelin-13,其股三头肌中的柠檬酸合酶、COX IV和β-羟酯酰辅酶A脱氢酶(β-HAD)的活性显著增加,并且核编码线粒体蛋白基因和线粒体编码的COX IV和COX I表达也显著增加(Frier et al.,2009)R1764。高脂饲养apelin 转基因(TG)和野生(WT)鼠20周后,TG鼠比WT鼠的骨骼肌线粒体数量显著增加,且肌纤维中I型(氧化型)肌纤维比例显著提高(Yamamoto et al.,2011)860-861。
AMPK是机体能量代谢调节中心,而线粒体是细胞的能量工厂。研究表明,AMPK可以通过调节线粒体数量和提高线粒体内的酶活性等途径增强线粒体能量代谢(Abbott et al.,2014; Marcinko et al.,2014; Wu et al.,1999)。关于apelin调节骨骼肌能量代谢是否通过AMPK作用,目前仍有争议(Frier et al.,2009R1765; Bertrand et al.,2015)。本细胞实验结果显示,AMPK siRNA+apelin与Control siRNA+apelin组相比,ATP转换率和最大呼吸能均显著降低。表明AMPK沉默显著可降低apelin补充介导的C2C12细胞线粒体呼吸功能,AMPK可直接参与apelin对C2C12细胞能量代谢的调节。另外,AMPK siRNA+PBS组与Control siRNA+PBS组相比,线粒体呼吸功能无显著性变化。这一结果与他人的一些研究相一致(Wang et al.,2014; Fentz et al.,2015)。一篇采用脂肪细胞的研究,通过AMPKα siRNA敲低脂肪细胞发现,其线粒体呼吸功能与正常脂肪细胞无差异(Wang et al.,2014)。另一篇对AMPK敲除小鼠的动物实验表明,AMPK敲除鼠每日耗氧量和呼吸交换率与野生鼠相比也无显著性差异(Fentz et al.,2015)。以上结果均表明,无外源性补充apelin的状态下,沉默AMPKα对线粒体呼吸功能影响不大。
3.2 有氧运动训练补充apelin对骨骼肌apelin、AMPKα磷酸化和COX IV表达的影响
3.2.1 有氧运动训练和apelin补充对骨骼肌apelin/APJ的影响
APJ作为apelin的受体,其在组织中的表达变化与apelin基本一致。文献已表明,apelin转基因小鼠、补充apelin或敲除apelin基因,其骨骼肌(Yamamoto et al.,2011)859、血管内皮(Strohbach et al.,2018)、心肌细胞(Bi et al.,2018)、黄体细胞(Różycka et al.,2018)、脂肪细胞(Than et al.,2014)等组织中,APJ蛋白表达量随apelin表达量增减而变化。尽管新近研究表明,运动可引起apelin mRNA表达增加,被认为是新发现的运动引起的肌肉因子(Besse et al.,2014709-712; Yang et al.,2015),但目前的研究结果并不完全相同。例如,有研究报道,Zuker大鼠进行6周跑台耐力运动训练后,比目鱼肌中的apelin蛋白表达显著性降低,而趾长伸肌中apelin蛋白表达未发生变化(Son et al.,2017)。本实验研究发现,无论注射apelin还是未注射apelin,4周有氧训练小鼠股四头肌中apelin和APJ的蛋白表达并未发生显著变化。推测这是否与4周有氧运动的时间不足或取材的肌纤维类型不同时间点有关,但仍有待进一步确定。
进而,无论是安静还是运动组,补充apelin均可促进骨骼肌apelin和APJ的蛋白表达。说明在本实验中补充apelin(0.1 μmol/kg体重/天,28天)比运动训练对骨骼肌apelin/ AJP蛋白表达的作用更强。
3.2.2 有氧运动训练补充apelin对骨骼肌AMPKα磷酸化和COX IV表达的影响
已有一些文献报道,外源性补充apelin可增加骨骼肌AMPKα磷酸化蛋白表达(Yue et al.,2010; Vinel et al.,2018)。在本实验中的研究结果与其一致,并且在运动训练中补充apelin同样可促进AMPKα活化。COX IV是线粒体中电子传递链的末端酶,催化电子从细胞色素C转移到氧,对线粒体能量代谢至关重要(Oliva et al.,2015)。AMPK可调节COXIV的表达,进而增强线粒体的呼吸功能(Ritchie et al.,2014)。本研究中有氧运动训练补充apelin,可进一步增加骨骼肌COX IV蛋白表达,表明有氧运动训练补充apelin可能通过骨骼肌apelin/APJ-AMPK活化-COX IV蛋白表达这一信号通路,对线粒体进行调节作用。
4 结论
外源性补充apelin可显著增加C2C12细胞AMPK介导的线粒体呼吸功能,并提高有氧运动训练小鼠骨骼肌apelin/ APJ、AMPKα磷酸化和COX IV蛋白表达。提示,有氧运动训练补充apelin可能对骨骼肌的apelin-AMPK通路及其介导的线粒体能量代谢有一定的积极促进作用。
ABBOTT M J, TURCOTTE L P,2014. AMPK-a2 is involved in exercise training-induced adaptations in insulin-stimulated metabolism in skeletal muscle following high-fat diet[J]. J Appl Physiol,117(8):869-879.
ATTANE C, FOUSSAL C, LE GONIDEC S, et al., 2012.Apelin treatment increases complete Fatty Acid oxidation, mitochondrial oxidative capacity, and biogenesis in muscle of insulin-resistant mice [J]. Diabetes, 61(2): 310-320.
BAJER B, VLCEK M, GALUSOVA A, et al., 2015. Exercise associated hormonal signals as powerful determinants of an effective fat mass loss[J]. Endocr Regul, 49(3):151-163.
BESSE P A, MONTASTIER E, Vinel C, et al., 2014. Effect of endurance training on skeletal muscle myokine expression in obese men: identification of apelin as a novel myokine [J]. Int J Obes, 38(5): 707-713.
BERTRAND C, VALET P, CASTANLAURELL I, 2015. Apelin and energy metabolism[J]. Front Physiol, 6: 115.
BI F, XU Y, SUN Q, 2018.Catalpol pretreatment attenuates cardiac dysfunction following myocardial infarction in rats [J]. Anatol J Cardiol, 19(5):296-302.
BOOTH F W, ROBERTS C K, LAYE M J,2012. Lack of exercise is a major cause of chronic diseases[J]. Compr Physiol, 2(2):1143-1211.
FALCO M D, LUCA L D, ONORI N, et al., 2002. Apelin expression in normal human tissues [J]. In vivo, 16(5): 333-336.
DRAY C, KNAUF C, DAVIAUD D, et al., 2008. Apelin stimulates glucose utilization in normal and obese insulin-resistant mice [J]. Cell Metab, 8(5): 437-45.
FENTZ J, KJφBSTED R, KRISTENSEN C M, et al., 2015.AMPKα is essential for acute exercise-induced gene responses but not for exercise training-induced adaptations in mouse skeletal muscle[J]. Am J Physiol Endocrinol Metab, 309 (11):E900-914.
FRIER B C, WILLIAMS D B, WRIGHT D C, 2009. The effects of apelin treatment on skeletal muscle mitochondrial content[J]. Am J Physiol Regul Integr Comp Physiol, 171(297):R1761-1768.
GILBERT J S,2017. From apelin to exercise: emerging therapies for management of hypertension in pregnancy [J]. Hypertens Res, 40(6):519-525.
INDRAKUSUMA I, SELL H, ECKEL J, 2015. Novel Mediators of Adipose Tissue and Muscle Crosstalk[J]. Curr Obes Rep, 4(4):411-417.
ISABELLE C L, CAMILLE A, THIBAUT D, et al., 2011. Apelin, diabetes, and obesity[J]. Endocrine, 40(1):1-9.
KATUGAMPOLA S D, MAGUIRE J J, MATTHEWSON S R, et al., 2001. [(125)I]-(Pyr(1))Apelin-13 is a novel radioligand for localizing the APJ orphan receptor in human and rat tissues with evidence for a vasoconstrictor role in man [J]. British journal of pharmacology, 132(6): 1255-60.
LI J, LI S, WANG F, et al., 2017. Structural and biochemical insights into the allosteric activation mechanism of AMP-activated protein kinase[J]. Chem Biol Drug Des, 89(5): 663-669.
MARCINKOarcinko K, STEINBERG G R, 2014. The role of AMPK in controlling metabolism and mitochondrial biogenesis during exercise[J]. Exp Physiol, 99(12):1581-1585.
MASRI B, KNIBIEHLER B, AUDIGIER Y,2005. Apelin signalling: a promising pathway from cloning to pharmacology [J]. Cellular signalling, 17(4): 415-426.
O'DOWD B F, HEIBEReiber M, Chan A, et al., 1993. A human gene that shows identity with the gene encoding the angiotensin receptor is located on chromosome 11 [J]. Gene, 136(1-2):355-360.
OLIVA C R,MARKERT T,GILLESPIE G Y,et al., 2015. Nuclear-encoded cytochrome c oxidase subunit 4 regulates BMI1 expression anddetermines proliferative capacity of high-grade gliomas [J]. Oncotarget, 6(6): 4330- 4344.
RITCHIE I R, MACDONALDT L, WRIGHT D C, et al., 2014. Adiponectin is sufficient, but not required, for exercise-induced increases in the expression of skeletal muscle mitochondrial enzymes[J]. J Physiol, 592(12): 2653-2665.
ROZYCKA M, KUROWSKA P, GRZESIAK M, et al., 2018. Apelin and apelin receptor at different stages of corpus luteum development and effect of apelin on progesterone secretion and 3β-hydroxysteroid dehydrogenase (3β-HSD) in pigs [J]. Anim Reprod Sci, 192: 251-260.
SON J S, KIM H J, SON Y, et al., 2017. Effects of exercise-induced apelin levels on skeletal muscle and their capillarization in type 2 diabetic rats [J]. Muscle Nerve,56(6):1155-1163.
SON J S, SONG A C, TESTROET E D, et al., 2018. Exercise-induced myokines: a brief review of controversial issues of this decade[J]. Expert Rev Endocrinol Metab, 13(1):51-58.
STROHBACH A, PENNEWITZ M, GLAUBITZ M, et al., 2018. The apelin receptor influences biomechanical and morphological properties of endothelial cells[J]. J Cell Physiol, 233(8):6250-6261.
TAHERI S, MURPHY K, COHEN M, et al., 2002.The effects of centrally administered apelin-13 on food intake, water intake and pituitary hormone release in rats [J]. Biochem Biophys Res Commun, 291(5): 1208-1212.
THAN A, ZHANG X, LEOW M K, et al., 2014.Apelin attenuates oxidative stress in human adipocytes.[J]. J Biol Chem, 289(6): 3763-3774.
WANG L, DI L, NOGUCHI CT, 2014. AMPK is Involved in Mediation of Erythropoietin Influence on Metabolic Activity and Reactive Oxygen Species Production in White Adipocytes[J]. Int J Biochem Cell Biol, 54(8):1-9.
WU Z, PUIGSERVER P, ANDERSSON U, et al., 1999. Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1[J]. Cell, 98(1):115-124.
YAMAMOTO T, HABATA Y, MATSUMOTO Y, et al., 2011. Apelin-transgenic mice exhibit a resistance against diet-induced obesity by increasing vascular mass and mitochondrial biogenesis in skeletal muscle [J]. Biochim Biophys Acta, 1810(9): 853-862.
YANG H, ZHAO L, ZHANG J, et al.,2015.Effect of Treadmill Running on Apelin and APJ Expression in Adipose Tissue and Skeletal Muscle in Rats Fed a High-fat Diet [J]. Int J Sports Med, 36(7): 535-541.
YUE P, JIN H, AILLAUD M, et al., 2010.Apelin is necessary for the maintenance of insulin sensitivity [J]. Am J Physiol-Endoc M, 298(1): E59-67.
VINEL C, LUKJANENKO L, BATUT A, et al., 2018. The exerkine apelin reverses age-associated sarcopenia[J]. Nat Med, 24(9):1360-1371.
Effects of Apelin Supplement during Aerobic Training on AMPK Activation and Mitochondrial Energy Metabolism in Skeletal Muscle
LI Tieying, ZHANG Ying
Objective:To investigate the effects of apelin supplement during aerobic training on AMPK activation and mitochondrial energy metabolism in skeletal muscle. Methods: In the cell experiments, the AMPKα specific small interfering RNA(AMPKα siRNA)or a negative control interfering RNA(Control siRNA) were transfected into mice skeletal muscle C2C12 cells by Lipofectamine. Starvation treatment was performed for 6 hours after 48 hours transfection, and then cells were incubated with apelin-13 or PBS for 6 hours in complete medium to observe the changes in mitochondrial basal respiration, ATP production, and respiratory function. In the animal experiments, forty 8-week-old C57BL/6J mice were randomly divided into four groups (n=10 in each group): sedentary without apelin treatment, sedentary with apelin treatment, exercise training without apelin treatment and exercise training with apelin treatment group. The apelin treatment groups were injected intraperitoneally with apelin-13 at 0.1 μmol/kg/day for 4 weeks. The exercise groups were trained 6 days/week, 1 hour/day for 4 weeks by running on a treadmill at 75% VO2max. 48 hours after the last session of exercise training, the quadriceps were collected. The protein expressions of apelin, APJ, AMPKα, p-AMPKα (Thr172) and COX IV in skeletal muscles was measured by Western Blotting. Results: 1) In the cell experiments, the basal respiration rate, mitochondrial ATP production and maximum respiration rate were significantly increased in the Control siRNA+apelin group compared with the Control siRNA+PBS group, but the mitochondrial ATP production and maximum respiration rate were significantly decreased in the AMPK siRNA+apelin group compared with the Control siRNA+apelin group. 2) In the animal experiments, the protein expression of apelin, APJ, COX IV and the p-AMPKα/AMPKα ratio in skeletal muscles were significantly increased in the apelin treatment groups compared with no apelin treatment groups. Conclusion: The exogenous supplementation of apelin was significantly increased the AMPK-mediated mitochondrial respiratory function in C2C12 cells, and the apelin supplement during aerobic training was also significantly increased the apelin/APJ, COX IV protein expression and the p-AMPKα/AMPK ratio in skeletal muscles. The results suggested that the combination of aerobic exercise training with apelin supplement might activates the apelin-AMPK pathway and improves the mitochondrial energy metabolism in skeletal muscles.
1000-677X(2019)01-0055-06
10.16469/j.css.201901008
2018-11-09;
2018-12-30
国家自然科学基金资助项目(31640044);中央高校基本科研业务费专项资金资助课题(2018XS001)
李铁瑛(1988-),女,在读博士研究生,主要研究方向为运动与骨骼肌健康的代谢适应,E-mail:yingyingziying@ 163.com。
张缨(1961-),女,教授,博士,博士研究生导师,主要研究方向运动与骨骼肌健康的代谢适应,E-mail: zhyi9256 @126.com。
G804.7
A
