2种微生态制剂对乌鳢生长性能、肠道形态及免疫功能的影响
2019-01-29谢明宝农兴新杨文豪
杨 虹,谢明宝,于 辉,农兴新,杨文豪,杨 映
(佛山科学技术学院 生命科学与工程学院,广东 佛山 528231)
益生菌(Probiotics)是一类对宿主有益的活性微生物,它能产生有益于宿主健康的功效,改善宿主的微生态平衡。国内外水产养殖业应用的益生菌种类主要有乳酸杆菌(Lactobacillusacidophilus)、枯草芽孢杆菌(Bacillussubtilis)、双歧杆菌(Bifidobacteriuminopinatum)、酵母菌(Yeast)和肠球菌(Enterococci)等[1]。益生菌在动物肠道酸性环境中具有较高的稳定性,能有效抑制有害菌生长,提高动物机体免疫力,同时也参与机体的新陈代谢,为机体提供营养物质,促进动物的生长发育,在水产养殖业中已被广泛使用[2]。中草药多糖与益生菌在生理功能上具有高度一致性。同时,中草药多糖扮演益生元的角色被广泛应用于水产养殖领域,它不仅具有免疫调节、抗感染、抗氧化等生物学功能,还具有无毒副作用、对动物刺激小等优点。玉屏风多糖是由黄芪、白术和防风三味中草药经传统水提醇沉技术得到的复合中草药多糖,研究表明,玉屏风多糖作为水产饲料的添加剂和免疫增强剂,具有改善水生动物肠道形态结构、提高机体免疫力、促进生长发育和保障健康的作用[3-4]。
乌鳢(Channaargus)俗称黑鱼,属鲈形目(Perciformes)、鳢科(Channaidae)、鳢属(Channa),是一种凶猛的肉食性鱼类,但因其肉味鲜美,且具有祛瘀活血、怯寒调养、生肌补血等多种药理功效,使其具有较高的经济价值与营养价值。在抗生素滥用导致水环境恶化、水产动物疾病频发的今天,寻求新型绿色环保的抗生素替代品成为水产领域的研究热点。已有研究证实,2种或2种以上不具有拮抗作用的益生菌复合制剂的作用效果明显优于单一益生菌[5-6]。而且中草药多糖与益生菌联合使用对于动物生长[7]、免疫[8]等的影响也显著优于单独的复合益生菌。将玉屏风多糖与复合益生菌联合使用,是微生态制剂的一种新思路。目前关于中药多糖复合益生菌制剂对水产养殖动物影响的研究报道相对较少。因此,本研究以乌鳢为试验对象,在饲料中分别添加复合益生菌(乳酸菌、双歧杆菌和枯草芽孢杆菌)和玉屏风多糖复合益生菌(玉屏风多糖、乳酸菌、双歧杆菌和桔草芽孢杆菌),分析2种微生态制剂对乌鳢的生长、肠道结构和免疫能力的影响,旨在探究复合益生菌和玉屏风多糖复合益生菌在水产动物养殖中的增益作用与效果,为其在生产中的应用提供科学依据。
1 材料和方法
1.1 试验材料
基础饲料参照《实用饲料配方集锦》[9]进行配方设计与配制,其组成成分及营养成分见表1。以基础饲料为对照组,试验组为在基础配方中分别添加0.8%复合益生菌、1.6%复合益生菌、 0.8%玉屏风多糖复合益生菌。复合益生菌由乳酸菌、双歧杆菌、枯草芽孢杆菌按1∶1∶1比例混合而得,有效活菌量为1.0×109cfu/mL。玉屏风多糖复合益生菌由复合益生菌和玉屏风多糖按1∶1比例混合而得。玉屏风多糖由佛山德众药业有限公司提供,其总还原糖、粗蛋白、粗脂肪、粗灰分、水分和粗纤维的含量分别为34.20%、18.52%、0.71%、8.86%、8.21%和0.67%。
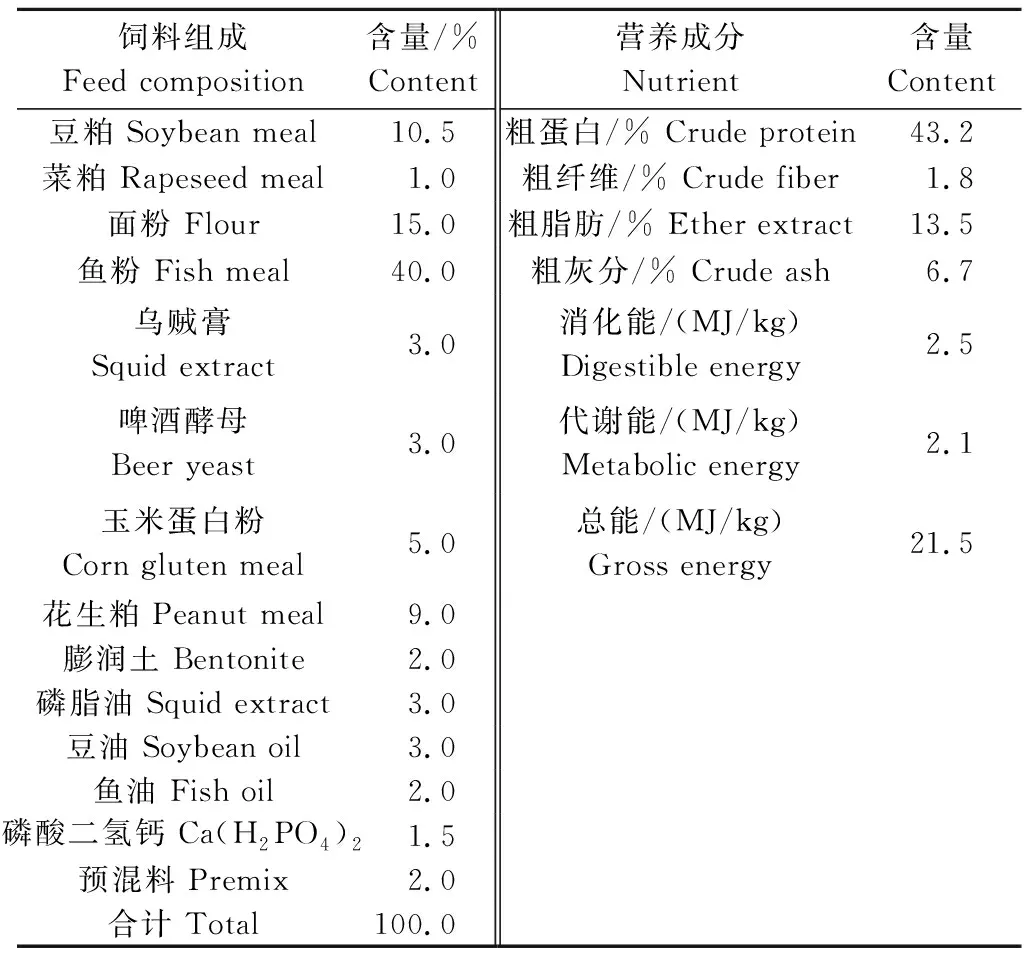
表1 基础饲料组成及营养水平(风干基础) Tab.1 Composition and nutrient levels of the basal diet(air-dry basis)
注:每千克预混料含8 000 IU 维生素A,7.5 mg 维生素B1,15 mg 维生素B2,100 mg烟酸,12.5 mg 维生素B6,5 mg 维生素B12,50 mg D-泛酸,1 mg生物素,200 mg肌醇,5 mg叶酸,2 500 mg氯化胆碱,240 mg 维生素C, 200 IU 维生素D4,300 mg 维生素E,0 mg维生素K3,400 mg 抗氧化剂,5 mg 氯化钴,1 000 mg左旋肉碱。
Note: 1 kg of premix contained 8 000 IU VA,7.5 mg VB1,15 mg VB2,100 mg niacin,12.5 mg VB6,5 mg VB12,50 mg D-pantothenic acid,1 mg biotin,200 mg inositol,5 mg folic acid,2 500 mg choline chloride,240 mg VC,200 IU VD4,300 mg VE,0 mg VK3,400 mg BHT,5 mg CoCl2,1 000 mg L-carnitine.
1.2 试验管理
选取平均体质量为(23±0.15)g的健康乌鳢240尾随机分成4组,即对照组和试验组(Ⅰ~Ⅲ组),每组3个重复,每个重复20尾。预试期7 d,正式期56 d,试验期间保持24 h充氧,水温为(28±0.5)℃,1 d 2次定时(8:00和16:00)投喂,日投喂量为总体质量的2%~4%,每次根据摄食情况适当调整投喂量。
1.3 试验方法
1.3.1 生长性能测定 分别于试验正式开始和第56天试验结束时,对禁食24 h后的乌鳢进行活体计数和体质量称量,并准确记录采食量、初均体质量(IBW)、末均体质量(ABW)等指标,计算体质量增加率(WGR)、特定生长率(SGR)、饲料系数(FCR)和成活率。
1.3.2 肠道形态测定 第56天试验结束后,于无菌环境下解剖乌鳢,选取长度约1 cm的中肠,采用Carnoy’s固定液固定12~24 h后,进行石蜡包埋与切片,利用常规苏木精-伊红(HE)染色,并用Image-Pro 6.0图像处理软件测定绒毛高度、隐窝深度和肌层厚度,计算绒腺比(V/C)。
1.3.3 血清生化指标测定 第56天试验结束后,对禁食24 h后的乌鳢进行尾静脉采血,室温静置一段时间后,于4 ℃、3 000 r/min离心5 min,移取并分装上层血清,测定总超氧化物歧化酶活性(T-SOD)和溶菌酶活性(LZM)。测定均采用南京建成生物工程研究所的试剂盒进行。
1.3.4MHCⅠ相对表达量测定 第56天试验结束后,解剖分离鱼体肝脏、肾脏、鳃丝和肌肉,参照Trizol Reagent(Invitrogen公司)和PrimeScriptTMRT Reagent Kit(TaKaRa公司)的说明书进行总RNA的提取与cDNA反转录。
根据NCBI上乌鳢β-actin(GenBank:AQU42895.1)和MHCⅠ(GenBank:ACF74832.1)基因序列设计引物,引物均由上海生工生物工程有限公司合成。PCR引物序列和产物长度见表2。
采用TaKaRa SYBR®Premix ExTaqTMⅡ(Perfect Real Time)进行实时荧光定量PCR试验,反应体系20 μL:SYBR®Premix ExTaqTMⅡ 10 μL,ROX Reference DyeⅡ 0.4 μL,cDNA模板2 μL,上、下游引物各0.8 μL,dH2O 6 μL。反应程序为:94 ℃预变性2 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,40个循环。目的基因的相对表达量采用2-△△Ct法计算。
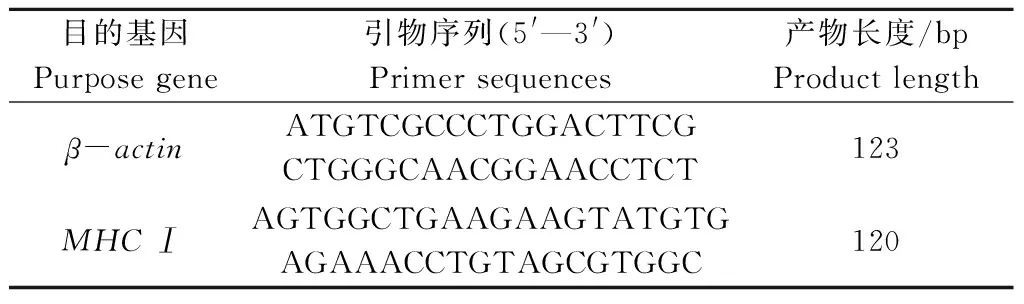
表2 目的基因引物序列 Tab.2 Primer sequences in PCR
1.4 数据处理
所得数据均以均值±标准差表示,采用SPSS 19.0进行单因素方差分析和Duncan’s法进行多重比较,分析试验结果的差异显著性。
2 结果与分析
2.1 复合益生菌和玉屏风多糖复合益生菌对乌鳢生长性能的影响
由表3可知,利用复合益生菌和玉屏风多糖复合益生菌处理乌鳢后,直至试验结束,没有试验鱼死亡。试验组的乌鳢体质量增加率和特定生长率显著高于对照组,饲料系数则显著低于对照组;以对照组作为参考,试验Ⅱ组的乌鳢体质量增加率和特定生长率分别提高31.15%和31.01%,饲料系数降低20.77%。此外,试验Ⅲ组的乌鳢生长性能优于试验Ⅰ组。

表3 复合益生菌和玉屏风多糖复合益生菌对乌鳢生长性能的影响Tab.3 Effect of compound probiotics and Yupingfeng polysaccharide on growth performance of Channa argus
注:同行肩标不同小写字母表示差异显著(P<0.05),下同。
Note: Values with Different lowercase superscripts within the same line indicate significant difference (P<0.05).The same as below.
2.2 复合益生菌和玉屏风多糖复合益生菌对乌鳢肠道形态结构的影响
由表4可知,复合益生菌和玉屏风多糖复合益生菌对乌鳢肠绒毛高度、隐窝深度和肌层厚度有一定的作用。各试验组的肠绒毛高度较对照组分别提高17.42%、21.42%和16.98%。隐窝深度表现为:试验Ⅲ组>对照组>试验Ⅱ>试验Ⅰ组。绒腺比表现为:试验Ⅱ组>试验Ⅰ组>试验Ⅲ组>对照组,试验组与对照组比较均有显著性差异。与对照组相比,试验组的肌层厚度分别提高10.51%、14.97%和13.08%,其中试验Ⅱ组和试验Ⅲ组与对照组有显著性差异。

表4 复合益生菌和玉屏风多糖复合益生菌对乌鳢肠道形态结构的影响Tab.4 Effect of compound probiotics and Yupingfeng polysaccharide on intestinal morphology of Channa argus
2.3 复合益生菌和玉屏风多糖复合益生菌对乌鳢血清生化指标的影响
由表5可知,利用复合益生菌和玉屏风多糖复合益生菌处理乌鳢后,经过56 d的饲养,试验组乌鳢的血清溶菌酶活性显著高于对照组,分别提高34.52%、37.64%、34.02%,其中以试验Ⅱ组最明显,而试验组之间无显著性差异。试验组血清总超氧化物歧化酶活性分别较对照组显著提高了23.61%、36.11%、40.27%,其中,试验Ⅱ和Ⅲ组高于试验Ⅰ组,但试验组之间无显著性差异。

表5 复合益生菌和玉屏风多糖复合益生菌对乌鳢LZM、T-SOD活性的影响Tab.5 Effect of compound probiotics and Yupingfeng polysaccharide on LZM and T-SOD activity of Channa argus
2.4 复合益生菌和玉屏风多糖复合益生菌对乌鳢MHCⅠ相对表达量的影响
由表6可知,复合益生菌和玉屏风多糖复合益生菌对乌鳢MHCⅠ相对表达量影响的检测结果显示,MHCⅠ在乌鳢肾脏、肝脏、鳃丝和肌肉中均有不同程度的表达。其中,以肾脏MHCⅠ的表达量最高,肝脏、鳃丝次之。试验Ⅱ组乌鳢肾脏、肝脏和鳃丝中的MHCⅠ表达量最高,但与其他2个试验组无显著性差异。试验Ⅰ组乌鳢肌肉中的MHCⅠ表达量显著高于其他3组。
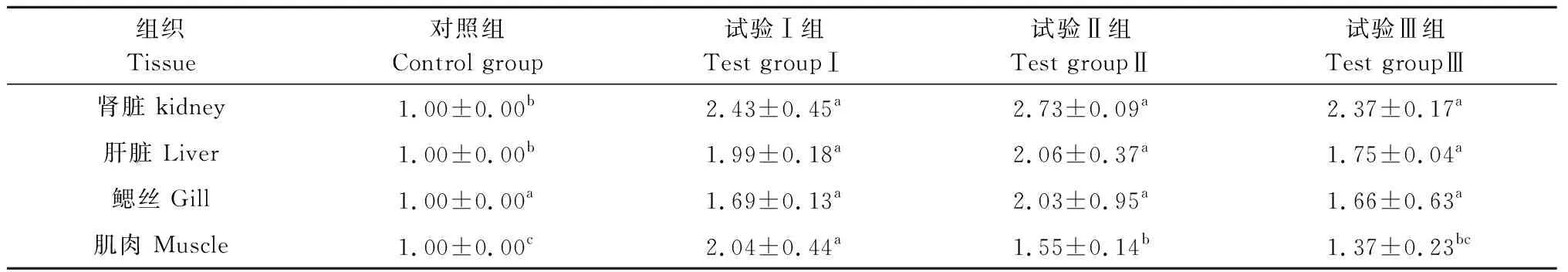
表6 MHCⅠ在乌鳢不同组织中的相对表达量Tab.6 The relative expression levels of MHC Ⅰ in the different parts of Channa argus
3 结论与讨论
本研究表明,复合益生菌和玉屏风多糖复合益生菌均可以促进乌鳢生长发育。这2种微生态制剂主要是通过提高乌鳢的肠绒毛高度、降低隐窝深度以及增加肌层厚度来保证肠道形态结构的完整性,从而增强鱼体免疫力。因此,建议在乌鳢养殖中,适当添加益生菌或玉屏风多糖复合益生菌等绿色饲料添加剂,以促进乌鳢的健康成长,减少病害的发生。
3.1 复合益生菌和玉屏风多糖复合益生菌对乌鳢生长性能的影响
益生菌在动物肠道内的繁殖过程中能合成多种营养物质,如挥发性短链脂肪酸、B族维生素等,还能产生多种消化酶,增强机体对营养物质的消化与吸收,从而促进动物的生长发育。刘淑兰等[10]等研究发现,投喂复合益生菌后大西洋鲑的增长率显著升高,饲料系数和死亡率显著降低,使其生长性能得到明显改善。王纯等[11]对虹鳟、江永明等[12]对奥尼罗非鱼以及丁丽等[13]对异育银鲫的研究也得到了类似结果,即益生菌可以提高动物的生长性能和存活率。本研究结果表明,在乌鳢基础饲料中添加复合益生菌能够不同程度提高乌鳢的特定生长率和体质量增加率,并降低饲料系数,与上述研究结果一致。值得注意的是,0.8%玉屏风多糖复合益生菌组乌鳢的生长效果优于0.8%复合益生菌组,这可能与复合益生菌的代谢作用有关。益生菌能够分泌多种消化酶来补充宿主自身内源性酶的不足,并与宿主自身产生的消化酶发挥叠加作用,将玉屏风多糖分解成小分子物质,促进机体吸收利用,从而发挥益生作用。也有研究证明,多糖是难以被宿主肠道直接消化吸收的,一般是通过肠道内微生物发酵降解才能供宿主和肠道微生物消化吸收,并且有利于宿主的健康生长[14]。然而这与肖拉[15]的研究结果不同,即在基础饲粮中单独添加枯草芽孢杆菌或黄芪多糖可提高建鲤生长性能,在基础饲粮中同时添加枯草芽孢杆菌和黄芪多糖也可以提高建鲤生长及免疫功能,但不如单独添加的效果好。这种差异可能是受益生菌和多糖的种类、数量及比例等因素影响。
3.2 复合益生菌和玉屏风多糖复合益生菌对乌鳢肠道结构的影响
肠道既是机体营养物质充分消化吸收的重要器官,也是免疫屏障和维持内环境稳态的结构基础[16]。在对肠道形态的研究中,一般认为肠绒毛高度、数量和形态结构决定了肠道消化的吸收能力,肌层厚度影响着营养物质的吸收和转运速度[17-18]。而且肠绒毛强有力且有规律的摆动可以有效阻止外界病原微生物入侵宿主肠道,也可促进肠道对营养物质的消化吸收。益生菌代谢中药多糖所产生的活性小分子物质,可以作为肠上皮细胞和肠道微生物的能量来源,从而促进机体免疫系统的发育成熟[19]。黄灿等[20]研究表明,益生菌能够减轻致病菌对肠黏膜结构带来的损伤,进一步保证了肠道结构的完整性。本研究结果表明,在乌鳢基础饲料中添加不同浓度的复合益生菌或玉屏风多糖复合益生菌均能促进乌鳢肠道绒毛生长、提高肌层厚度以及降低隐窝深度,与其在草鱼[21-22]、长吻鮠[23]、鲤鱼[24]、南亚野鲮[25]等水产动物上的研究结果基本一致。因此,进一步说明益生菌和多糖能够促进肠道的生长发育,提高肠绒毛的高度与密度、肌层厚度以及微绒毛的长度与密度。DANIELS等[26]、MERRIFIELD等[27]、KRISTIANSEN等[28]、LAZADO等[29]的研究结果也支持了以上观点。本研究结果还显示,0.8%玉屏风多糖复合益生菌组的乌鳢隐窝的生长发育明显优于0.8%复合益生菌组。但是,有关玉屏风多糖复合益生菌的添加浓度是否影响乌鳢肠黏膜生长发育还有待进一步深入研究。
3.3 复合益生菌和玉屏风多糖复合益生菌对乌鳢血清生化指标的影响
溶菌酶是一种重要的非特异性生物防御因子,也是一种消化酶,具有杀灭和消化致病菌的功能,在水产动物免疫防御中起到重要的作用[30]。总超氧化物歧化酶是一种抗氧化酶,能清除自由基,也能催化过氧化物自由基发生歧化,同时还能防御活性氧对机体的伤害和机体衰老[31]。LZM和T-SOD大小在很大程度上能够直接反映机体的非特异性免疫防御能力和抗氧化能力。潘雷等[5]、赵晶晶等[31]、李桂英等[32]、夏磊等[33]的研究结果也都表明,益生菌能显著提高血清LZM和T-SOD,且与添加单一益生菌比,复合益生菌对机体免疫力具有更好的促进作用。本研究结果表明,复合益生菌能够显著提高LZM和T-SOD,与上述的研究结果一致。而比较添加0.8%复合益生菌组和添加0.8%玉屏风多糖复合益生菌组发现,添加0.8%玉屏风多糖复合益生菌组中T-SOD大于添加0.8%复合益生菌组。有研究表明,益生菌与宿主多个功能器官协同作用在宿主的代谢、免疫调控等方面起到重要作用[34],而中药多糖代谢产物可以作为信号分子在宿主细胞与肠道微生物之间传递信息[35]。因此,推测玉屏风多糖复合益生菌对动物机体的免疫调节作用可能与益生菌发酵多糖所产生的发酵物有关。
3.4 复合益生菌和玉屏风多糖复合益生菌对乌鳢MHCⅠ相对表达量的影响
MHC是由一系列位于染色体上紧密相连的基因位点组成的具有高度多态性的一类基因家族,是编码免疫球蛋白样受体的高度多态性基因群,也是跟免疫密切相关的基因家族[36]。MHCⅠ主要位于细胞表面,参与机体免疫反应,将抗原呈递到T细胞中去攻击侵入的病原体,从而在动物机体免疫应答的诱导与调节中发挥重要作用[37]。MHCⅠ基因在哺乳动物上的研究较广泛,但鱼类MHCⅠ基因的研究起步较晚。MUOZ-ATIENZA等[38]研究发现,益生菌可以提高大菱鲆组织器官中免疫相关因子MHCⅠ的相对表达量。本研究结果显示,MHCⅠ在乌鳢肾脏、肝脏、鳃丝和肌肉中均有不同程度的表达,而且所有试验组均高于对照组。MHCⅠ在肾脏中的相对表达量最高,在肝脏、鳃丝中中等程度表达,在肌肉中表达量较低,与黎建平[39]、王娟等[40]的研究结果基本一致。原因可能是肾脏、肝脏是机体的主要免疫组织器官,含有较多的骨髓细胞和淋巴细胞。
综上所述,在一定范围内,复合益生菌的益生作用与其添加量具有高度相关性,而相同添加水平,玉屏风多糖与复合益生菌叠加作用效果优于单独使用复合益生菌。基于此,后续将对复合益生菌与玉屏风多糖之间的配比进行优化,寻求最适的混配比例以及在乌鳢饲料中的最适添加量,并且探讨玉屏风多糖复合益生菌的益生机制,以期为玉屏风多糖复合益生菌制剂在水产养殖上的应用提供一些理论依据。
