响应面优化硝普钠法测定发酵液中的蛋氨酸含量
2019-01-26胡翠英李良智姚雪梅王桃云顾华杰
胡翠英,李良智,姚雪梅,王桃云,顾华杰
(苏州科技大学化学生物与材料工程学院,江苏苏州215009)
蛋氨酸(Met)作为必需氨基酸之一,主要应用于饲料、医药、食品等行业。随着Met需求量的逐年增长,其产量不断提高,2016年全球Met产量达164.2万吨,大约是2013年的2倍[1]。目前Met的获取方法有生物酶拆分法[2]、发酵法、化学合成法等[3],其中发酵法虽价廉、低污染,但由于代谢通路复杂而导致其产量较低,因此如何获得Met高产菌株成为科研工作者的研究焦点。快速测定发酵液中Met含量对于筛选Met产生菌株有重要意义。
目前,发酵液中Met测定方法有:高效液相法(High-performance liquid chromatography,HPLC)[1,4]、氨基酸分析仪法(Aminoacid analyzer)[5]、薄层层析法(Thin layer chromatography,TLC)[6]、间接碘量法[7]、间 接 碘 量 法 结 合 凯 氏 定 氮 法[8-9]、 NTB(Nitrothiobenzoate) 显色法[10]和硝普钠(SNP) 法[11-12]等。高效液相色谱-质谱法与氨基酸分析仪法测定原理类似,通过改变流动相极性,将样品中各种氨基酸分离开,同时采用柱前或柱后衍生法,在特定波长下测定氨基酸含量。这两种方法的优点是准确、可靠,缺点是耗时、高价。碘量法和凯氏定氮法分别测定的是Met的甲硫基与氨基两个基团的含量,二者配合使用,测定结果会较为可靠,但同时导致测定方法复杂化。NTB显色法和SNP法均为光度测定法。NTB显色法[10]优点是迅速、灵敏,但测定过程中需要用到有毒物质-DEPC(Diethy pyrocarbonate,焦碳酸二乙酯)水。另一种分光光度法-SNP法,步骤简单,耗时短,能迅速测定Met含量,但存在受其它氨基酸干扰的因素。20 世纪 40~80 年代 Mccarthy[13]、Smith[14]、Greenstein[15]、Ahmed[16]等已经对 SNP 法做了大量研究,目的是提高这种方法的灵敏度和可靠性等。目前许多文献中[11-12]使用 SNP法测定 Met含量,但对反应中各试剂的添加原因、反应时间长短、干扰氨基酸影响程度等的报道较少。随着时代发展,电子产品不断更新换代,现代设备的检测方法多样化,灵敏度也越来越高。本文在原有测定方法的基础上,结合最大吸收峰的测定,对SNP反应中各试剂的添加量、反应时间和吸收波长等进行优化。
1 材料与方法
1.1 材料与仪器
菌种 蜡样芽孢杆菌(实验室自筛);试剂:丝氨酸(Ser)、苏氨酸(Thr)、赖氨酸(Lys)、半胱氨酸(Cys)、亮氨酸(Leu)、组氨酸(His)、异亮氨酸(Ile)、蛋氨酸(Met)、缬氨酸(Val)、精氨酸(Arg)、丙氨酸(Ala)、酪氨酸(Tyr) 以上氨基酸均为L型,阿拉丁公司;SNP Sangon Biotech公司;种子培养基:牛肉膏 5 g,蛋白胨 10 g,NaCl 5 g,H2O 1 L,pH7.2,琼脂20 g;发酵培养基:葡萄糖20 g(单独灭菌),MgSO4·7H2O 0.2 g,NaNH4HPO43.5 g,K2HPO4·2H2O 11.9 g,(NH4)2SO41 g,柠檬酸·3H2O 2 g,NaSO410 g,H2O 1 L,pH6.5。
BT25S和BSA224S天平 德国赛多利斯公司(Sartorius);UV2450紫外可见分光光度计 日本岛津公司(Shimadzu);ZQLY-180S恒温摇床 上海知楚仪器有限公司;KQ-700DB超声波清洗器 昆山超声仪器有限公司;A300全自动氨基酸分析仪 德国曼默博尔公司(MembraPure GmbH)。
1.2 实验方法
1.2.1 发酵液中氨基酸种类分析 将菌株在种子培养基中活化过夜(30℃,200 r/min),接种发酵液,接种量10%(v/v),30 ℃,200 r/min,培养 72 h。发酵液离心(常温10000 r/min离心10 min),取上清液400μL,加入100μL 10%磺基水杨酸;2~8℃静置60 min;14500 r/min常温离心15 min;取上清液再次离心5 min;经0.22μm过滤器过滤后,在氨基酸分析仪上分析氨基酸组成。
1.2.2 初始硝普纳法 发酵液1500 g离心15 min;5 mL上清液中加入1 mL 5 mol/L NaOH和0.1 mL 10%SNP溶液,摇匀试管,静置10 min;加入2 mL 3%甘氨酸(Gly)水溶液,10 min内频繁振荡;将2 mL H3PO4逐滴加到混合物中,振荡试管,反应5 min;在540 nm 处测吸光值[11-12]。
1.2.3 蛋氨酸合成过程中各氨基酸SNP反应吸收光谱 本次实验选择的其它氨基酸主要是Met代谢过程中涉及的氨基酸,包括 Met、Lys、Thr、Val、Ile、Cys、Ser、Tyr、His、Leu、Arg、Ala。各种氨基酸浓度为1.0 g/L,按1.2.2方法,观察实验过程中颜色变化,拍照,用紫外可见分光光度计扫描,波长范围300~700 nm。
1.2.4 发酵液中各成分对Met含量测定的影响 将发酵培养基中 NaNH4HPO4(3.5 g/L)、MgSO4·7H2O(0.2 g/L)、柠檬酸(2 g/L)、(NH4)2SO4(1 g/L)、Na2SO4(10 g/L)、K2HPO4·2H2O(11.9 g/L)、葡萄糖(20 g/L)等分别按1.1中含量配成各自溶液,以蒸馏水为对照样品,并分别灭菌。按1.2.2方法,用紫外可见分光光度计扫描吸收光谱,波长范围300~900 nm。1.2.5 单因素实验
1.2.5.1 试剂加入后反应时间对SNP法吸收光谱的影响 向上清液中加入1 mL 5 mol/L NaOH和0.1 mL 10%SNP 溶液,摇匀试管,静置不同时间(1、2、3、4、5、6、7、8、9、10、20、30 min),分别测定吸收光谱;其中平行样静置30 min后,分别加入2 mL 3%Gly水溶液,不同时间(1、2、3、4、5、6、7、8、9、10 min)内频繁振荡,测定300~900 nm范围内的吸收光谱;10 min后平行样中,分别逐滴加入2 mL浓H3PO4,振荡试管,反应不同时间(1、2、3、4、5、6、7、8、9、10、20、30、40 min),分别测定吸收光谱。
向含有1、2、3 g/L Met的无菌发酵液中分别加入1 mL 5 mol/L NaOH和0.1 mL 10%SNP溶液,分别静置5、15、20、30、60 min,分别按照1.2.2 中的方法加入Gly与H3PO4,分别测定513 nm处的吸光值。
1.2.5.2 试剂加入量对Met测定的影响 基本按照1.2.2中的方法,稍作修改,加入NaOH与SNP后,静置30 min,加入Gly后,振荡反应10 min,加入H3PO4后,反应5 min。其它参数每次只改变一个因素。5 mol/L NaOH 加入 0、0.5、1.0、1.5、2 mL;10%SNP加入 0.05、0.15、0.25、0.3、0.35、0.4、0.45、0.5 mL;3%Gly 水溶液加入量 0、1、2、3 mL;浓 H3PO40、1、2、3 mL。测定513 nm处吸收值。
1.2.6 响应面法优化SNP法 以单因素实验结果为依据,采用Box-Behnken中心组合实验设计,对SNP法响应面优化。实验设计见表1,重复3次。测定前用水补足体积,每个样加完试剂后总体积为10.3 mL。

表1 SNP法响应面设计因素水平表Table 1 Factors and levels table of response surface experiment for SNPmethod
1.2.7 分析Gly、His的存在对SNP反应吸收光谱的影响 无菌发酵培养基中加入1 g/L的Met,或加入1 g/L Met+1 g/L His,两种混合液作为样品。依1.2.6得出的最佳SNP法不加甘氨酸,测定扫描光谱;依1.2.6得出的最佳SNP法,但加入2 mL 3%甘氨酸,测定扫描光谱。比较四条吸收光谱曲线。
1.2.8 标准曲线制定 配制 0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 g/L 的 Met,扫描 SNP 反应结束后产物光谱。记录吸收值的变化,利用Originpro 8绘制标准曲线。
1.3 数据分析
经紫外可见分光光度计测定的数据,保存为txt文件,利用Originpro 8绘制各类相关图。利用Design-expert 7.0软件设计响应面实验方案并分析实验结果。
2 结果与分析
2.1 发酵液中不同氨基酸SNP法反应吸收光谱
文献报道中,利用SNP法测定Met含量时,会受到 His、Cys、Tyr 等氨基酸的影响[15]。为能在发酵液中准确判断和定量Met,需要确定发酵液中存在哪些干扰氨基酸,并分析影响程度。理论上,Met合成通路中,从 Asp 开始,会形成 Lys、Thr、Ile、Cys、Ser等[17]。发酵液经全自动氨基酸分析仪分析,蜡样芽孢杆菌发酵液中氨基酸种类为 Thr、Ser、Gly、Ala、Met、Val、Ile、His、Lys、Arg 等。图 1 揭示了这些氨基酸SNP反应后的吸收光谱。SNP实验过程中,不加入H3PO4时,试管中溶液颜色不发生变化。Met的SNP反应中只有加入H3PO4后,溶液颜色才会出现红色。结果表明除了Met外,只有Tyr、His、Cys吸收光谱会出现新的吸收峰。SNP反应结束后,吸收光谱中His与Met的最大吸收峰比较接近,Met的最大吸收峰处波长为513 nm,His的最大吸收峰处于402 nm与486 nm处。Cys、Tyr的最大吸收峰出现在350 nm左右,且Tyr此处峰值不大。其它氨基酸都没有出现新的吸收峰。因此,若想排除其它氨基酸对Met测定的影响,可以只考虑His的影响。
2.2 培养基成分对测定的影响

图1 不同氨基酸硝普钠反应吸收光谱Fig.1 Absorption spectra of sodium nitroprusside reaction with different amino acid
测定发酵液中Met含量时,培养基中营养成分分别和SNP进行反应,可以确定这些成分是否会对测定产生影响。图2明显可以看出,培养基成分葡萄糖、MgSO4、(NH4)2SO4等在513 nm虽然会有小于0.4的吸收值,但其颜色都属于黄色系列,未出现红色。消除影响的方法为利用无菌的空白培养基,按需加入各种试剂,反应结束后作为对照。所以培养基中的其他成分对硝普纳法分析Met的含量影响不大。需要避免的一点是,在配制培养基时,碳源最好单独配好、灭菌,之后无菌加入到其它成分的培养基中。最好保持培养基本身没有的颜色,以避免影响判断。如果培养基无可避免的有颜色,比如需要加入酵母膏,可以通过直接扫描光谱,分析在513 nm处是否出现吸收峰。虽然培养基中有些成分,在此会有吸收值,但不会出现吸收峰(图2)。通过计算峰高值(以513 nm左右处的基线为准),确定发酵液中Met含量。

图2 发酵培养基中各成分硝普钠反应吸收光谱Fig.2 Absorption spectra of sodium nitroprusside reaction with different components of the broth
2.3 SNP法各试剂的反应时间对吸收光谱的影响
通过依次加入各试剂,反应不同时间,测定扫描光谱,分析 NaOH、SNP、Gly、H3PO4各试剂在 SNP 法测定蛋氨酸所起的作用。如图3所示,随着加入NaOH与SNP后的反应时间的延长,395 nm处吸光值不断下降(反应 2、3、4、5、6、7、8、10、30 min 的吸收光谱曲线,因与9、20 min的吸收光谱曲线趋势一致,故省略)。Ahmed等[16]实验证明SNP在碱性条件下反应生成[Fe(CN)5NO2]4-离子,吸收峰在400 nm 左右,与本实验中395 nm处吸收峰接近,吸收峰下降,说明反应液中[Fe(CN)5NO2]4-离子随着反应时间的延长,离子形式或量在发生变化。
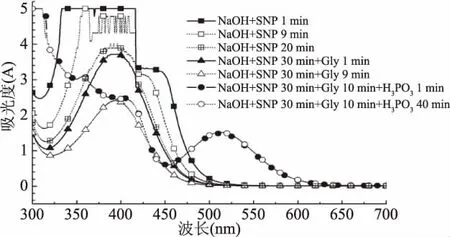
图3 蛋氨酸的硝普钠反应中依次加入各试剂并反应不同时间对吸收光谱的影响Fig.3 Absorption spectra of methionine with reagents of sodium nitroprusside reaction for different time
为确定加入NaOH与SNP后静置时间对最终反应结束后513 nm处吸光值的影响,设计了相应的实验,结果见图4。3种浓度的Met SNP法反应后吸光值趋势一致,随着静置时间的延长,A513nm先升高后稳定,反应30 min后出现平稳的趋势。所以后面实验中,静置时间设定为30 min。

图4 样液中加NaOH与硝普钠后放置时间对吸收值的影响Fig.4 The effect of reaction time after addition of sodium hydroxide and sodium nitroprusside reagents
图3中反应30 min后加入Gly,吸收光谱曲线形状无明显改变,只是500 nm以下的吸收值在不断下降。图中省略了反应2、3、4、5、6、7、8、10 min 吸收光谱图,吸收光谱曲线趋势与反应1、9 min时的一致,10 min的吸收光谱曲线与反应9 min的基本重合。加入H3PO4后,峰形很快出现变化,最大吸收峰出现在513 nm处,说明形成新的物质。反应1 min或反应40 min,曲线接近重叠,即时间的延长毫无意义(图3省略了其它反应时间,因与1 min时的吸收光谱几乎重叠)。综上所述,加入NaOH与SNP后,反应30 min;加入Gly后,反应时间10 min;加入H3PO4后,反应1 min后,吸收光谱已基本无变化,但为了方便测定,反应时间统一为5 min。
2.4 SNP法中试剂添加量对吸收值的影响
图5 ~6是SNP反应过程中各加入试剂的量对吸光值的影响。结果显示,Gly、5 mol/L NaOH、SNP、H3PO4四种试剂的添加量对SNP反应均有影响。H3PO4与NaOH不加入时,513 nm处没有吸收峰出现,吸收值为0。说明SNP反应中,必须加入H3PO4与NaOH。但H3PO4的添加量大于1 mL时,吸光值基本不变;5 mol/L NaOH加入量大于0.5 mL后,吸光值明显下降,可能与多余的NaOH改变液体离子电荷有关;Gly的加入使吸收值一直在下降。图6表明,3种浓度 Met的 SNP法反应的吸光值均随着10%SNP添加量的增加呈现出先上升后平稳的趋势。当添加量大于0.25 mL时,当Met含量为0.25 g/L时,吸光值有轻微下降趋势;而浓度为0.5、0.75 g/L,吸光值仍在上升,且二者吸光值接近。为了响应面数据更准确,将SNP添加量选择在0.15与0.30 mL中间。所以,在响应面设计中以Gly、5 mol/L NaOH、SNP为变量,中心点分别为 1.0、0.5、0.22 mL。

图5 三种试剂的添加量对蛋氨酸-硝普钠反应的影响Fig.5 The effect of the addition of three reagents on the reaction of methionine with sodium nitroprusside reagents

图6 硝普钠添加量对吸收值的影响Fig.6 The effect of the addition of sodium nitroprusside on the reaction
2.5 响应面优化SNP法
整个反应是连续的,为了使量更确定,做了三因素的响应面分析(表1~3)。通过响应面分析得出A513nm=0.83+4.28A-4.24B-0.72C-0.82AB-0.51AC-0.21BC-2.64A2+10.32B2+0.29C2(A、B、C 均为实际值)。模型方差分析,p为0.0053<0.01极显著,失拟项概率0.2913>0.05,说明无失拟因素存在。R2校正值为0.8054(>0.8),与R20.9149相近,说明回归效果较好,能够预测不同反应试剂量下,SNP法吸收值的大小。
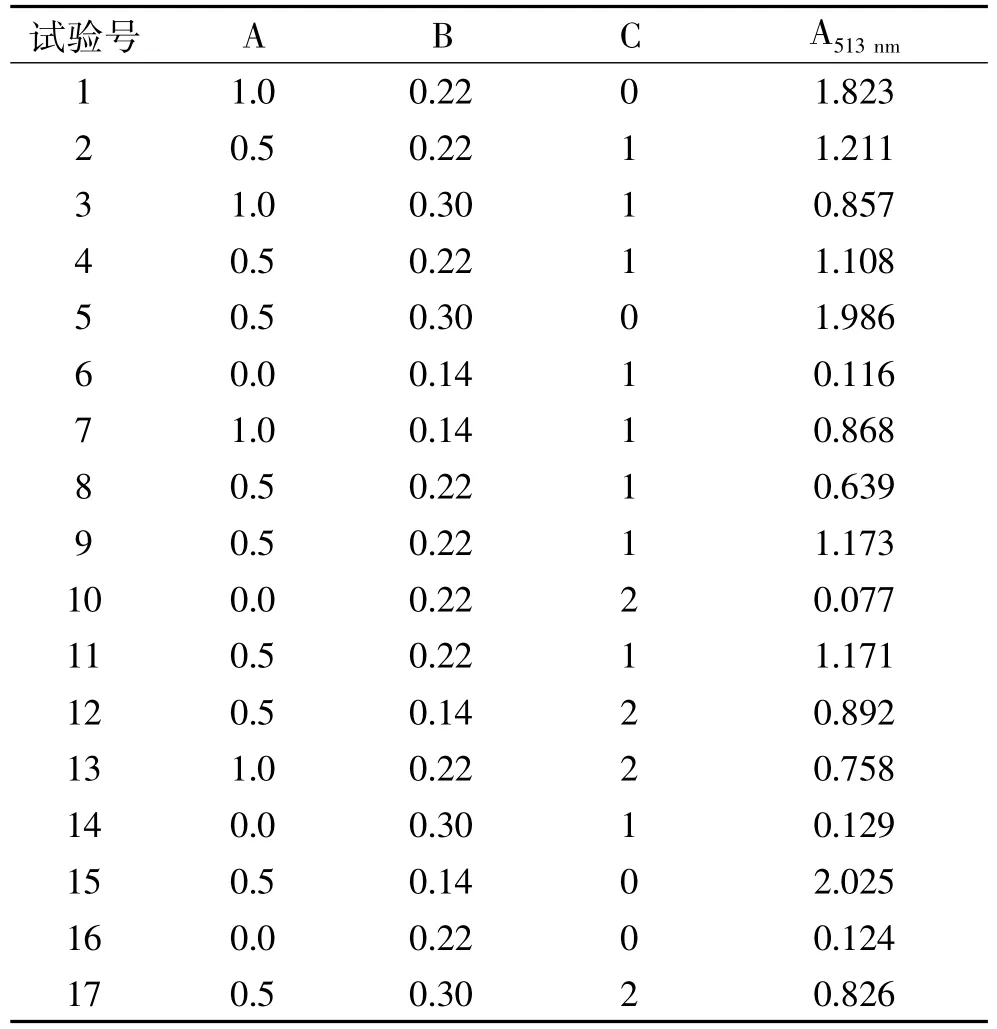
表2 响应面试验设计及结果Table 2 Design and results of the response surface experiment
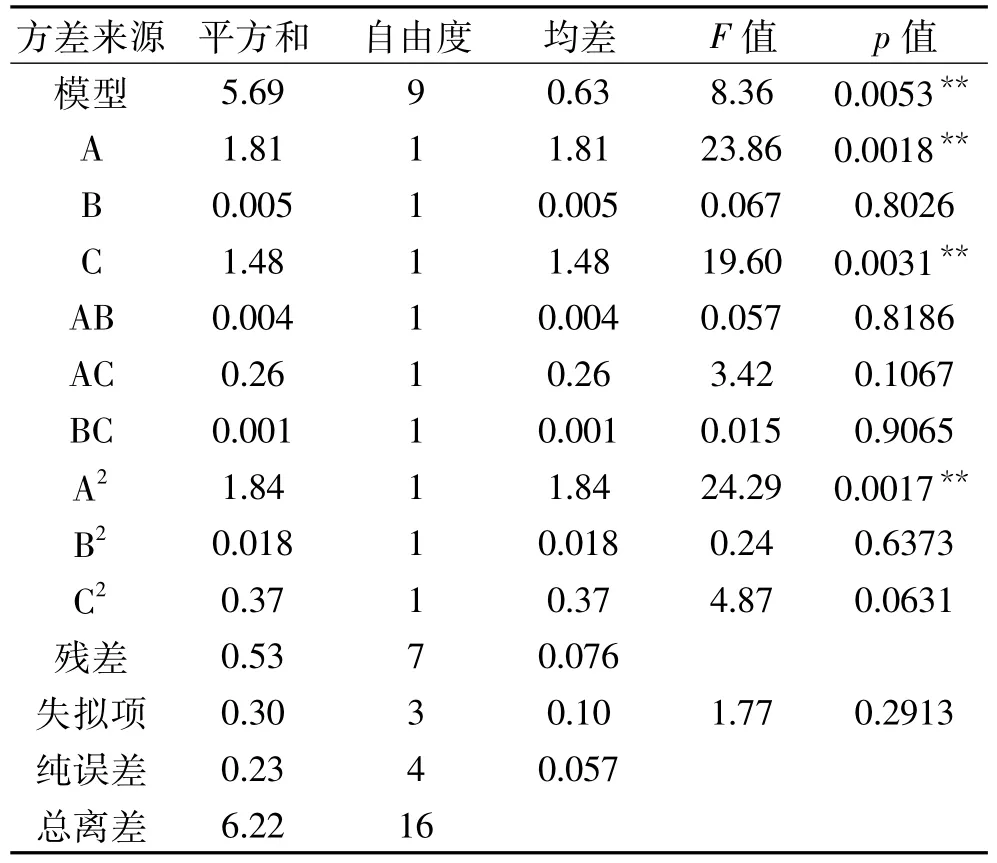
表3 响应面方差分析Table 3 Analysis of variance for response surface experiment
表3说明,NaOH与Gly对吸光值的影响极其显著(p<0.01),不可忽视;三个因素间的交互影响不显著(p>0.05)。图7显示出NaOH的影响存在最高值,此时5 mol/L NaOH的量约为0.6~0.9 mL,与单因素实验的趋势相似;3%Gly水溶液(图7(b))对吸光值的影响也极显著,最佳添加量趋于0 mL,与单因素实验结果相同;而10%的SNP试剂(图7(a))的添加量在0.14~0.30 mL之间对吸光值的影响不大,与单因素实验略有出入。

图7 响应面分析等高线图Fig.7 The contour graphics of response surface design
利用Design-expert软件,根据响应面数据计算最佳条件,得出SNP法测定最佳条件为:5 mol/L NaOH添加量为0.74 mL,10%SNP添加量为0.15 mL,3%Gly添加量为0 mL,预测的A513nm为2.059。经实验验证,1.0 g/L Met经优化后的SNP法测定,A513nm均值为1.952,与预测值接近。
2.6 Gly对Met吸收光谱的影响
图8分析比较了测定Met吸收光谱时,Gly对吸收光谱的影响。加入Gly时,无论样品中是否含有His,513 nm处的吸收峰值都明显变小。而且发酵液中同时存在Met与His,加入Gly时,其吸收值降得更低。总之,Gly的存在,不仅会降低His与SNP反应的吸收值,也会降低Met与SNP反应吸收值,所以依靠Gly消除His的影响的同时,也会降低测定Met的灵敏度。
为消除His的影响,1970年Smith等在反应过程中加入Gly[14]。图8中,单独存在 Met时,最大吸收峰出现在513 nm处,单独存在His时,最大吸收峰出现在486、402 nm 处(图1(a)),Met与 His混合时,最大吸收峰出现在510 nm处。由此可以说明,如果有其它试剂的干扰,最大吸收峰会发生蓝移,实验时,可将Met标准品相同条件下与SNP试剂反应结果作为标准,进而确定结果。

图8 甘氨酸对蛋氨酸硝普钠反应吸收光谱的影响Fig.8 The affection of glycine on the absorption spectra of methionine after reaction with sodium nitroprusside
2.7 标准曲线的绘制
通过测定不同浓度的Met与SNP反应后其最大吸收峰及吸收值的大小。图9两张图表明0~1.4 g/L不同含量的Met在513 nm处的吸光值出现由小到大的线性关系。当浓度为1.2 g/L时,吸光值已经大于2.0。当浓度>1.6 g/L时,吸光值大于3.0,且513 nm处吸收峰出现明显波动(图9(a))。为了检测准确,浓度范围尽量选择在0~1.0 g/L。

图9 不同浓度蛋氨酸硝普钠反应的吸收光谱与标准曲线Fig.9 The standard curve of methionine with sodium nitroprusside reaction
3 结论
SNP法测定发酵液中Met含量时,其中Gly的加入,不仅会降低His与SNP反应后的吸收值,同时会降低Met和SNP反应后的吸收值。利用扫描光谱的方式,可以发现,样品中如果存在His,吸收峰会出现蓝移。证实可利用SNP法排除其它氨基酸的干扰,测定发酵液中是否含有Met。通过单因素实验和响应面试验,优化了SNP法中各试剂添加量与反应时间。结果为:发酵液1500×g离心15 min,5 mL上清液中加入0.74 mL 5 mol/L NaOH和0.15 mL 10%SNP溶液,摇匀试管,放置30 min;将2 mL浓H3PO4逐滴加到混合物中,振荡试管,反应5 min,在513 nm处测吸收值。
用SNP法测定发酵液中Met含量:先利用紫外分光光度计扫描光谱,判断最大吸收峰的位置。确定有Met时,利用优化后的SNP法测定发酵液中Met含量。为了增加SNP反应的灵敏度,不加Gly。菌种筛选时,利用此方法可以迅速分辨出哪些菌株是Met高产菌株。此测定方法具有被广泛使用的价值。
