酶法预处理对花生油脂体稳定性的影响及酶法破乳工艺优化
2019-01-26赵自通陈复生周龙正
赵自通,陈复生,周龙正
(河南工业大学粮油食品学院,河南郑州450001)
花生种植历史悠久,早在公元前2000年左右南美洲地区就有人开始种植花生,随后辗转传播到世界各地[1]。目前花生已经是世界上主要油料作物之一,而我国的花生产量占全世界花生总产量的40.8% ,位居世界第一[2-3]。花生油营养价值丰富、色泽清亮、滋味可口,是我国人民日常生活中必不可少的食用油。但是传统的压榨法和浸出法取油都是以提取得到更多的油脂为导向,得到的花生蛋白变性严重,功能性质明显下降,限制了其在食品工业中的应用[4-5]。
随着科技的发展,酶制剂的生产成本不断降低,而且由于酶制剂的高效专一、反应条件温和、安全环保等优点,非常符合当前我国倡导的绿色可持续发展的要求,使得酶制剂在食品工业中的应用愈加广泛[6-7]。因此,为了减少油料资源的浪费,使油料资源的利用更加安全绿色、可持续发展,研究人员在水剂法的基础上提出了提取条件温和、绿色、安全,且可以同时得到花生蛋白和油脂的水酶法提取工艺。
水酶法是在对油料进行机械破碎的基础上,利用酶制剂来降解植物油料细胞的细胞壁及其内部结构,再以水为溶剂利用非油成分(蛋白质和碳水化合物)对油和水的亲和力差异,以及油水比例的差异将油和非油成分进行分离的技术[8]。但是由于存在一些限制因素的影响,使得大多数油料的水酶法提取工艺都处在理论研究阶段,并没有得到大规模得工业化应用。其中水酶法乳状液的破乳是限制其工业化应用的一个关键因素,这是由于在水酶法萃取体系中同时存在大量的油脂和蛋白质,造成乳化现象严重难以破乳[9]。因此,研究如何解决水酶法工艺过程中的破乳难题对水酶法的推广应用至关重要。而且目前关于水酶法提油及蛋白研究中使用的酶制剂基本都是蛋白酶或者蛋白酶与其他酶类的复配,在提取过程中由于蛋白酶的水解作用,所得到的蛋白产品为蛋白质水解产物,限制了花生蛋白在食品工业中的应用。
本研究在传统花生水酶法工艺基础上进行改进,先使用复合植物水解酶先将花生中的油脂体和花生蛋白分离,然后对花生油脂体破乳工艺进行优化得到花生油脂,以期为水酶法提取工艺提供新的思路,促进水酶法提取技术的工业化应用。
1 材料与方法
1.1 材料与仪器
花生(开农1715) 河南省开封市农林科学研究院;复合植物水解酶(Viscozyme L) 丹麦诺维信(北京)有限公司;木瓜蛋白酶(酶活:800 U/mg) 上海源叶生物科技有限公司;其他试剂 均为国产分析纯。
BT-9300H型激光粒度分布仪 辽宁丹东市百特仪器有限公司;FW-100型高速万能粉碎机 北京市永光明医疗仪器有限公司;BSA224S-CW型分析天平 赛多利斯科学仪器(北京)有限公司;THZ-82型数显水浴恒温振荡器 金坛华峰仪器有限公司;K1100型全自动凯氏定氮仪 山东济南海能仪器股份有限公司;FM200型均质机 上海弗鲁克流体机械制造有限公司;LGJ-25型低速冷冻干燥机 北京四环科学仪器厂有限公司;TDL-5A型离心机 上海安亭科学仪器厂;CX41型光学显微镜 奥林巴斯(中国)有限公司。
1.2 实验方法
1.2.1 花生油脂体的提取方法 将脱红衣花生用高速万能粉碎机粉碎10 s,称取粉碎后的花生20 g,按料液比1∶3.5加去离子水,均质5~10 s(转速7800 r/min)使样品充分混匀后加入复合植物水解酶。在52℃水浴恒温振荡器中振荡提取90 min,充分酶解。酶解结束后于沸水浴中灭酶5 min,取出后冷却。将冷却后的样液转移至离心管以5000 r/min离心20 min。分别得到上层油脂体、水相和下层沉淀。取出上层油脂体置于4℃冰箱中备用(样品放置时间不能超过24 h)。复合植物水解酶提取花生油脂体的工艺流程如图1所示。

图1 复合植物水解酶提取花生油脂体工艺流程图Fig.1 Flowchart for extracting peanut oil bodyby Viscozyme L
1.2.2 花生及油脂体基本成分的测定 花生及油脂体油脂含量测定:参照GB/T 5009.6-2016中的索氏抽提法测定花生及油脂体的油脂含量;花生及油脂体蛋白含量的测定:参照GB/T 5009.5-2016中蛋白质的测定方法,利用全自动凯氏定氮仪测定花生及油脂体的蛋白含量;花生及油脂体水分含量的测定:参照GB/T 5009.3-2016中的直接干燥法测定花生及油脂体的水分含量。
1.2.3 预处理对花生油脂体稳定性的影响
1.2.3.1 粉碎时间对花生油脂体稳定性的影响 取100 g脱红衣花生分别于万能粉碎机中粉碎5、10、15、20、25、30 s,按照 1.2.1 中的方法提取花生油脂体,参考 Hao等[10]的方法将油脂体按 1∶10(g/mL)稀释于纯水,充分振荡混匀后,将激光粒径分析仪调整到自动测试模式,分析样品粒径分布。
1.2.3.2 烘烤温度对花生油脂体稳定性的影响 取100 g未脱红衣花生,放入烘箱中分别在60、80、100、120、140、160℃条件下进行烘烤后冷却脱红衣,按照1.2.1中的方法提取花生油脂体后将油脂体按1∶10(g/mL)稀释于纯水,充分振荡混匀后,将激光粒径分析仪调整到自动测试模式,分析样品粒径分布。同时将油脂体稀释10倍,在数码显微镜下进行观察拍照。
1.2.4 破乳方法 参考赵翔等[11]的方法取适量油脂体于50 mL离心管中,以一定比例的去离子水稀释,加入一定量的木瓜蛋白酶,将样品置于恒温水浴振荡器中,调节至适宜的温度,反应一段时间后取出灭酶,冷却后5000 r/min离心20 min,取出上层游离清油并称重,按下式计算破乳率:

式中:m1为破乳后得到的清油质量(g),m为称取样品的质量(g),ω为油脂体的含油量(%)
1.2.5 破乳单因素实验
1.2.5.1 酶解温度对花生油脂体破乳率的影响 选取酶解温度为40、45、50、55、60、65、70 ℃,料液比为1∶5 w/v,酶浓度为 1400 U/g,酶解时间为 3 h,按照1.2.4的实验方法进行酶法破乳实验,考察酶解温度对破乳率的影响。
1.2.5.2 酶浓度对花生油脂体破乳率的影响 选取酶浓度为 400、600、800、1000、1200、1400、1600、1800 U/g,酶解温度为55 ℃,料液比为1∶5 w/v,酶解时间为3 h,按照1.2.4的实验方法进行酶法破乳实验,考察酶浓度对破乳率的影响。
1.2.5.3 酶解时间对花生油脂体破乳率的影响 选取酶解时间为 1.0、1.5、2.0、2.5、3.0、3.5、4.0 h,酶解温度为55 ℃,料液比1∶5 w/v,酶浓度为1400 U/g,按照1.2.4的实验方法进行酶法破乳实验,考察酶解时间对破乳率的影响;
1.2.5.4 料液比对花生油脂体破乳率的影响 选取料液比为 1∶1、1∶2、1∶3、1∶4、1∶5、1∶6 w/v,酶解温度为55℃,酶浓度为1400 U/g,酶解时间为3 h,按照1.2.4的实验方法进行酶法破乳实验,考察料液比对破乳率的影响。
1.2.6 响应面优化试验 在单因素实验的基础上,根据响应面设计原理[12],选取酶解温度(A)、酶浓度(B)、酶解时间(C)三个影响因素。设计三因素三水平响应面优化实验,进一步优化确定木瓜蛋白酶破乳的最佳条件,响应面设计因素水平见表1。
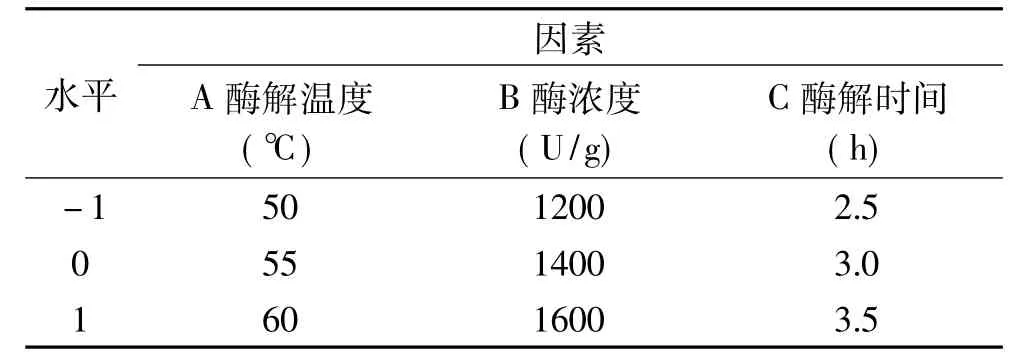
表1 响应面因素水平表Table 1 Factors and levels of response surface methodology
1.3 数据处理
实验数据以平均值±标准差(Mean±SD)表示。采用 Microsoft Office Excel 2013、SPSS 22.0、Design-Expert V8.0.6数据分析工具进行处理,并用Duncan多重比较法检验各处理之间的差异显著性,p<0.05表示差异显著。
2 结果与分析
2.1 花生及油脂体的主要成分
由表2可知,在花生种子中油脂及蛋白质的含量分别达到了51.55%和26.70%,因此花生不仅是优质的植物油料资源也是优质的植物蛋白资源。而经过复合植物水解酶初步提取后得到的花生油脂体中脂肪含量高达76.44%,而大量优质未被蛋白酶酶解的花生蛋白已被分离出去,因此油脂体中的蛋白质含量仅为2.25%左右,但有研究表明油脂体蛋白是影响油脂体稳定性的关键因素,蛋白质作为界面活性物质吸附或镶嵌在油脂体表面,其庞大的分子结构在界面展开使内部疏水氨基酸暴露[13-14],由于共价交联及非共价相互作用形成一层具有一定强度及带电性的蛋白膜,维持了油脂体三维结构的稳定性[15]。因此,利用蛋白酶作用破坏膜蛋白的结构,进而促进油脂体的聚集融合能达到较好的破乳效果[9]。
2.2 预处理对花生油脂体稳定性影响
2.2.1 粉碎时间对花生油脂体稳定性的影响 花生油脂体的粒径大小是衡量花生油脂体稳定性的一个重要指标,花生油脂体的粒径越大,说明花生油脂体越容易发生聚集融合,花生油脂体越不稳定,相反则说明花生油脂体越稳定[16-17]。由图2 可知,花生粉碎时间对复合植物水解酶提取的花生油脂体粒径大小有显著影响(p<0.05);在选定的粉碎时间内,随着粉碎时间的增加,花生油脂体的粒径表现出先增加后降低的趋势,并且可以清楚的看到,在粉碎时间为10 s时,花生油脂体的中位粒径与体积平均粒径最大,说明在此条件下所得到的花生油脂体更加不稳定,有利于后期的破乳。朱凯艳等[18]的研究也发现花生的粉碎程度对水酶法乳状液的稳定性有很大影响,适度粉碎可以降低工艺中产生的乳状液稳定性,但当原料粒径降低到最低值后继续粉碎,会导致水酶法乳状液稳定性增加。
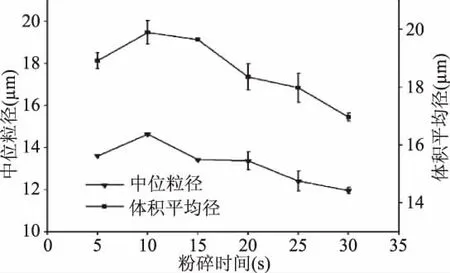
图2 粉碎时间对花生油脂体的粒径的影响Fig.2 Effects of grinding time on the particle size of the peanut oil body
2.2.2 烘烤温度对花生油脂体稳定性的影响 由图3可知,随着烘烤温度的增加,复合植物水解酶提取得到的花生油脂体的中位粒径和体积平均粒径都显著增加(p<0.05),这可能是因为随着烘烤温度的增加,花生中的水分减少,花生质地变脆,在粉碎时花生子叶细胞更易破碎,使花生油脂体聚集融合,最终导致花生油脂体的粒径变大。
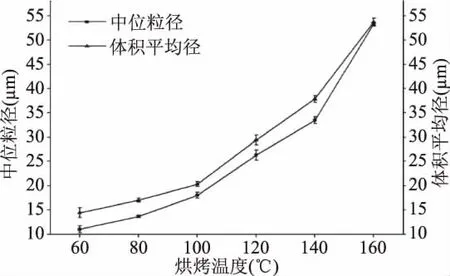
图3 烘烤温度对花生油脂体的粒径的影响Fig.3 Effects of baking temperature on the particle size of the peanut oil body
通过图4油脂体的粒径分布可以看到,在较低的烘烤温度下,花生油脂体的粒径分布呈现出双峰状态,但随着温度的增加小于中位粒径的油脂体数量逐渐减少,最终花生油脂体的粒径不断增加,而且其分布状态也由双峰状态逐渐变为单峰状态。
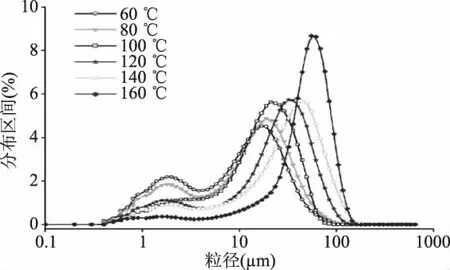
图4 不同烘烤温度所得花生油脂体的粒径分布Fig.4 Particle size distribution of peanut oil body obtained at different baking temperature
结合显微镜照片(图5)发现,随着烘烤温度的增加,花生油脂体的体积增大,更容易发生聚合,说明花生原料经过高温烘烤后可以促进花生油脂体的聚合,有利于油脂的提取。

表2 花生和花生油脂体的主要成分Table 2 Proximate analysis of peanut andpeanutoilbody
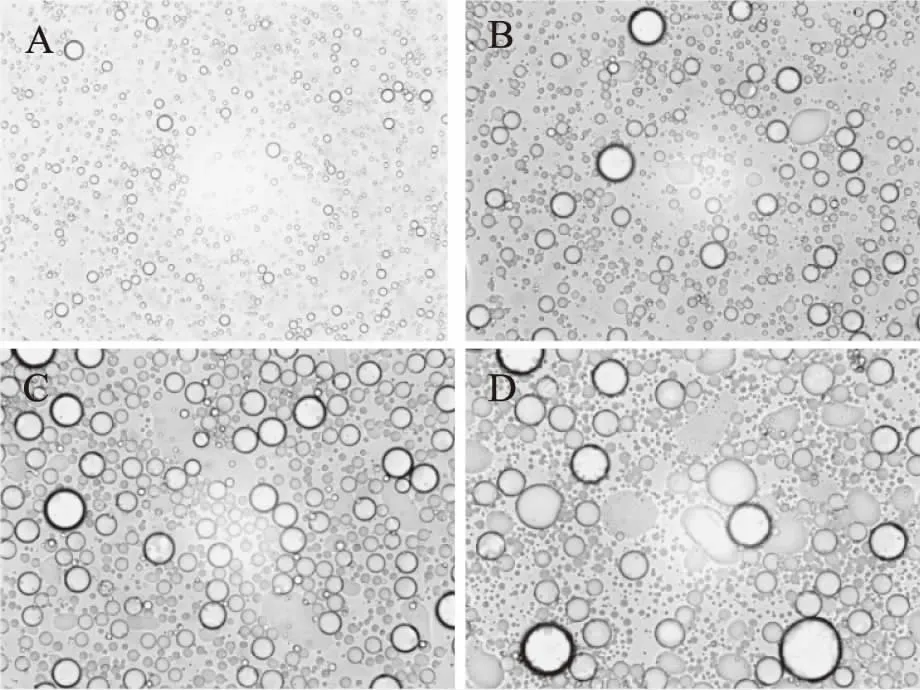
图5 不同烘烤温度所得花生油脂体的显微照片(400×)Fig.5 Micrograph of peanut oil body obtained at different baking temperatures(400×)注:A、B、C、D分别为60、80、100、120℃烘烤后花生油脂体的显微照片。
2.3 破乳单因素实验
2.3.1 酶解温度对花生油脂体破乳率的影响 酶解温度对花生油脂体破乳率的影响规律如图6所示,当酶解温度由40℃上升到55℃时,随着温度的增加,花生油脂体的破乳率呈现出逐渐增加的趋势,并且在温度为55℃时达到最大值;这可能是由于随着温度的升高,酶解温度不断接近木瓜蛋白酶的最适反应温度,使得木瓜蛋白酶的作用效果增强。但是当酶解温度继续增加时,花生油脂体的破乳率表现出逐渐降低的趋势,这可能是由于在酶解温度达到木瓜蛋白酶的最适温度后继续增加酶解温度,反而使得木瓜蛋白酶的酶活因过高的温度而受到抑制,导致破乳率下降[19-20]。因此将后续响应面优化实验的酶解温度范围确定为50~60℃之间。
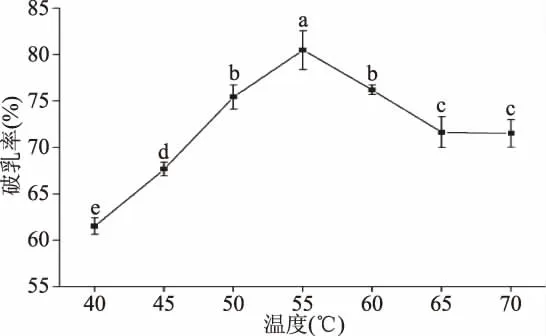
图6 酶解温度对花生油脂体破乳率的影响Fig.6 Effect of enzymolysis temperature on the demulsification rate of peanut oil body
2.3.2 酶浓度对花生油脂体破乳率的影响 酶浓度对花生油脂体破乳率的影响规律如图7所示,随着酶浓度的不断增加花生油脂体的破乳率呈现出先增加后逐渐平稳的趋势,并且在酶浓度为1400 U/g的时候破乳率达到最大值。由酶促反应的特性可知,在酶浓度较低的时候,酶制剂的数量相对于底物的数量较少,此时酶的数量是限制酶促反应素的主要限制因素,因此增加木瓜蛋白酶的浓度,花生油脂体的破乳率表现出增加的趋势;但是随着酶浓度的逐渐增加,酶促反应的速度达到最大值,由于酶促反应受“底物饱和效应”的影响,破乳率呈现出逐渐平稳的趋势[21]。因此综合考虑破乳率和经济因素的影响,选取酶浓度为1200~1600 U/g作为后续响应面优化实验范围。
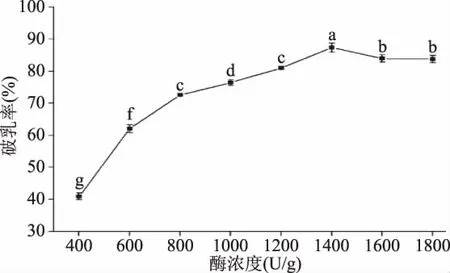
图7 酶浓度对花生油脂体破乳率的影响Fig.7 Effect of enzyme concentration on the demulsification rate of peanut oil body
2.3.3 酶解时间对花生油脂体破乳率的影响 酶解时间对花生油脂体破乳率的影响规律如图8所示,在酶解时间由1 h逐渐增加到4 h的过程中,花生油脂体的破乳率呈现出逐渐增加的趋势,并且在酶解时间为3 h时破乳率达到最大值,此后继续增加酶解时间,破乳率不再继续增加。这可能是由于在一定的酶浓度下,随着酶解时间的增加,蛋白质被不断的降解,在3.0 h左右的时候油脂体蛋白几乎被完全降解,此后继续酶解破乳率不再继续增加。因此综合考虑破乳率和生产经济成本选择2.5~3.5 h的时间范围进行后面的响应面优化实验。
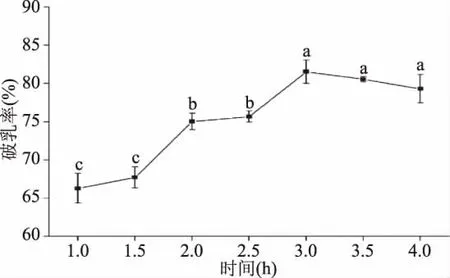
图8 酶解时间对花生油脂体破乳率的影响Fig.8 Effect of different enzymolysis time on the demulsification rate of peanut oil body
2.3.4 料液比对花生油脂体破乳率的影响 料液比对花生油脂体破乳率的影响规律如图9所示,在选定的料液比范围内料液比对破乳率的影响呈现出先增加后降低的趋势,在料液比为1∶3时油脂体的破乳率最高达到了92.39%。而后继续增加料液比,破乳率呈现出显著的降低的趋势(p<0.05)。这可能是因为在相同的酶浓度下,较低的料液比实际上使破乳体系中单位体积内的酶浓度变的相对较高,而此时适当增加料液比,可以增大木瓜蛋白酶与油脂体蛋白的接触机率,因此提高了酶解速度进而使破乳率增加。但是当料液比过大时,破乳体系中单位体积的酶浓度被稀释,减少了木瓜蛋白酶分子与底物分子的碰撞几率,酶解速率下降导致破乳率降低[22]。因此选择料液比为1∶3进行后续实验。
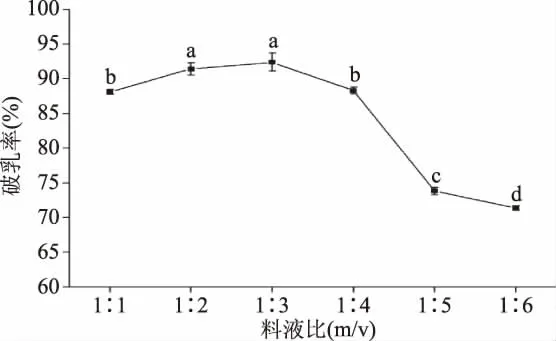
图9 料液比对花生油脂体破乳率的影响Fig.9 Effect of material-to-liquid ratioon the demulsification rate of peanut oil body
2.4 响应面优化试验
2.4.1 响应面试验设计结果 由Design-Expert 8.0.6统计分析软件的实验设计功能可知,以花生油脂体的破乳率为响应值(Y),以酶解温度(A)、酶浓度(B)、酶解时间(C)为自变量,建立三因素三水平的Box-Behnken设计包括17个实验方案,具体的实验方案及实验结果如表3所示。利用Design Expert 8.0.6软件对实验结果进行回归拟合分析,得到酶解温度(A)、酶浓度(B)、酶解时间(C)三个因素对花生油脂体破乳率的二次回归方程为:Y=91.76+1.63A+4.89B+1.33C-0.51AB+0.34AC+0.21BC-14.47A2+1.54B2-9.72C2。
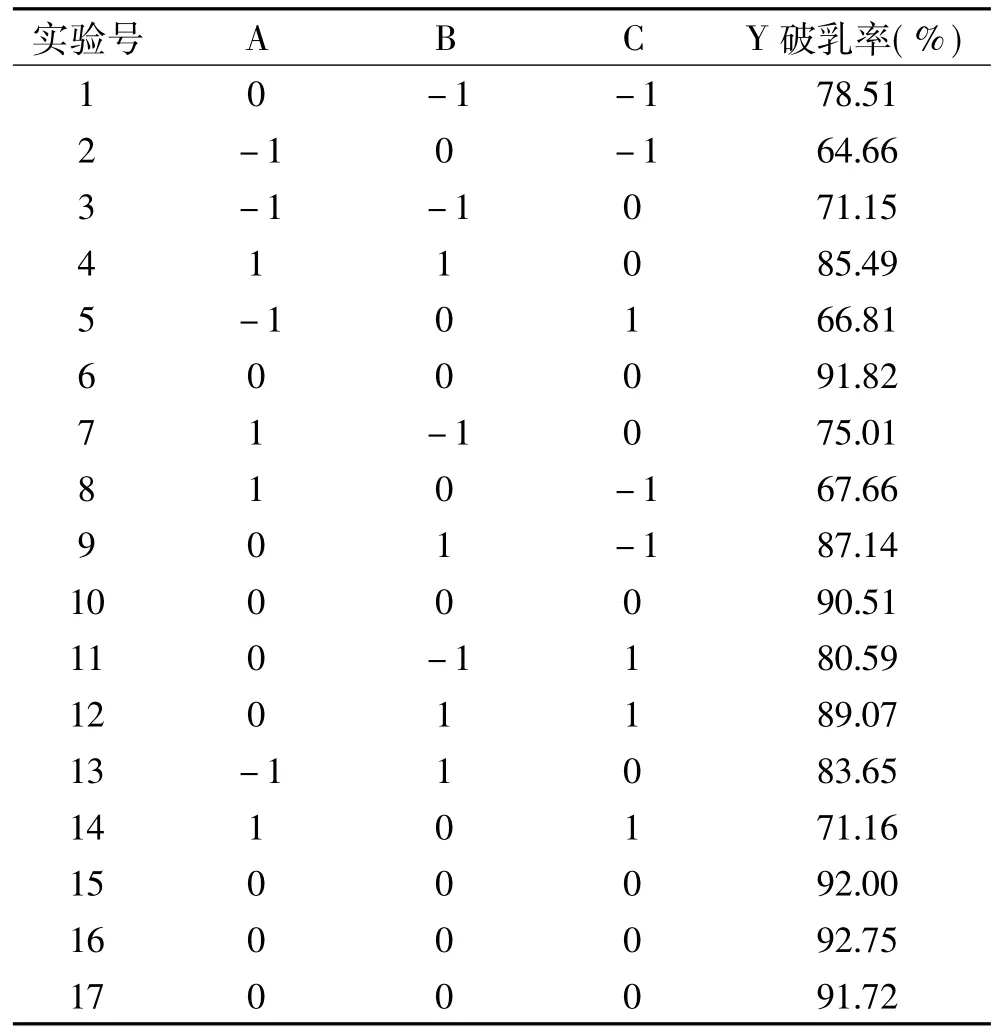
表3 响应面实验设计及结果Table 3 Design and results of response surface analysis
对响应面分析中得到的花生油脂体破乳率Y的二次模型方程进行方差分析,结果如表4所示,由方差分析的结果可知回归方程模型检验极显著(p<0.01),而失拟项检验不显著(p>0.05),且得到的回归模型的R2=0.9944,R2adj=0.9872,说明回归模型拟合程度较好,具有一定的可靠性,可以用来预测花生油脂体破乳工艺的结果。花生油脂体破乳率响应面方程的一次项:酶解温度(A)、酶浓度(B)、酶解时间(C)和其分别对应的二次项:A2、B2、C2均显著(p<0.05),根据平方和判断各因素影响顺序依次为:酶浓度>酶解温度>酶解时间。
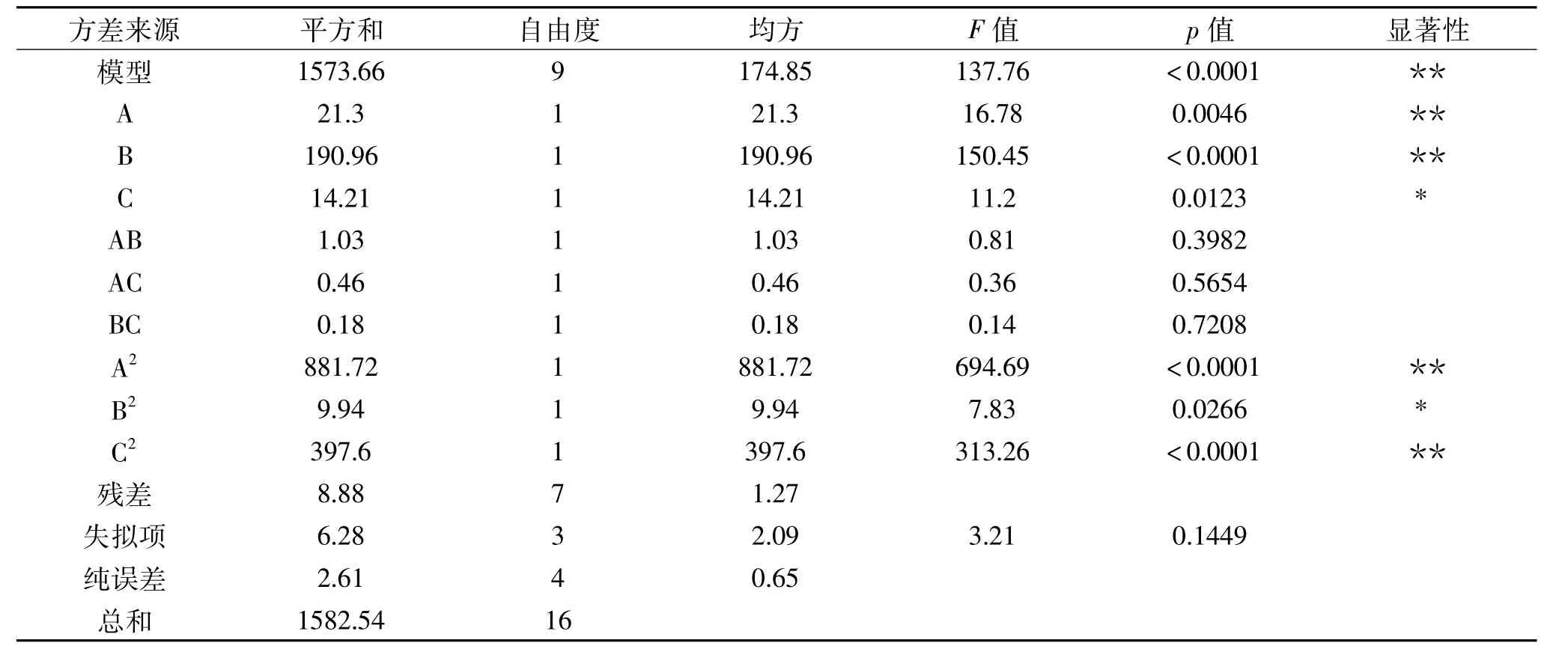
表4 回归模型及方差分析Table 4 Variance analysis of regression equation
各因素的交互作用对破乳率的影响如图10所示。通过观察响应面的变化情况和等高线的稀疏程度可直观地反映温度(A)、酶浓度(B)、酶解时间(C)之间的交互作用对花生油脂体破乳率的影响,当等高线呈圆形时表示两因素交互作用对破乳率的影响不显著,而呈椭圆形或马鞍形时则表示两因素交互作用显著[23]。由图10可知,酶浓度(B)和酶解时间(C)、酶浓度(B)和温度(A)的等高线呈现出马鞍状,且酶浓度(B)和温度(A)的等高线较为密集,说明它们之间均存在交互作用,且酶浓度(B)和温度(A)之间的交互作用对破乳率的影响较大,但响应面坡度较为平缓,说明参数范围选择较小。而温度(A)和酶解时间(C)的等高线为圆形且在选定范围内有极值出现,说明温度(A)和酶解时间(C)交互作用对破乳率的影响不显著与表4的方差分析相符合。
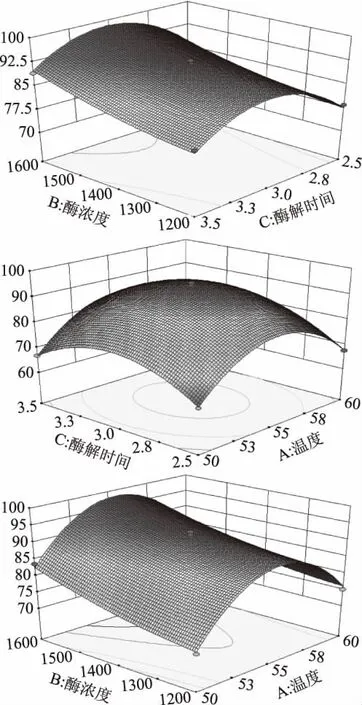
图10 两因素交互作用对破乳率影响的响应面图Fig.10 Response surface of two factors interaction effects on the demulsification rate
2.4.2 最佳破乳工艺的确定及验证 通过Design-Expert软件分析,得到木瓜蛋白酶对花生油脂体破乳的最佳工艺参数为:酶解温度58.26℃,酶浓度为1400.00 U/g,酶解时间为3.03 h,预测花生油脂体的破乳率为93.09%。考虑到实际条件,调整为酶解温度58℃,酶浓度为1400 U/g,酶解时间为3 h。在此条件下进行三组平行实验进行验证,得到的平均破乳率为93.44% ±0.82%,相对误差为0.38%,预测值与实际值吻合较好。
3 结论
本研究对传统水酶法工艺进行改进,采用复合植物水解酶提取花生油脂体,并进一步研究花生烘烤温度及粉碎时间对花生油脂体稳定性的影响,结果发现,在粉碎时间为10 s时所得到的花生油脂体的粒径最大,粉碎时间继续增加油脂体的粒径反而减小;此外在60~160℃温度范围内,油脂体粒径随着烘烤温度的增加而不断增加,且粒径分布由双峰逐渐过渡为单峰状态。此外根据响应面优化试验得到木瓜蛋白酶破乳的最佳条件为:酶解温度58℃,酶浓度1400 U/g,酶解时间3 h,料液比1∶3(w/v),在此条件下预测花生油脂体的破乳率为93.09%。选择最佳实验条件进行三组平行实验验证,得到平均破乳率为93.44% ±0.82%,相对误差为0.38%,预测值与实际值吻合较好。
