离子液体溶解细菌纤维素工艺优化及性能
2019-01-26王学川李丹妮
张 雯,王学川,李丹妮
(1.陕西科技大学食品与生物工程学院,陕西西安710021;2.陕西科技大学轻工科学与工程学院,陕西西安710021)
细菌纤维素(Bacterial cellulose,BC)指由生长在液态含糖基质中的细菌产生,并分泌到基质中的纤维素,是葡萄糖以β-1,4糖苷键连接而成的高分子聚合物,呈半透明凝胶状,因其是由细菌合成而命名为BC。BC对人体有许多独特的功能,如增强消化功能、预防便秘、吸附与清除食物中有毒物质、优化消化系统内环境而起到抗衰老作用等[1-2]。BC被认为是目前发现的性能最为优良的膳食纤维之一,对人体健康有诸多益处,被称作“白色金矿”[3],深受广大消费者的喜爱。BC除了具备上述膳食纤维的优良性能外,还具有滑爽、嫩脆、细腻等独特的口感,同时其高保水性、高复水性、高凝胶强度、良好的弹性以及乳化稳定性等优良特性,使其能够作为食品中的增稠剂、成型剂、分散剂、乳化剂、稳定剂[4-10],在食品工业中具有广阔的应用前景[11]。
由于BC分子内部和分子间复杂的氢键及较高的结晶度[12],使其难溶于水和一般有机溶剂,在作为食品添加剂使用过程中,不易变形及改性,使其应用受到较大限制。因此BC的溶剂选择和溶解工艺的优化成为了研究热点。在众多纤维素的新型溶剂体系中,离子液体以其无味、低蒸汽压、良好的热稳定性和化学稳定性、优良的纤维素溶解能力等特性得到了广泛关注,被认为是替代挥发性有机溶剂的新型绿色溶剂[13]。咪唑类氯盐氯化-1-烯丙基-3-甲基-咪唑(1-allyl-3-methylimidazolium chloride,AmimCl)中存在大量的游离态Cl-,以其较强的电负性结合纤维素中羟基上的H原子,大大削弱了纤维素分子间和分子内的氢键作用;因离子液体的阳离子侧链上含强极性烷基键,使其更易与纤维素形成络合物,从而进一步削弱纤维素的氢键作用。因此,随着离子液体的不断渗入,纤维素聚集态结构逐渐被破坏,最终被溶解[14]。
本研究拟采用AmimCl溶解BC,研究其最优溶解工艺,同时利用傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)、X-射线衍射(X-Ray diffraction,XRD)、扫 描 电 镜 (Scanning electron microscope,SEM)及热重-差示扫描量热(Thermogravimetric analysis-differential scanning calorimetry,TG-DSC)等现代检测技术研究溶解前后BC的材料学性能变化,探索离子液体溶解过程对BC的影响,以期为BC提供一种新型高效溶解途径,为BC作为食品添加剂进行广泛应用奠定一定的理论技术基础。
1 材料与方法
1.1 材料与仪器
菌种:木糖葡糖酸醋杆菌(Gluconacetobacter xylinus) 本实验室保藏;AmimCl、1,3-二甲基-2-咪唑啉酮(DMI)、溴化1-乙基-3-甲基咪唑 上海笛柏生物科技有限公司;固体培养基 蔗糖50.00 g、牛肉膏15.00 g、磷酸氢二钠4.40 g、柠檬酸0.80 g、琼脂18.00 g、乙醇10 mL、自来水1000 mL、pH6.0;种子培养基 蔗糖50.00 g、牛肉膏15.00 g、磷酸氢二钠4.40 g、柠檬酸 0.80 g、乙醇 10 mL、自来水 1000 mL,pH6.0;基本发酵培养基 蔗糖50.00 g、牛肉膏15.00 g、乙醇10 mL、酒糟水解液1000 mL,p H6.0;其余试剂国产分析纯或生化试剂。
S-4800电镜扫描仪 日本日立公司;D/max2200PC全自动X-射线衍射仪 日本Rigalcu;VERTEX 70傅立叶变换红外光谱仪 德国 Brucher公司;STA449F3-1053-M热重分析仪 德国耐驰仪器制造有限公司;MG250B恒温培养箱、HYG-1A恒温振荡器 上海新瑞仪器有限公司;XPS-8CA偏光显微镜 上海光学仪器有限公司;752型紫外分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 BC的制备 斜面培养:将木糖葡糖酸醋杆菌接种至斜面培养基中,置于30℃恒温培养箱中培养2~3 d得活化木糖葡糖酸醋杆菌;种子液制备:将活化木糖葡糖酸醋杆菌接种至种子培养基中,置于30℃恒温培养箱中培养1 d,之后将培养液于30℃,160 r/min振荡30 min以释放菌体细胞,得种子液;发酵培养:将种子液以20%接种量接种至发酵培养基(装液量30 mL/250 mL三角瓶),置于30℃恒温培养箱中静置培养10 d。
1.2.2 BC膜处理 将发酵液表面所形成的BC膜浸泡于0.10 mol/L NaOH溶液中,80℃下水浴30 min,之后继续加热煮沸2 h,再用蒸馏水反复冲洗至p H为 7.0[15-16],处理后的 BC 进行冷冻干燥(需称重的样品在冷冻干燥后置于鼓风干燥箱中,105℃条件下继续干燥至恒重)。
1.2.3 利用偏光显微镜观察BC在AmimCl中的溶解过程 将SMART-POL-T偏光显微镜的热台加热至110℃,在盖玻片上滴一滴AmimCl,用镊子从细菌纤维素上撕取少量纤维放入离子液体中浸润,迅速用另一盖玻片盖紧,实时观察溶解过程,并以一定的时间间隔(30~60 s)跟踪拍摄,直至完全溶解。
1.2.4 不同配比复合溶剂对BC溶解的影响 分别称取 AmimCl和 DMI共计10 g,使之配比分别为10∶0、8∶2、6∶4、4∶6,置于 250 mL 烧瓶中,110 ℃ 油浴,分别加入BC,每次加量为0.10 g,至总加入量为0.50 g,观察并记录溶解时间。
1.2.5 溶解温度对BC溶解的影响 称取复合溶剂10 g(AmimCl∶DMI=8∶2)分别置于温度为 90、100、110、115℃的油浴锅中,分别加入0.10 g BC,待其溶解后以0.10 g的增量继续加入BC,并记录每次溶解时间,直到加量达到0.50 g为止。绘制溶解时间随溶解温度的变化曲线。
1.2.6 投料量对BC溶解的影响 称取复合溶剂10 g(AmimCl∶DMI=8∶2)置于 250 mL 烧瓶中,110℃下油浴,分别以投料量1.0%、2.0%、3.0%、4.0%、5.0%、6.0%、7.0% 加入BC,观察并记录溶解时间。
1.2.7 BC的再生 上述1.2.4~1.2.6实验中,BC溶解完成后趁热以12000 r/min离心10 min,分离得到透明的BC/IL溶液和未溶解BC,用去离子水洗去未溶解BC上的离子液体,干燥后称重,记为W。上清液转移至烧杯中,分别加入五倍量的重蒸水作为沉淀剂,剧烈搅拌1 h,静置10 h,12000 r/min条件下离心10 min,收集沉淀进行干燥得再生 BC,称重,记为W1。分别按照下式计算BC溶液质量分数及BC再生率。
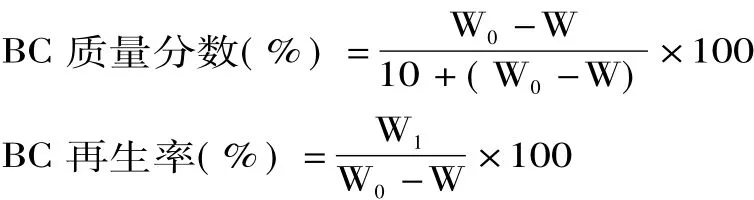
式中:W0为所投入BC干重(g),W为未溶解BC干重(g),W1为再生BC干重(g)。
1.2.8 离子液体溶解对BC性能的影响 离子液体溶解之前的BC记为BC-DZ,再生后的BC记为BCYP。利用FT-IR、XRD、SEM 及 TG-DSC 对 BC-YP及BC-DZ进行检测,研究离子液体溶解对BC性能的影响。
1.2.8.1 基团分析 采用傅里叶红外光谱[16]进行分析。样品处理:取适量样品采用KBr压片法进行压片,放入红外光谱仪中进行测定,扫描范围400~4000 cm-1,设定分辨率4 cm-1,扫描速度为0.2 cm/s,室温下操作。
1.2.8.2 结晶度分析 采用X-射线衍射光谱[16]进行分析。样品处理:样品平整固定在样品架上,铜靶,测试电压40 kV,测试电流100 mA,速率5°/min,步宽0.02°,2θ为0~80°范围扫描。根据X衍射参数,由下面两个计算公式分别计算细菌纤维素的结晶度(Xc)和晶体的粒径L。

式中:I为衍射峰的衍射强度;Iam为无定形区衍射强度;β为半峰宽(rad);k为常数,通常取0.89;λ为X射线波长(0.15406 nm);θ为布拉格衍射角。
1.2.8.3 表面形貌分析 采用扫描电镜[16]进行分析。样品处理:处理后的冻干样品置于液氮中,脆断处理,制样,喷金镀膜后利用扫描电子显微镜观察其微观结构,电压25 kV。
1.2.8.4 热稳定性分析 采用热重分析仪进行分析。温度范围0~800℃,升降温速率10℃/min,称量范围5~10 mg(小样品坩埚),氮气气氛。
1.3 数据处理
所有数据作三次平行,结果以平均值±SD表示,用 SPSS(PASW Statistics18)软件对数据进行处理。
2 结果分析
2.1 偏光显微镜下观察BC在离子液体AmimCl中的溶解过程
图1所示为BC在离子液体AmimCl中的溶解过程PLM图像。实验结果直观反映了离子液体AmimCl对于BC有较强的溶解能力。在偏光显微镜下观察到BC呈白色杆状晶体,随着受热时间的延长,纤维素出现部分溶解现象,结构变得疏松、纵裂和破碎。110℃条件下,纤维素晶体在30 min内完全溶解于AmimCl中,最后在视野中消失。实验过程中可观察到,在溶解初始阶段,BC溶解速度较快,11 min以后溶解速度减慢,可能与溶液粘度随着BC溶解量的增加而增加有关[13]。离子液体 AmimCl中存在大量的游离态Cl-,以其较强的电负性结合BC中羟基上的H原子,大大削弱了BC分子间和分子内的氢键作用。同时,因离子液体的阳离子侧链上含强极性烷基键,使其更易与BC形成络合物,从而进一步削弱BC内部氢键作用[14]。因此,随着离子液体的不断渗入,BC聚集态结构逐渐被破坏,最终被溶解。

图1 BC在[AMIM]Cl中的溶解过程PLM图像Fig.1 PLM images of BC dissolving in[AMIM]Cl at different time注:(A)3 min;(B)9 min;(C)11 min;(D)16 min;(E)19 min;(F)30 min。
2.2 不同配比复合溶剂对BC溶解时间的影响
不同配比复合溶剂对BC溶解时间的影响结果如图2所示。由图2可知,当 AmimCl∶DMI=4∶6,投料量为1.0%时,BC充分溶解需240 min,投料量增大至2.0%,在溶解时间为10 h时仍未观察到BC完全溶解。分析其原因主要是因为,复合溶剂中起溶解作用的AmimCl含量过低,含量较高的 DMI对BC只能起到溶胀作用,因此BC在有限时间内不能完全溶解;而当 AmimCl∶DMI=10∶0时,投料量 1.0% ~5.0%的BC在纯溶剂AmimCl中溶解所需时间也较长。当DMI在复合溶剂中的比例大于0且小于60%时,BC溶解时间缩短,表明其溶解速率有所提高,当BC投料量为4.0%及5.0%时,复合溶剂为AmimCl∶DMI=8∶2时BC溶解时间最短。DMI虽然不是BC的良好溶剂,却能够对 BC进行溶胀,进而缩短离子液体AmimCl溶解BC的时间,同时DMI能够降低BC溶液的粘度,加速 BC 溶解。Rinaldi[17]发现,BMIMCl中添加适量DMI能够加速纤维素的溶解,实验结论与本研究一致。待溶解反应结束后,利用水作为沉淀剂对BC溶液进行再生,实验结果如表1所示。

表1 不同配比复合溶剂溶解BC后的再生率Table 1 BC regeneration after dissolved in different ratio of double solvents
表1为投料量5%的BC在不同配比复合溶剂中溶解后BC的再生率。由表1可知,当AmimCl∶DMI=8∶2时BC再生率最高,达40.2%。当AmimCl作为纯溶剂溶解BC以及AmimCl∶DMI=6∶4时,BC再生率相对较低。由图2可知,BC在这两种复合溶剂中溶解所需时间相对较长,因此BC在溶解过程中所发生的降解程度也相对较大,使其再生率降低[12]。综上最优复合溶剂配比为 AmimCl∶DMI=8∶2。
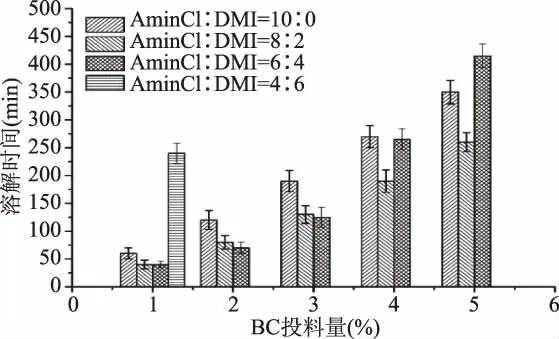
图2 复合溶剂配比对BC溶解时间的影响Fig.2 Effect of ratio of double solvents on BC dissolution time注:当 AmimCl∶DMI=4∶6,投料量大于 1.0%时,实验过程中溶解10 h所投入BC仍不能完全溶解,因此没有溶解时间数据。
2.3 溶解温度对BC溶解时间的影响
由图3可知,在相同投料量下,随着温度的升高,BC溶解所需时间缩短,其中,溶解温度为90℃时所需溶解时间最长,115℃时所需溶解时间最短,表明温度升高可使BC溶解速率加快。分析其原因主要是因为,温度升高有利于加强BC分子链上的氢与AmimCl中Cl-之间的相互作用,使BC分子内和分子间氢键被破坏,使BC溶解速率增加。同时,高温条件可使溶解后的BC聚合度降低,BC溶解液黏度变小,流动性增加,从而进一步加速BC的溶解[18]。待溶解结束后,利用水作为沉淀剂对BC溶液进行再生,实验结果如表2所示。

图3 温度对BC溶解时间的影响Fig.3 Effect of temperature on BCdissolution time

表2 不同温度下BC溶解后的再生率Table 2 BCregeneration after dissolved under different temperature
表2为投料量5.0%的BC在不同温度条件下溶解后的再生率。由表2可知,虽然在温度为115℃时,BC溶解速率最快,但温度过高引起BC损失反而使其再生率较低;115℃时的BC再生率达到33.4%,因此确定BC最优溶解温度为110℃。其中溶解温度为90、100℃时再生率较低,可能与BC溶解时间过长引起的损失有关。
2.4 投料量对BC溶解时间的影响
由图4可看出,BC投料量从1.0%增加至5.0%的过程中曲线斜率较小,实验数据表明BC投料量每增加0.10 g,BC溶解所需时间增加10 min,表明此阶段随着BC投料量增加,BC溶解所需时间增加幅度不大,BC溶解速率较快。BC投料量大于5.0%时,曲线斜率增大,实验数据表明BC投料量增加0.10 g,BC溶解所需时间增加40 min,BC溶解所需时间延长,表明此阶段BC溶解速率变小。当BC投料量增至7.0%时,曲线斜率继续增大,实验数据表明BC投料量增加0.10 g,BC溶解所需时间增加60 min,表明随着溶液中BC浓度的增加,BC溶解速率不断减小,溶解更多的BC已十分困难。实验过程中同样观察到,BC溶解初始阶段溶液较稀薄,随着BC的溶解,溶液逐渐变得粘稠,这与BC较大的分子量以及其较高的结晶度有关[6,13]。实验结果与BC溶解过程PLM结果一致。溶解结束后经计算可得,在10 g复合溶剂(AmimCl∶DMI=8∶2)中,溶解温度为 110 ℃,溶解时间为11 h条件下,BC/IL溶液中BC质量分数可达6.5%。
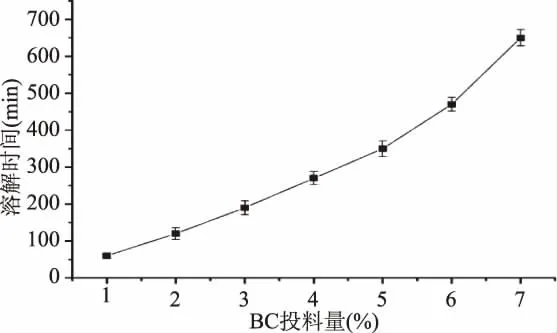
图4 投料量对BC溶解时间的影响Fig.4 Effect of inventory on BC dissolution time
2.5 离子液体溶解对BC性能的影响
2.5.1 BC及再生BC红外光谱分析 图5为BC经AmimCl溶解,水沉淀再生前后的FT-IR图谱。由图5可知,BC-DZ和BC-YP峰形极其相似,说明在BC溶解及再生过程中并不发生纤维素的衍生化过程,即BC的溶解过程为物理过程。图5所示红外图谱中,3402 cm-1处为-OH的伸缩振动特征吸收峰;2894 cm-1附近为 C-H 伸缩振动特征峰;1428、1381 cm-1附近为 C-H 弯曲振动特征峰;1034、1059以及1112 cm-1处为醇中的 C-O的伸缩振动特征峰,表明BC在溶解过程中并没有引入新的基团。相比于 BC-DZ,BC-YP 在3000~3500 cm-1范围内的氢键O-H振动峰变窄,表明再生BC中的氢键在溶解再生过程中出现了一定程度的破坏。同时FT-IR谱图表明,再生BC在1428 cm-1处的吸收峰变弱变宽,而在899 cm-1处的吸收峰明显增强。这两处的红外吸收强度变化与材料的结晶度变化有关,表明BC经过溶解再生后结晶度有所改变[19-20]。
图5 离子液体溶解再生前后BC FT-IR图谱Fig.5 FT-IR spectra of regenerated BC before and after IL-dissolution
2.5.2 BC及再生BC X-射线衍射分析 图6为BC经AmimCl溶解,水沉淀再生前后的XRD图谱。由图6可知,BC的XRD图谱主要有3个衍射峰,分别是14.25、16.65 和 22.45,对应(101)、(101)和(002)晶面,与Ⅰ型纤维素的结晶峰位移基本一致,说明BC溶解之前属于Ⅰ型纤维素[21]。溶解再生之后,BC的结晶峰位移与溶解之前基本一致,而结晶度由原来的51.99%下降至31.29%。这是由于大分子溶剂在溶解过程中破坏了纤维素分子之间的氢键作用,从而破坏了纤维素分子的有序排列,使其结晶度下降[13]。
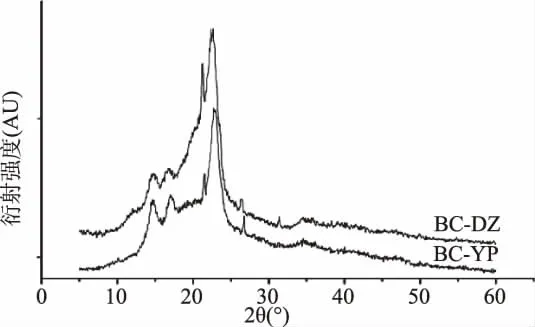
图6 离子液体溶解再生前后BC XRD图谱Fig.6 XRD spectra of regenerated BC before and after IL-dissolution
2.5.3 BC及再生BC SEM形貌分析 图7为BC经AmimCl溶解,水沉淀再生前后的SEM图像。由图可知,溶解再生之前BC纤维表面光滑,微观纤丝排列整齐有序,粗细较均匀,溶解再生之后,BC表面出现很多裂缝及孔洞,变得凹凸不平,微纤丝堆积不紧密。BC在AmimCl中的溶解机理为:溶剂中游离态Cl-以其较强的电负性结合BC中羟基上的H原子,削弱BC分子间和分子内的氢键作用。同时因离子液体的阳离子侧链上含强极性烷基键,与BC形成络合物从而进一步削弱BC内部氢键作用。溶解过程中离子液体不断渗入,使BC聚集态结构逐渐被破坏,而再生过程并未完全恢复BC的聚集态结构,因此出现图示再生前后 BC 形貌变化[13,21]。
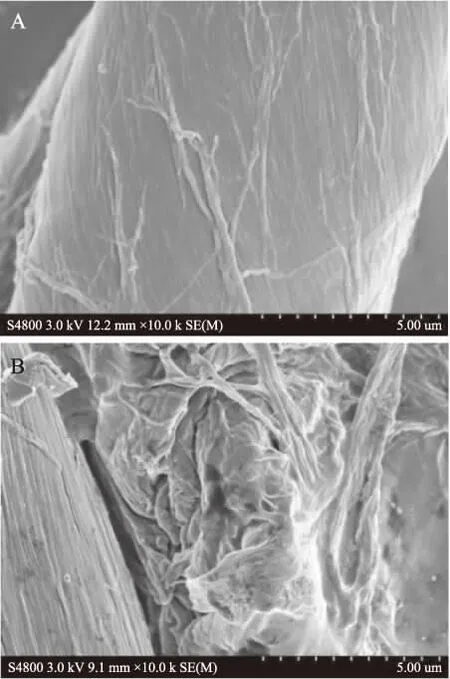
图7 离子液体溶解再生前(A)后(B)BC SEM图谱Fig.7 SEM spectra of regenerated BC before(A)and after(B)IL-dissolution
2.5.4 BC及再生BC TG-DSC分析 图8为经BC经AmimCl溶解,水沉淀再生前后的TG-DSC图谱。由图8可知,BC的 DTG图谱所示峰值出现在214.3℃和329.0℃,温度升高至214.3℃时,质量损失24.29%,温度达800℃时质量损失74.01%;再生BC的DTG图谱所示峰值出现在301.3℃时,温度升高至301.3℃时,质量损失31.78%,800℃时质量损失77.31%。这是由于BC/IL溶液中的离子键破坏了BC中的部分氢键,使得再生BC热稳定性有所降低。同时再生过程使得BC晶区结构受到部分破坏,有序程度降低,“晶区”与“非晶区”的差别变小,因而再生BC结晶峰小于原BC样品的结晶峰,与XRD的结果一致。
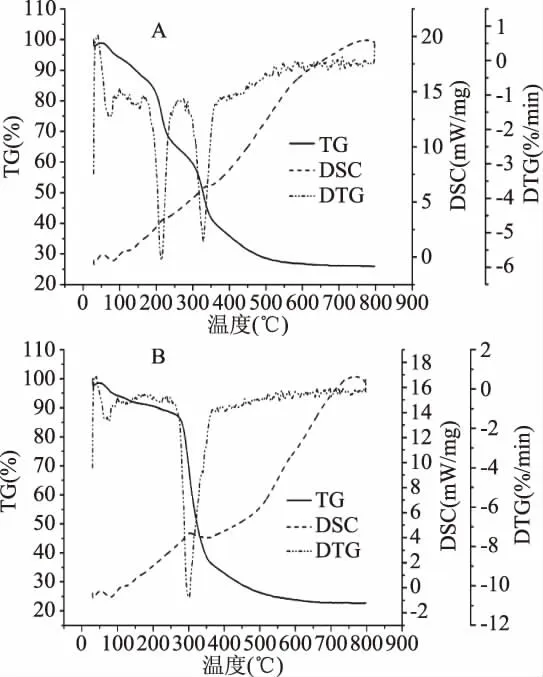
图8 离子液体溶解再生前(A)后(B)BCTG-DSC图谱Fig.8 TG-DSCspectra of regenerated BC before(A)and after(B)IL-dissolution
3 结论
利用PLM技术观察BC在离子液体AmimCl中的溶解过程,表明离子液体AmimCl对BC具有良好的溶解性能,可作为一种BC的新型溶剂。工艺优化研究确定其最优溶解工艺为:溶解温度为110℃,复合溶剂比为AmimCl∶DMI=8∶2,溶解时间为11 h条件下,BC/IL溶液中BC质量分数可达6.5%。利用FT-IR、XRD、SEM、TG-DSC 对 IL溶解再生前后 BC化学基团、结晶性能、微观结构进行了比较,表明离子液体AmimCl溶解再生细菌纤维素属于物理过程,其化学结构不受影响,溶解再生后的BC结晶度及热性能有所降低,纤维表面出现很多裂缝及孔洞,微纤丝堆积变得松散。本研究为BC实际应用过程中难溶解的问题提供了新的思路,为BC改性奠定了理论及技术基础。
