不同分子特性玉米蛋白高F值活性肽的制备及其模拟消化吸收
2019-01-26王成涛
王 鑫,侯 威,赵 磊,*,王成涛,*,卢 松
(1.北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京100048;2.阜丰集团内蒙古阜丰生物科技有限公司,内蒙古呼和浩特010030)
我国是全球第二大玉米生产国,占世界总产量的20%[1]。玉米黄粉是玉米湿法加工淀粉时产生的副产物,其中含有30%~70%的蛋白质[2],可分为玉米醇溶蛋白、谷蛋白、球蛋白和白蛋白等成分[3]。但是由于其气味和色泽独特,口感粗糙,色氨酸、赖氨酸等人体必需氨基酸组成不充分,大大限制了其在食品行业中的应用[4],在我国主要被用作动物饲料或发酵行业氮源,极少被综合开发利用[5]。而在美、日等发达国家,一些蛋白加工企业对玉米黄粉进行了充分挖掘,生产出一系列高附加值产品,玉米黄粉的价值得到了很大提高。
高 F值活性肽(High Fischer ratio peptide,HFRP)是一类由2~9个氨基酸残基所组成的复合小肽,其显著特征是支链氨基酸(Brand chain amino acid,BCAA)与芳香族氨基酸(Aromatic amino acids,AAA)含量的摩尔数比值(即F值)较高,一般应大于20[6-7]。其中,BCAA 主要包括:缬氨酸(Val) 、亮氨酸(Leu)、异亮氨酸(Ile);AAA主要包括:色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)[8]。HFRP 是一种重要活性肽,具有抗疲劳、改善肝、肾、肠、胃疾病患者营养的功能[9-10]。玉米黄粉中 BCAA 所占比例为23.79%,BCAA与AAA比值高达4.8,这两项指标远高于其他谷类中的稻谷(3.81)、小麦(3.29)、高粱(4.6)和油料作物中的大豆(3.91)、蚕豆(3.97)、扁豆(3.32)[11],可以有效利用这一天然优势,并在蛋白酶酶解作用下进一步降低芳香族氨基酸含量制备HFRP[12]。郑喜群等[13]采用碱性蛋白酶和米曲霉固态发酵产生的羧肽酶依次水解玉米醇溶蛋白,制备HFRP;Cheison等[14]采用胰蛋白酶作为水解酶,得到制备HFRP的最佳条件。
HFRP经口摄入、进入机体发挥生理功能,需要面临胃肠道的物理屏障和生化屏障双重作用,前者主要包括由消化道粘膜层、细胞分泌系统、上皮细胞间的紧密连接等构成的物理屏障,后者是指胃内低pH、胃肠内多种消化酶等消化降解[15]。因此,采用模拟胃肠消化模型和单层细胞模型,筛选出HFRP中可以被完整、高效吸收的肽。
本研究以玉米黄粉为原料,采用复合酶解法制备HFRP,利用活性炭吸附进一步降低芳香族氨基酸比例,提高F值,并通过分子量、电荷性和疏水性将其分离纯化,进一步研究其吸收状况和胃肠消化状况,为新型活性肽保健食品的研究开发提供理论依据和技术支持,为玉米黄粉的综合利用探索新道路。
1 材料与方法
1.1 材料与仪器
玉米黄粉 阜丰集团有限公司;碱性蛋白酶(2×105U/g)、风味蛋白酶(3.37×104U/g) 诺维信(中国)公司;胃蛋白酶(1×104U/g)、胰蛋白酶(1×104U/g) Solarbio公司;Octyl Sepharose 4 Fast Flow、Sephadex-G15、CM FF 16/10、DEAE FF 16/10、酪蛋白、L-酪氨酸 美国 Sigma公司;Caco-2细胞 北京金紫晶生物医药技术有限公司;不完全培养液MEM-EBSS 北京博尔金科技有限公司;胎牛血清、100 U/mL青-链双抗 美国Ameresco公司;AKP检测试剂盒、BCA微量蛋白检测试剂盒 上海酶联生物科技有限公司;其它试剂 均为分析纯或色谱纯。
L-8900氨基酸自动分析仪 日本日立公司;UV2450紫外可见光分光光度计 日本岛津公司;YS-10小型高速粉碎机 北京燕山正德机械设备有限公司;HQ45恒温摇床 中国科学院武汉科学仪器厂;Supra高速冷冻离心机 韩国Hanil Science Industrial(翰尼科学产业);ATN-300自动凯氏定氮仪 上海洪纪仪器设备有限公司;Sorvall Legend Micro 17R微量离心机 美国Thermo公司;FD-1B-80冷冻干燥机 南京普森仪器公司;purifier 10 AKTA蛋白纯化系统 美国通用公司;Axiovert 200倒置显微镜 德国Zeiss公司;STX2跨膜电阻仪 世界精密仪器商贸(上海)有限公司WPI;HH-4水浴锅 上海蓝凯仪器仪表有限公司;Galaxy S CO2培养箱 英国RS Biotech公司;SpectraMax I3多功能酶标仪 美国Molecular Devices公司;1290-Q-TOF-MS/MS液相色谱-质谱联用仪 美国安捷伦科技公司;MLS-3750高压蒸汽灭菌锅 日本三洋电机株式会社。
1.2 实验方法
1.2.1 理化指标的测定 根据GB/T 5009.3-2016食品中水分的测定[16]中直接干燥法测定水分含量;根据 GB/T 5009.4-2016 食品中灰分的测定[17]中灼烧称质量法测定灰分含量;根据GB/T 5009.5-2016食品中蛋白质的测定[18]中凯氏定氮法(F=6.24)测定蛋白质含量;根据GB/T 5009.6-2006食品中脂肪的测定[19]中索氏抽提法测定脂肪含量。将样品置于水解管中,加入6 mol/L的HCl溶液,110℃真空水解24 h,冷却后定容,过滤干燥,加入0.02 mol/L的HCl溶液室温放置30 min,采用氨基酸自动分析仪测定除色氨酸外的氨基酸含量。
1.2.2 HFRP的制备 以玉米黄粉为原料,首先经碱性蛋白进行初次酶解(添加量1.25×104U/g底物、p H9、料液比1∶35、温度 50 ℃、时间 3 h),将芳香族氨基酸暴露于肽端,然后通过风味蛋白酶进行二次酶解(添加量1.01×103U/g底物、p H7、温度45℃、时间2.5 h),使芳香族氨基酸游离于酶解液中。利用活性炭对酶解液中游离氨基酸进行吸附(添加量7%、pH4、温度30℃、时间1.5 h),然后选择杆菌肽(分子量1422.69 Da)、合成多肽1(分子量912.835 Da)、合成多肽 2(分子量 493.46 Da)、色氨酸(分子量204.213 Da)作为检测标准物,依据其在 sephadex G-15自装柱中保留时间的不同,确定所制备的活性肽的分子量范围(上样量100μL、样品浓度10 mg/mL、流速0.3 mL/min、流动相为高纯水、检测波长280 nm)。收集2~9个氨基酸组成的HFRP(<1000 Da),对其进行真空冷冻干燥,干燥温度设为-52℃,时间36 h,-20℃储存备用。
1.2.3 不同分子量HFRP的分离 凝胶的预处理:取适量Sephadex G15填料,沸水煮30 min排除胶粒中的空气,轻轻搅拌,静置20 min后倾去破损漂浮的粒子,反复数次。装柱:保持空柱垂直,沿上壁缓慢倒入凝胶液,保持填料始终处于 Tris-HCl缓冲液(0.5 mol/L,p H8.0)以下,至凝胶沉淀离柱上端1.5~2 cm处,利用缓冲液平衡过夜。加样与洗脱:样品质量浓度为35 mg/mL,洗脱液为蒸馏水,洗脱流速0.5~1 mL/min之间,洗脱至 OD280<0.02。收集各组分,对其进行真空冷冻干燥,干燥温度设为-52℃,时间36 h,-20℃储存备用。选择合成多肽1(分子量912.835 Da)、合成多肽2(分子量493.46 Da)、色氨酸(分子量204.213 Da)作为分子量界限,对吸附后样品分子量进行检测。
1.2.4 不同电荷性HFRP的分离 选用阳离子层析介质CM FF 16/10和阴离子层析介质DEAE FF 16/10装柱进行试验,装柱方法同1.2.3。样品以2 mL/min的流速上柱,用50 mmol/L p H8.8 Tris-HCl缓冲液以5 mL/min流速洗脱至 OD280<0.02,随后用 0~0.5 mol/L NaCl连续梯度,流速为2 mL/min洗脱。收集各组分,对其进行真空冷冻干燥,干燥温度设为-52℃,时间36 h,-20℃储存备用。
1.2.5 不同疏水性HFRP的分离 选用Octyl Sepharose 4 Fast Flow填料装柱进行试验,装柱方法同1.2.3。配置 2~3个柱体积 0.1 mol/L p H7.0 Na2HPO4溶液,1.7 mol/L(NH4)2SO4与样品混合,经过填料,使样品完全吸附,然后按照100%~0%1.7 mol/L(NH4)2SO4梯度洗脱500 mL,洗脱液的流速控制在2 mL/min,洗脱至OD280<0.02。收集各组分,对其进行真空冷冻干燥,干燥温度设为-52℃,时间36 h,-20℃储存备用。
1.2.6 吸收模型的构建 参考Xie等[20]的方法进行细胞培养。将新购Caco-2细胞置于一次性细胞培养瓶(25 cm2)中,加入完全培养液(不完全MEMEBSS培养液、1%100 U/mL青-链双抗(V/V)、10%胎牛血清(FBS,V/V)),于37℃、90%相对湿度、5%CO2培养箱中培养24 h后换液,之后隔天换液。在倒置显微镜下观察,细胞融合度达到90%时,用0.25%胰蛋白酶溶液消化5 min,待培养瓶中细胞成片脱落时加入完全培养液终止消化,利用一次性吸管吹打,将消化液转入15 mL离心管,于1000 r/min离心5 min,弃去上清液,加入完全培养基进一步吹散成单个细胞悬液,细胞计数后,调整细胞浓度为5×104个/mL。向Transwell转运板膜底侧(BL侧)小池内加入1.5 mL完全培养基,向膜上侧(AP侧)小池内加入稀释好的含有细胞的混合培养液0.5 mL,置于CO2培养箱中培养21 d,期间每隔2 d更换一次完全培养液,直至Caco-2形成致密完整的单层细胞结构,并且分化成熟,可用于模拟吸收试验。
1.2.7 吸收模型评价
1.2.7.1 跨膜电阻(TEER)值测定 TEER值是反映细胞单层完整性的一个指标,一般TEER值在200~1000Ω·cm2范围之内,值越大,细胞单层致密越完整[21]。吸弃培养液,小室内外均加入37℃预热的PBS溶液,重复三次,其中第三次放于培养箱中孵育30 min后连上细胞电位仪测电阻。
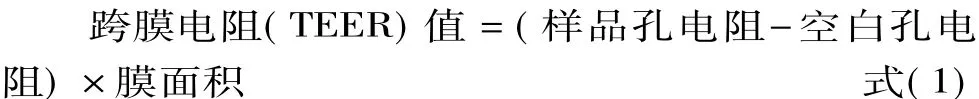
1.2.7.2 荧光黄透过率测定 预热HBSS(0.4 g/L KCl、60 mg/L KH2PO4、8 g/L NaCl、60 mg/L Na2HPO4、0.35 g/L NaHCO3、1 g/L D-葡萄糖和 2.38 g/L HEPES,pH7.2)溶液到37℃。向 Transwell转运板AP侧加入0.4 mL荧光黄(100 mg/mL)HBSS溶液,BL侧加入0.6 mL空白HBSS溶液,在37℃,5%CO2培养箱中孵育1 h,从BL侧取0.5 mL样品液。利用酶标仪(激发波长427 nm、发射波长536 nm)测定吸光值,依据以下公式计算表观渗透系数。

式中:dQ/dt是单位时间药物转运量(mg/s),A是转运膜表面积(cm2),C0是培养液中荧光黄原始浓度(μg/mL)。
1.2.7.3 碱性磷酸酶活性测定 碱性磷酸酶可分解磷酸苯二钠,产生游离酚和磷酸,酚在碱性溶液中与4-氨基安替吡啉作用,经铁氰化钾氧化生成红色醌衍生物,根据红色深浅可以测定酶活力的高低[22]。本实验使用 AKP试剂盒按说明书步骤,分别在Transwell膜的两侧取样,测定碱性磷酸酶活力。根据标准曲线方程计算碱性磷酸酶活力,结果以金氏单位(37℃时,与基质作用15 min产生1 mg酚为一个金氏单位)表示。

1.2.8 Caco-2细胞模型转运方法 利用HBSS溶液将不同分子特性的各个活性肽组分溶解、稀释成20 mg/mL的溶液,并调节其p H至7.0±0.1,在BL侧加入1.5 mL的HBSS溶液,AP侧加入0.5 mL的活性肽溶液,1.5 h后收集BL侧溶液,对其进行真空冷冻干燥,干燥温度设为-52℃,时间36 h,-20℃储存备用。
1.2.9 体外模拟胃肠消化 参考Samaranayaka等[23]和Ruiz等[24]的方法进行。模拟胃液:胃蛋白酶3.2 g、NaCl 2.0 g、浓盐酸 7 mL、去离子水 1000 mL,调节p H2.0±0.1。模拟肠液:KH2PO46.8 g、0.2 mol/L NaOH 190 mL、胰蛋白酶10 g、去离子水 1000 mL,调节p H7.5±0.1。HFRP中可被吸收的多肽+胃液+肠液:用0.01 mol/L盐酸(pH2.0)将不同分子特性的多肽样品稀释至10 mg/mL,按照上述方法配制模拟胃液,分别在37℃的条件下预热10 min。按照酶与底物之比为1∶35(w/w)分别混合模拟胃液与底物,并于37℃保持2 h。2 h后,用0.9 mol/L NaHCO3将消化液pH调节至5.3,再用2 mol/L NaOH调节p H至7.5,按照酶与底物的比例为1∶50(w/w)将配制好的模拟肠液与胃消化液混合,2 h后肠消化完毕,沸水浴灭酶10 min,冷却至室温后,真空冷冻干燥至粉末(-52 ℃,36 h),-80 ℃储存备用。1.2.10 多肽结构鉴定 采用HPLC-Q-TOF鉴定经细胞转运后膜下侧(BL侧)组分结构,其中液相条件为:Agilent Zorbax Eclipse Plus C18 2.1×50 mm,1.8μm色谱柱、柱温30℃、流动相为0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B),线性梯度洗脱:0~60 min,B 10% ~60%、流速 1.0 mL/min、进样量10μL;质谱条件为:电喷雾离子源ESI、正离子模式、毛细管电压3500 V、喷嘴电压500 V、碰撞能80 eV、干燥器温度300℃、流量5.0 L/min、鞘气(N2)温度150℃、鞘气流量 1 L/min、离子扫描范围 50~1000 m/z;二级质谱碰撞电压15 eV。正、负离子一级质谱全扫描及二级质谱全扫描分析。
1.3 数据处理
实验结果用珚X±SD表示,数据处理采用Excel软件。
2 结果与分析
2.1 玉米黄粉的基本成分及氨基酸组成
玉米黄粉常规测定结果见表1。其中蛋白质含量高达59.17%。进一步利用氨基酸分析仪对玉米黄粉中氨基酸组成进行分析(表2),可以看出玉米黄粉中Leu、Val、Ile等支链氨基酸含量较高,分别为16.96%、4.37%、2.31%,占总氨基酸含量的23.64%,而Tyr和Phe等芳香族氨基酸含量较低,分别为2.83%和4.85%,占总氨基酸含量的7.68%;另外,Ala、Val、Pro、Met、Ile、Leu 和 Phe 属于疏水性氨基酸,总量占氨基酸总量的54.03%,表明玉米蛋白是一种疏水程度较大的蛋白,这一特殊组成也是造成玉米中蛋白质水溶性差的主要原因。
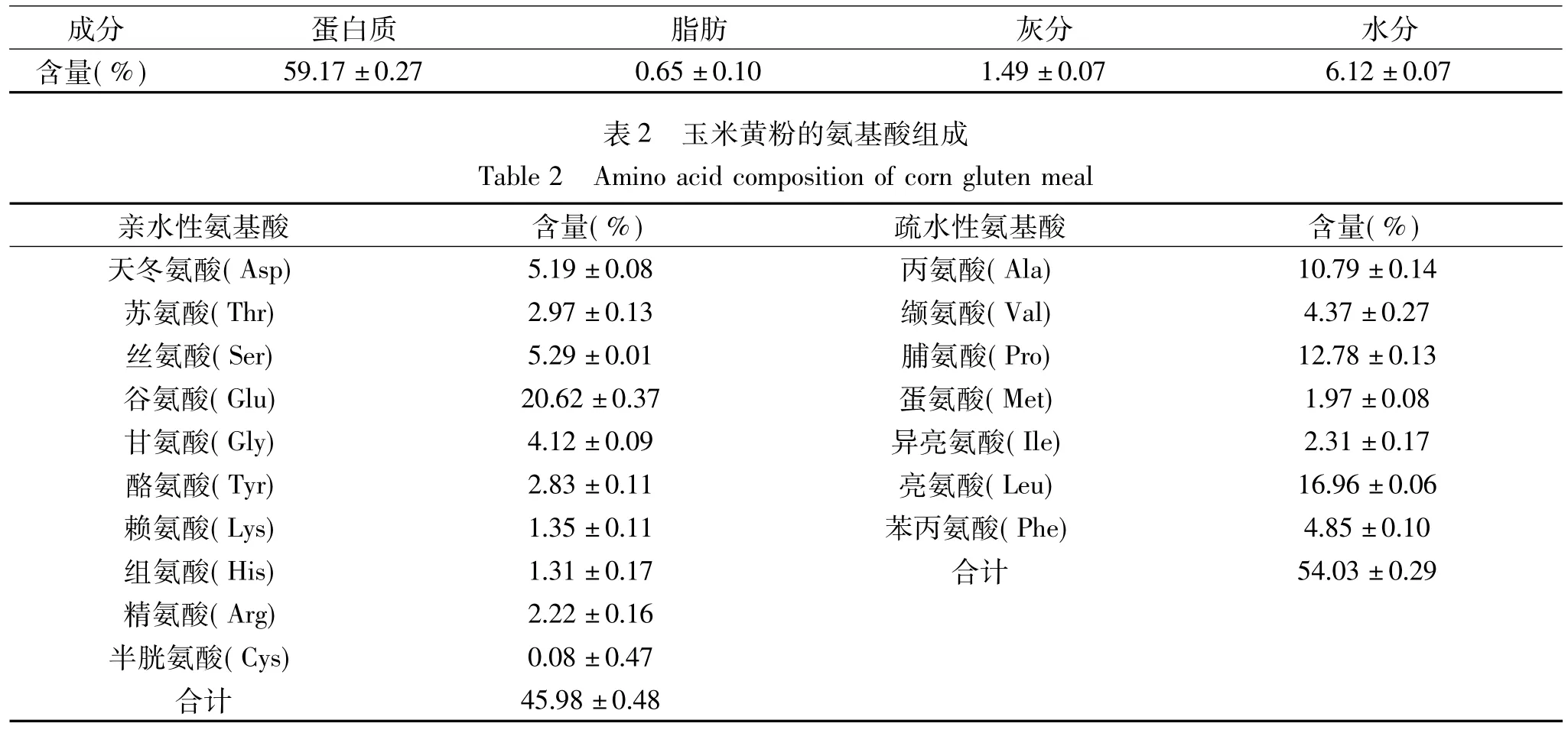
表1 玉米黄粉的基本成分Table 1 Basic components of corn gluten meal
2.2 不同分子量HFRP的制备结果
由图1可见,HFRP经Sephadex G15分离后得到SE-F1、SE-F2和 SE-F3,共3个组分。根据凝胶色谱吸附原理[25],分子量 SE-F1(493.46~912.835 Da) >SE-F2(204.213~493.46 Da) >SE-F3( <204.213 Da),并且SE-F1组分的含量最多。分别将3个组分多次收集,冷冻干燥后备用。
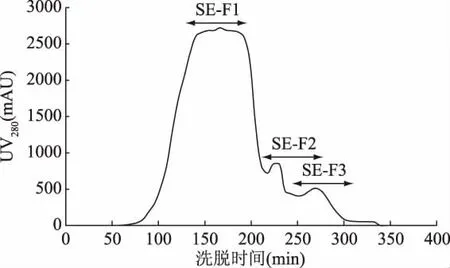
图1 高F值活性肽的Sephadex G15凝胶柱分离图谱Fig.1 The spectrum of high Fischer ratio peptide on a column of Sephadex G-15
2.3 不同电荷性HFRP的制备结果
为分离得到不同电荷特性的活性肽组分,本试验按照1.2.4中提供的方法,将制备得到的HFRP进行分离,得到带有不同电荷的组分(CM-Fx和DE-Fx),阳离子和阴离子层析分离结果分别见图2和图3。图2中HFRP经阳离子层析介质CM FF 16/10分离,得到CM-F1、CM-F2和CM-F3共3个组分。根据阳离子层析原理,固定相本身带有负电荷,当待分离活性肽的电荷小于所使用平衡液的pH时,多肽带有负电,因此不被吸附,根据电荷性由弱到强依次被平衡液洗脱下来,而当活性肽所带的电荷大于平衡液的pH时,多肽带有正电而被吸附到树脂的负电荷基团上,这些多肽需要更高强度的盐溶液下才能洗脱下来[26]。阴离子交换树脂层析原理与阳离子交换树脂层析原理相反。图3中HFRP经阴离子层析介质DEAE FF 16/10分离,得到 DE-F1、DE-F2、DE-F3共3 个组分。分别将6个组分多次收集,冷冻干燥后备用。
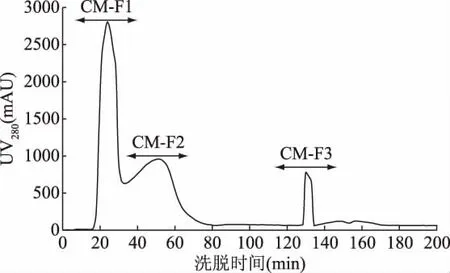
图2 高F值活性肽的阳离子分离图谱Fig.2 The spectrum of high Fischer ratio peptide on a column of cations
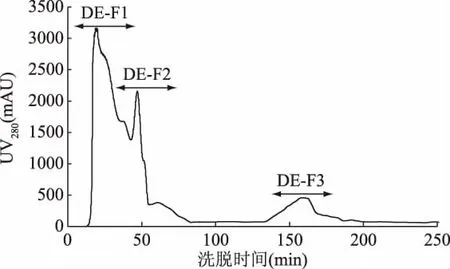
图3 高F值活性肽的阴离子分离图谱Fig.3 The spectrum of high Fischer ratio peptide on a column of anions
2.4 不同疏水性HFRP的制备结果
由图4可知,HFRP经疏水层析填料 Octyl Sepharose 4 Fast Flow洗脱后共出现3个峰,得到OC-F1、OC-F2和OC-F3共3个组分。随着时间的延长,洗脱液中盐离子浓度逐渐增大,被洗脱下来的组分,其疏水性越来越强[27],按照疏水强度排列为OC-F1<OC-F2<OC-F3。分别将3个组分多次收集,冷冻干燥后备用。
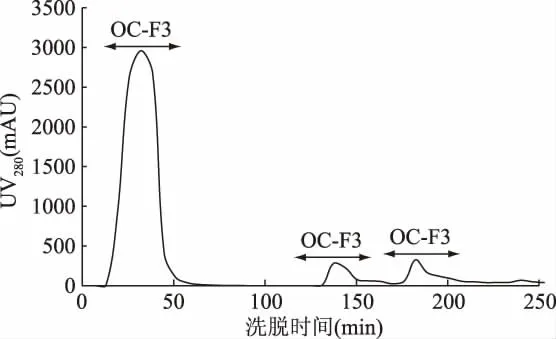
图4 高F值活性肽的疏水性层析分离图谱Fig.4 The spectrum of high Fischer ratio peptide on a column of hydrophobicity interaction chromatography
2.5 吸收模型评价
2.5.1 Caco-2细胞TEER值的测定结果 吸收模型构建成功与否与Caco-2细胞接种量大小密切相关,本试验通过在相同膜面积的小池中接种1.5、2.5、3.5、4.5、5.5×105个/cm2,选择最佳接种量。由图5可知,随着培养时间的延长,Transwell转运板上Caco-2细胞成膜的完整性逐渐趋于完善。接种量为1.5×105个/cm2时,第22 d TEER值仍没有达到试验的最低要求(TEER值>200Ω/cm2),可见接种量较小,导致细胞没有形成完整的膜结构。接种量>2.5×105个/cm2时,第8 d以后TEER值均有增长,第9 d达到400Ω/cm2。但是继续培养后发现,接种量为4.5×105个/cm2和5.5×105个/cm2的试验孔,TEER值在16 d之后呈现下降的趋势,可能是由于细胞接种量过密导致的局部隆起、破裂产生孔洞,相比之下,接种量为2.5×105个/cm2和3.5×105个/cm2时,TEER值稳定增长并能保持在400Ω/cm2左右,说明在此接种范围内所造模型能够形成完整的膜结构,综合考虑选择2.5×105个/cm2为最佳接种量,虽然在此接种量的条件下,TEER值在第10 d之后已经达到试验要求,但是Caco-2细胞还只是分裂复制形成单层膜结构,并没有开始分化形成类似于小肠的微绒毛结构,因此,吸收试验还应在接种后第21 d后进行试验。

图5 不同接种量不同的时间段12孔TransWell培养板细胞的跨膜电阻值Fig.5 TEER curves of the Caco-2 monolayer in a TransWell 12-well plate at different inoculation amounts and different periods
2.5.2 Caco-2细胞荧光黄通透率的测定结果 在21 d培养的Caco-2单细胞层荧光黄转运的荧光黄通透率(Papp)为(0.086±0.04) ×10-6cm/s,小于转运实验规定的 1.0 ×10-6cm/s[28],说明所形成的单细胞层完整性符合实验要求,可用于转运实验。
2.5.3 Caco-2细胞碱性磷酸酶活性的测定结果 在21 d培养的Caco-2单细胞层AP、BL侧碱性磷酸酶活性 AP/BL>10[28],说明吸收模型分化完全。
本实验建立的 Caco-2细胞模型的 TEER值(200~1000 Ω/cm2)[20]、荧光黄通透率( < 1.0 ×10-6cm/s)[27]和碱性磷酸酶活性(AP/BL > 10)[29],符合体外模拟胃肠消化实验要求,可用于HFRP消化吸收特性的研究。
2.6 不同分子特性的HFRP BL侧透过多肽一级质谱测定结果
2.6.1 不同分子量的HFRP BL侧透过多肽一级质谱测定结果 向BL侧加入p H7.2的HBSS 1.5 mL,向AP侧加入20 mg/mL、pH7不同分子量的HFRP溶液0.5 mL,1.5 h后收集BL侧溶液进行质谱鉴定。通过将BL侧多肽排除空白(模拟肠液),得到寡肽群1(OP1,Oligo-Peptides1)。通过将寡肽群1与 AP侧多肽的保留时间和母离子大小对比,来判断可以完整通过模拟肠壁的多肽,得到寡肽群2(OP2,Oligo-Peptides2)。通过将寡肽群2(OP2,Oligo-Peptides2)与未经模拟肠壁消化的不同分子量的HFRP组分对比,寻找具有相同保留时间和母离子大小的多肽,得到的寡肽群3(OP3,Oligo-Peptides3),OP3为可完整透过模拟肠壁的HFRP组分,选择不同分子量的HFRP中具有代表性的谱峰进行研究,数据分析结果如表3所示。由表3可知,从BL侧检测得到物质的分子量<500,这一现象与Korhonen等[30]的研究中发现的通常只有2~6个氨基酸残基的肽能够完整通过肠壁,被完整吸收的理论相一致;同时可以发现,分子量越小的多肽,越容易被完整吸收。同时小肠上皮细胞膜为磷脂双分子层结构,导致脂溶性和疏水性强的寡肽易于透过细胞层进入机体内环境[31]。

表3 不同分子量的HFRPBL侧透过多肽一级质谱图表Table 3 First-order mass spectrometry chart of different molecular HFRPthrough BL side
2.6.2 不同电荷性的HFRP BL侧透过多肽一级质谱测定结果 向BL侧加入p H7.2的HBSS 1.5 mL,向AP侧加入20 mg/mL、p H7不同电荷性的HFRP溶液0.5 mL,1.5 h后收集BL侧溶液进行质谱鉴定。由此得到寡肽群1(OP1,Oligo-Peptides1)、寡肽群2(OP2,Oligo-Peptides2)和寡肽群 3(OP3,Oligo-Peptides3)。此时得到OP3为可完整透过模拟肠壁的HFRP组分,选择阳离子组分(CM-FX)和阴离子组分(DE-Fx)具有代表性的谱峰进行研究,数据分析结果如表4和表5所示。由表4和表5对比可知,溶液中带有正电荷的多肽比带有负电荷的多肽更容易透过模拟肠壁,并且正电荷性越强,其透过趋势越明显。Shimizu等[30]的研究中发现的带有正电荷的物质多数能够通过亲水的旁路途径被转运吸收,而带有负电的物质不能通过该路径,这一现象与此研究相符。
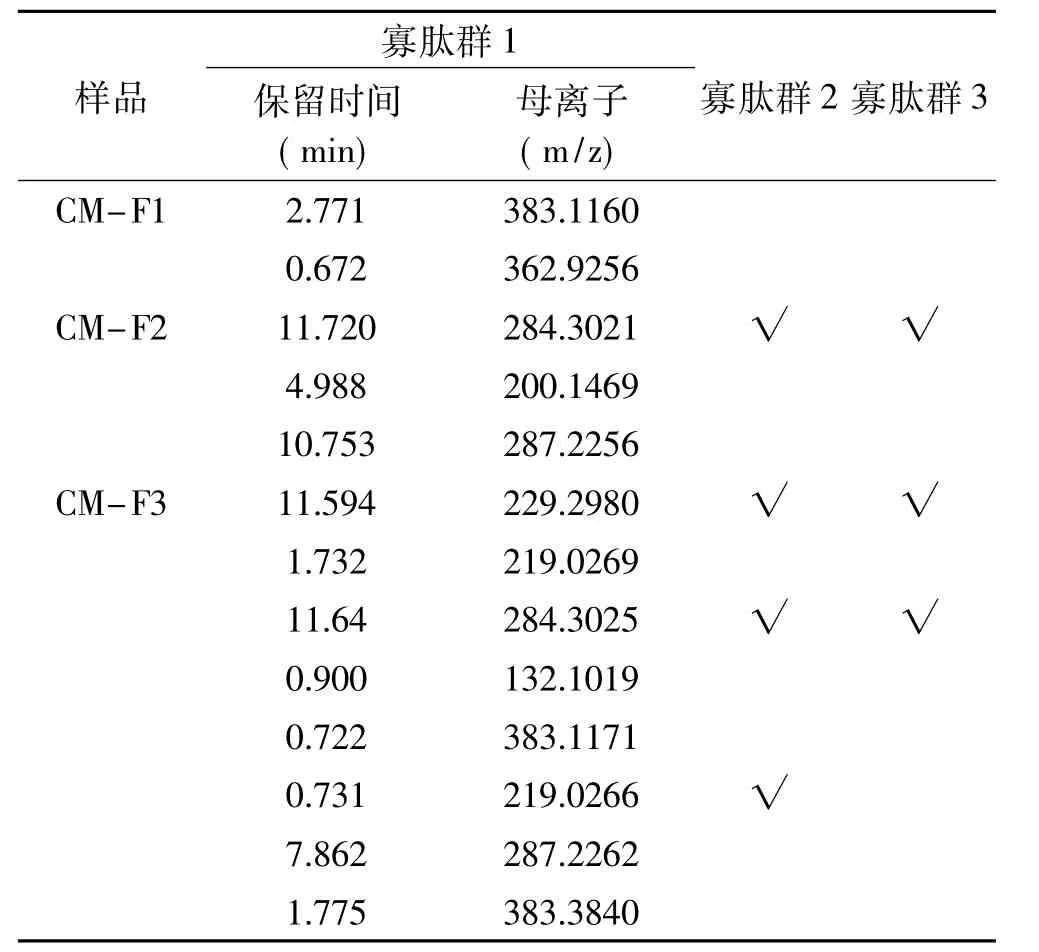
表4 不同电荷性(阳离子)的HFRPBL侧透过多肽一级质谱图表Table 4 First-order mass spectrometry chart of different cations HFRP through BL side
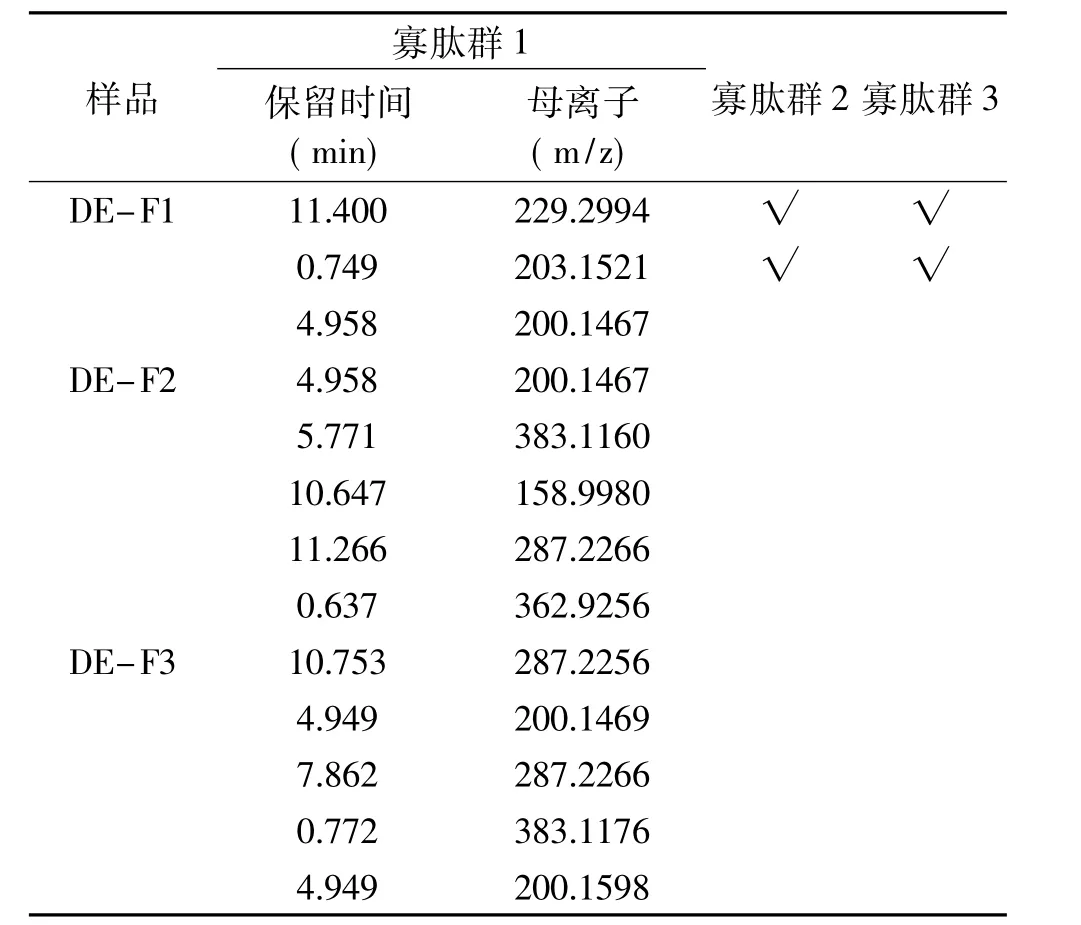
表5 不同电荷性(阴离子)的HFRP BL侧透过多肽一级质谱图表Table 5 First-order mass spectrometry chart of different anions HFRPthrough BL side
2.6.3 不同疏水性的HFRP BL侧透过多肽一级质谱测定结果 向BL侧加入p H7.2的HBSS 1.5 mL,向AP侧加入20 mg/mL、p H7不同疏水性的HFRP溶液0.5 mL,1.5 h后收集BL侧溶液进行质谱鉴定。由此得到寡肽群 1(OP1,Oligo-Peptides1)、寡肽群 2(OP2,Oligo-Peptides2)和寡肽群 3(OP3,Oligo-Peptides3)。此时得到OP3为可完整透过模拟肠壁的HFRP组分,选择各疏水性组分(OC-FX)具有代表性的谱峰进行研究,数据分析结果如表6所示。由表6可知,三种组分的疏水性强弱依次为OC-F3>OC-F2>OC-F1,随着疏水性的增强,靠近细胞膜更加容易,吸收转运通过细胞膜的多肽种类也依次增多。有研究[32]表明,某些肽的疏水性与其细胞透过率呈正相关,并且主动运输途径需要疏水性较高的肽参加才能完成转运吸收。
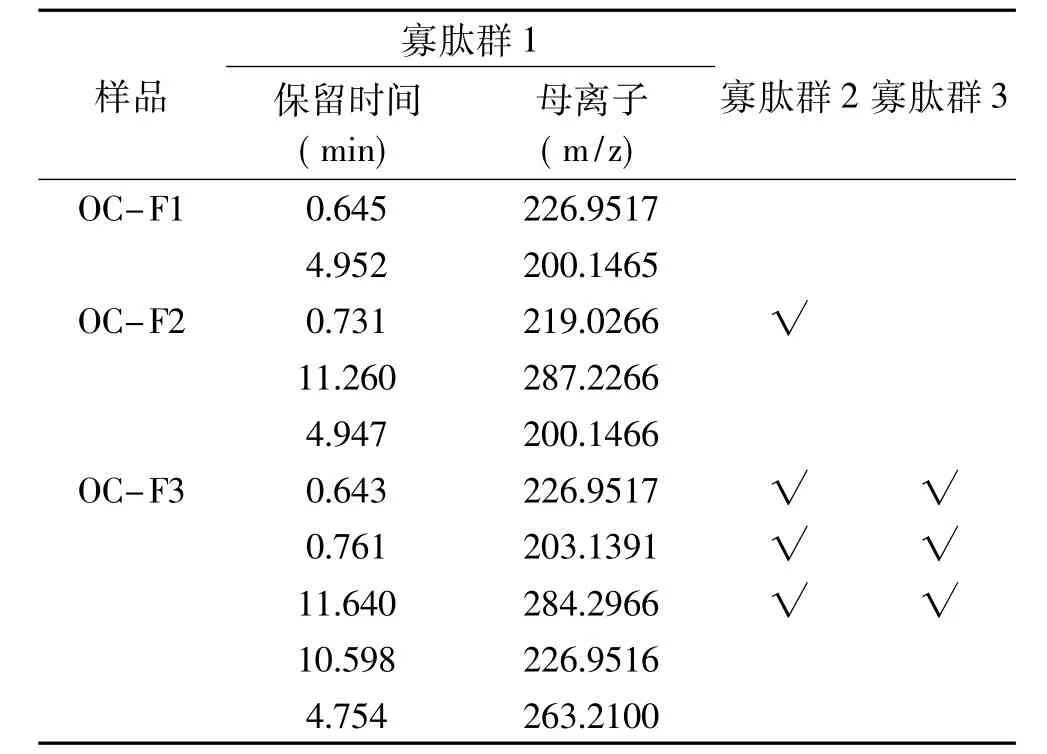
表6 不同疏水性的HFRPBL侧透过多肽一级质谱图表Table 6 First-order mass spectrometry chart of different hydrophobicity HFRP through BL side
2.6.4 不同分子特性的高吸收多肽序列鉴定结果
选择可以被肠壁完整吸收的不同分子特性多肽的寡肽群3,将其进行二级质谱扫描,根据子离子中出现的特征离子峰手动解谱,解谱结果较为复杂,只能鉴定出4种物质,结果见表7。由表7可知,得到的能够透过模拟肠壁的寡肽结构均为二肽,证明小分子多肽更容易透过肠壁结构而被完整吸收。经过分析,能够完整透过肠壁的多肽分别为LA、IP、PL、HQ共4条。

表7 目的离子二级质谱图表Table 7 Secondary ion mass spectrometry chart of target ions
2.6.5 高吸收组分中耐消化结构鉴定结果 经对比找到HFRP中4条多肽能够完整通过模拟肠壁而结构不被破坏,将这4条多肽与相对应组分模拟胃肠消化后产物对比,即可验证这4个组分是否能够耐受胃肠消化酶的裂解作用,经过对比发现,组分PL和HQ在胃肠消化液中同样存在,并且出峰时间和母离子大小相当,子离子碎片相同,表明这两个二肽可以在2 h胃液消化和2 h肠液消化下稳定存在。
3 结论
本实验选用支链氨基酸含量高达23.79%的玉米黄粉为底物,通过碱性蛋白酶和风味蛋白酶复合酶解制备得到HFRP,然后按照分子量、电荷性和疏水性进行分离,进行转运吸收试验。结果表明,HFRP中短肽LA、IP、PL和HQ能够以完整形式被吸收,其中短肽PL和HQ既能耐受住胃液的消化,又能够被肠壁在不破坏结构的条件下完整吸收。由此推测,从此HFRP中分离鉴定出的短肽PL和HQ具有分子量小、在溶液中带有正电荷、疏水性程度高的特性,且此特性的短肽具有优先吸收和耐胃肠消化的特点,为新型活性肽保健食品的研究开发提供一定理论依据和技术支持。
