PIVKA-Ⅱ及AFP对原发性肝癌的诊断价值*
2019-01-25高光剑潘耀振
高光剑, 潘耀振
(贵州医科大学, 贵州 贵阳 550004)
原发性肝癌(primary hepatic carcinoma,PHC)是我国常见的恶性肿瘤,死亡率已占我国癌症死因第二位,且发病出现低龄化的倾向[1]。肝癌患者的治疗效果极差,据统计,原发性肝癌的5年生存率不足20%[2],目前手术和肝移植是治疗肝癌最好的方法,肝癌术后的高复发率和高病死率仍是影响预后的主要因素。随着研究的进展,异常凝血酶原(PIVKA-Ⅱ)、甲胎蛋白异质体(AFP-L3)、MicroRNA等肝癌标志物被筛选出来[3],文献显示PIVKA-Ⅱ诊断肝癌的敏感性和特异性较高[4],且得到了国际上多位学者研究结果的支持[5-7]。本研究旨在探讨PIVKA-Ⅱ联合AFP早期诊断肝癌的临床价值。
1 资料和方法
1.1 临床资料
收集2016年10月~2017年8月173例病历资料,PHC组88例,经临床或病理诊断为PHC,其中男性为73例、女性15例,年龄28~78岁、平均(55.81±11.34)岁,肝癌诊断标准符合《新编常见恶性肿瘤诊治规范》原发性肝癌等肿瘤疾病的诊断标准;肝硬化组9例(包括因饮酒、慢性肝病等所致的肝硬化,但排除活动性肝炎、妊娠、胚胎源性肿瘤等),其中男性5例、女性4例,年龄40~80岁、平均(60.11±15.26)岁;对照组(非肝癌、肝硬化组)76例,其中男性32例、女性44例,年龄21~88岁、平均(55.37±14.87)岁。
1.2 方法
取所有的研究对象清晨空腹静脉血后分离血清,分别检测血清中的PIVKA-Ⅱ(富士瑞必欧公司的Lumipulse G1200电化学发光免疫分析仪及PIVKA-Ⅱ检测试剂盒)、AFP水平(德国西门子公司的ADVIA Centaur® XP全自动化学发光免疫分析系统);PHC组患者行上腹部增强CT(日本东芝公司生产的Aquilion TM Prime螺旋CT)。
1.3 统计学方法
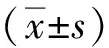
2 结果
2.1 血清PIVKA-Ⅱ、AFP水平及阳性率
PHC组PIVKA-Ⅱ、AFP水平高于肝硬化组和对照组,差异具有统计学意义(P<0.05);肝硬化组与对照组两项指标比较,差异无统计学意义(P>0.05)。PHC组PIVKA-Ⅱ及AFP阳性率高于肝硬化组和对照组,差异有统计学意义(P<0.05);而肝硬化组与对照组比较,差异无统计学意义(P>0.05)。见表1。
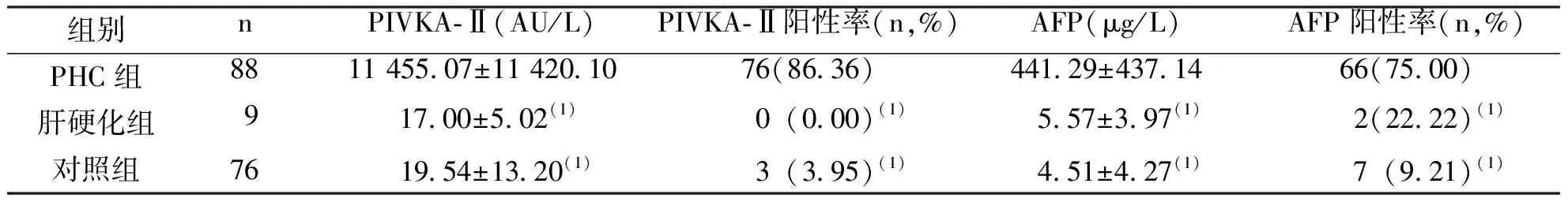
表1 各组被检者血清PIVKA-Ⅱ、AFP水平及阳性率Tab.1 Serum PIVKA-Ⅱ and AFP level and positive rate of 3 groups
(1)与PHC组比较,P<0.05
2.2 血清PIVKA-Ⅱ及AFP诊断PHC
血清PIVKA-Ⅱ、AFP单独使用对诊断PHC有较高的灵敏度、特异度和准确度,联合使用能提高诊断的特异度。见表2。
2.3 血清PIVKA-Ⅱ和AFP水平与肿瘤大小
结合PHC组上腹部增强CT检查得到每个患者肿瘤大小的数据,将它们按肿瘤大小分为≤50 mm组和>50 mm组。分析结果显示,肿瘤病灶>50 mm组的两项血清学指标高于肿瘤病灶≤50 mm患者,差异具有统计学意义(P<0.05);且肿瘤病灶≤50 mm组患者血清PIVKA-Ⅱ和AFP水平代于肿瘤病灶>50 mm组;差异有统计学意义(P<0.05)。见表3。
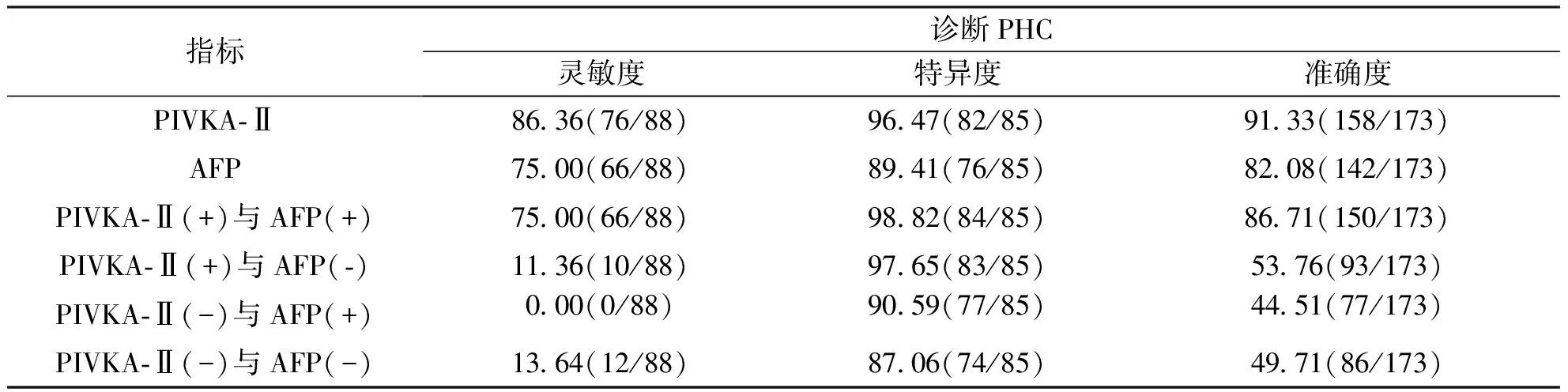
表2 血清PIVKA-Ⅱ及AFP单独或联合应用对PHC的诊断效能(%)Tab.2 The diagnosis capabilities of independent or combined PIVKA-Ⅱ and AFP
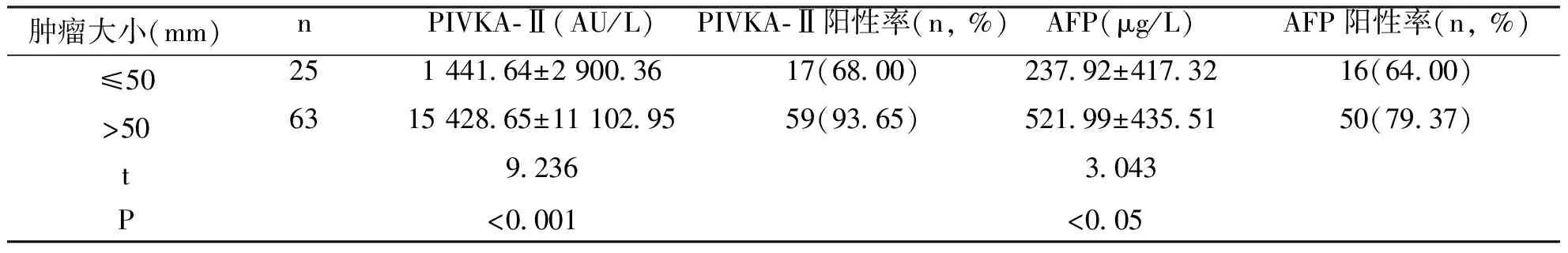
表3 不同肿瘤大小PHC患者血清PIVKA-Ⅱ和AFP水平Tab.3 Serum PIVKA-Ⅱ and AFP level of PHC patients with different tumor size
2.4 PHC治疗前后血清PIVKA-Ⅱ和AFP水平
PHC组88例患者中,有5例患者接受了手术、13例介入治疗(TACE);10例接受介入治疗后3 d,8例为手术或介入后1月复查血清PIVKA-Ⅱ和AFP,两者均明显下降,肿瘤变小,见表4。
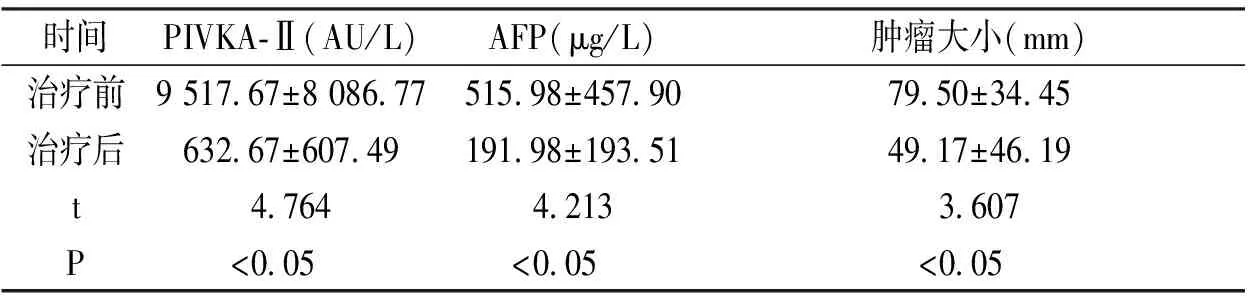
表4 例PHC患者治疗前后血清PIVKA-Ⅱ、AFP水平及肿瘤大小Tab.4 Before and after treatment of serum PIVKA-Ⅱ and AFP level of PHC patients
3 讨论
我国肝癌的发生常常由于感染乙肝所致,而肝癌的类型又以PHC为主,恶性程度高、治疗效果差、病死率相对较高,早发现、早诊断、早治疗能显著改善患者预后,根治性手术切除肿瘤仍然是肝癌治疗上最为行之有效的方案,小肝癌和非小肝癌的手术切除率分别为95.70%和51.20%,且术后5年生存率有显著的差异,分别为71.90%和15.40%[8],因此,能否寻找到肝癌早期诊断以及疗效监测的指标显得尤为重要。
长期以来,AFP联合上腹部B超、上腹部增强CT被作为经典的原发性肝癌的辅助诊断手段,并且写入NCCN指南来指导各级医院的临床工作。上腹部B超虽然是较为简单的无创性检查手段,但是该检查常受操作人员的水平以及腹腔内各种因素的影响,导致其诊断的敏感性及特异性难以提高。上腹部CT增强对腹腔实性占位有一定的辨识能力,可是对于一些小肝癌、不典型肝癌等的诊断,上腹部CT增强存在一定的局限性,可能无法对疾病的判断提供强有力的证据。自从1963年发现甲胎蛋白以来,由于其对肝癌的诊断具有一定的准确性、且标本留存方便而被临床广泛应用,但国内外多篇文献的分析发现其对原发性肝癌诊断的敏感性仅为54%~63%,特异性为82%~89%[9],且有30%~40%的的肝细胞肝癌患者呈阴性或低浓度[10],在活动性肝炎、胚胎源性肿瘤患者和妊娠等情况下患者血清AFP含量也可升高。故而,在肝癌的早期诊断及治疗上,需要进行更进一步的研究,从而寻找到更合理及更准确的方法以提高PHC的早期诊断符合率以及进行疗效的监测。
PIVKA-Ⅱ是1984年由Liebman发现并提出的新的监测PHC的指标,正常人血清中的PIVKA-Ⅱ含量极低,但它在PHC患者血清中会特异性升高。正常情况下,维生素K充足是肝脏合成凝血酶原的前提条件,PIVKA-Ⅱ是由肝细胞微粒体羧化酶系和环氧化物还原酶共同作用而产生的,其主要有4个功能域,1个γ-羧基谷氨酸区(Gla区),2个环状区和1个催化区。其中Gla区有10个依赖维生素K的Gla,处于肽链的氨基末端。在维生素K充足时,上述的10个(第6、7、14、16、19、20、25、26、29和32位点)Gla将全部转化成γ-羧基谷氨酸,从而形成正常的凝血酶原。当维生素K不足或无法利用时,γ-羧基谷氨酸无法由分子中的一个或多个谷氨酸残基羧化转变,无法结合钙离子和磷脂,从而丧失了凝血活性。有实验表明在肝癌组织中γ-谷氨酸羧化酶活性下降明显,而正常肝组织中未检测到γ-谷氨酸羧化酶活性异常,从而肝癌组织中γ-谷氨酸羧化酶活性下降导致了异常凝血酶原的形成。肝癌组织由于多种原因能产生PIVKA-Ⅱ并释放入血[11-12],但目前其产生机制尚未完全明确。PIVKA-Ⅱ在PHC患者的血清学指标中阳性率较高,在日本和美国等国家中已尝试将PIVKA-Ⅱ作为PHC的血清肿瘤标志物的常规检测指标,研究发现,PIVKA-Ⅱ的诊断的灵敏性和特异性均高于AFP[13-14]。而且肝癌的早期诊断应着重对慢性肝病定期监测,发现了PIVKA-Ⅱ升高的高危人群应定期随访并结合影像学等检查以提高早期肝癌的诊断符合率,从而能够降低肝癌的漏诊率和误诊率[15]。
在本研究表明,PHC组PIVKA-Ⅱ、AFP分别高于肝硬化组和对照组,且差异具有统计学意义(P<0.05)。PIVKA-Ⅱ与AFP联合诊断的准确度均高于单一指标的准确度,所以相较于经典的AFP,AFP协同PIVKA-Ⅱ能明显提高诊断的准确性。并且肿瘤病灶>50 mm的患者PIVKA-Ⅱ及AFP阳性率高于≤50 mm的患者(P<0.001),但在≤50 mm的患者中,AFP诊断的灵敏度及特异度均不理想[16],而PIVKA-Ⅱ指标的阳性率却高于AFP,故在小肝癌中PIVKA-Ⅱ的诊断效能高于AFP。AFP阴性的PHC患者中,PIVKA-Ⅱ能协助AFP诊断,从而能够大大降低PHC患者的漏诊率和误诊率。而且在该实验中发现PHC患者在经过治疗后血清学指标水平及肿瘤大小均较治疗前明显降低(P<0.05),说明PIVKA-Ⅱ、AFP在疗效的评估方面具有一定的临床实用价值。
综上所述,PIVKA-Ⅱ诊断PHC具有较高的灵敏度和特异度,同时它对小肝癌较为敏感,能填补AFP对此判断的不足,PIVKA-Ⅱ和AFP之间通过优势互补作用,能明显提高彼此的诊断效能,对于我国早期肝癌,尤其是PHC患者的早期发现、早期诊断、早期治疗具有良好的临床实用价值,对治疗后疗效的监测具有较大的价值。
