GnRH-a联合腹腔镜手术治疗子宫内膜异位症的效果观察
2019-01-25温灿良钟卓慧
温灿良,颜 璨,钟卓慧
(广州市妇女儿童医疗中心,广东广州 510623)
子宫内膜异位症是指有活性的内膜细胞在子宫内膜以外的区域种植而引发的妇科疾病,其作为一种器官依赖性、免疫性与炎症性病变,可引发月经改变、性交疼痛、盆腔疼痛等问题,还有恶变的发展倾向,需及时进行干预[1]。腹腔镜手术是治疗子宫内膜异位症的首选方法,具有恢复快、创伤小等优点,但不利于清除微小病灶,且复发率较高[2]。促性腺激素释放激素激动剂(gonadotropin-releasing hormone angonist,GnRH-a)是促性腺激素释放激素(GnRH)的同工异构体,活性明显强于GnRH,且与GnRH受体的亲和力更高。GnRH-a可抑制垂体释放黄体生成素(LH)和促卵泡激素(FSH),从而抑制卵巢功能,GnRH-a所致的低雌激素血症可导致异位的子宫内膜萎缩,从而治疗子宫内膜异位症[3]。为探寻治疗子宫内膜异位症的有效方法,维护患者健康,本研究探讨了GnRH-a联合腹腔镜手术治疗子宫内膜异位症的临床效果。
1 资料与方法
1.1 一般资料 选取2016年5月至2018年5月我院收治的子宫内膜异位症患者84例,随机分为2组,各42例。观察组年龄20~39岁,平均(29.01±3.60)岁;病程2~11周,平均(4.47±1.19)周;r-AFS分期情况:Ⅰ期5例,Ⅱ期16例,Ⅲ期17例,Ⅳ期4例。对照组年龄21~39岁,平均(29.12±3.67)岁;病程2~11周,平均(4.51±1.23)周;r-AFS分期情况:Ⅰ期5例,Ⅱ期17例,Ⅲ期16例,Ⅳ期4例。本研究经我院医学伦理委员会批准,患者及其家属对本研究均知情,并签署知情同意书。比较两组患者年龄、病程、r-AFS分期等一般资料,差异无统计学意义(P>0.05),具有可对比性。
1.2 入选标准 ⑴纳入标准:①入选者均存在腰痛、性交痛、下腹痛等症状,且均经病理诊断与B超检查证实;②可正常排卵;③子宫活动度不强,且后穹窿存在触痛性结节。⑵排除标准:①合并子宫腺肌症、严重心肝肾功能不全、高血压、恶性肿瘤、造血系统疾病、糖尿病者;②对本研究药物过敏者;③妊娠、哺乳期女性。
1.3 方法
1.3.1 对照组:单纯行腹腔镜手术,手术方法参照文献[4]:患者取截石位,气管插管静脉复合麻醉,麻醉满意后建立气腹,设置压力为10~12mmHg;采用四孔法入腹,根据患者的具体情况实施粘连松解术、卵巢囊肿剔除术或病灶电凝术;术后常规使用生理盐水冲洗盆腔,并将病理标本送检。
1.3.2 观察组:实施GnRH-a联合腹腔镜手术。腹腔镜手术操作步骤与对照组相同;在腹腔镜术后月经恢复第1~3d,使用醋酸戈舍瑞林缓释植入剂(英国阿斯利康制药公司,进口药品注册证号:H20160259)3.75mg/次,皮下注射,一个月经周期注射1次,治疗时间6个月。
1.4 评价指标 ①疗效:治疗6个月后观察两组患者的疗效。疗效标准:临床症状消失,血液指标正常,妇科检查未发现阳性体征,B超提示无盆腔包块为显效;临床症状缓解,血液指标改善,妇科检查未发现阳性体征,B超提示无盆腔包块为有效;临床症状进行性加重或无改善,血液指标无改善,妇科检查提示阳性体征,B超可见盆腔包块为无效。治疗总有效率=显效率+有效率。②分别于治疗前、治疗6个月后,使用彩色超声诊断系统(迈瑞,Resona 70B)检测子宫内膜厚度。③分别于治疗前、治疗6个月后抽取患者空腹静脉血,使用发光免疫分析仪(美国贝克曼,Access 2型)采用化学免疫发光法检测血清雌二醇(E2)、LH和FSH的水平。
1.5 统计分析 使用SPSS 20.0统计学软件。计数资料以百分率和例数表示,组间比较采用卡方检验;计量资料采用(±s)表示,组间比较采用两独立样本t检验、组内比较采用配对本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 观察组显效22例、有效17例、无效3例,治疗总有效率为92.86%(39/42);对照组显效13例、有效19例、无效10例,治疗总有效率为76.19%(32/42)。观察组患者治疗总有效明显高于对照组(χ2=4.459,P=0.035)。
2.2 子宫内膜厚度 治疗前两组患者子宫内膜厚度比较,差异无统计学意义(P>0.05)。治疗后,两组患者子宫内膜厚度均明显低于治疗前(P<0.05);并且,治疗后观察组患者子宫内膜厚度明显低于对照组(P<0.05)。见表1:
表1 两组子宫内膜厚度对比(±s,mm)
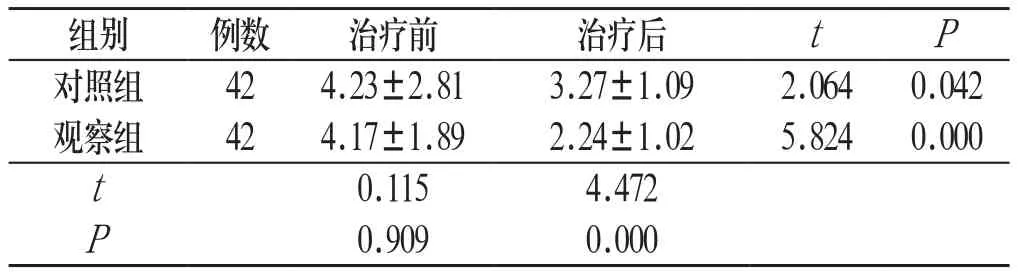
表1 两组子宫内膜厚度对比(±s,mm)
组别 例数 治疗前 治疗后 t P对照组 42 4.23±2.81 3.27±1.09 2.064 0.042观察组 42 4.17±1.89 2.24±1.02 5.824 0.000 t 0.115 4.472 P 0.909 0.000
2.3 性激素水平 两组患者治疗前E2、LH、FSH水平比较,差异均无统计学意义(P>0.05)。与治疗前比较,两组患者治疗后的E2、LH、FSH水平均明显降低(P<0.05);并且,观察组患者治疗后的E2、LH、FSH水平明显低于对照组治疗后(P<0.05)。见表2:

表2 两组患者治疗前后性激素水平对比(x ± ,n=42)s
3 讨论
目前,临床上对于子宫内膜异位症的发病机制尚未形成统一意见,认为子宫内膜种植、免疫缺陷、雌激素及遗传因素等均与子宫内膜异位症的发生发展有关[5]。流行病学资料显示,育龄女性子宫内膜异位症的发病率约在2%~5%之间,在不孕症女性患者中发病率可达25%~40%[6]。临床多采用药物或手术等方式治疗子宫内膜异位症,其中药物治疗包括激素治疗和对症治疗。虽然激素治疗的疗效确切,但不良反应较大、患者接受度低;对症治疗仅能改善临床症状,但难以根治。因此,需要寻找一种更为科学有效的治疗子宫内膜异位症的方法。
腹腔镜手术为微创外科治疗技术,能够最大程度地去除病灶,减少手术操作对生育功能的不良影响,维护卵巢功能;GnRH-a与机体内源性GnRH的化学结构相似,半衰期较长,进入机体后可降低LH、FSH和E2的水平,加快异位内膜的萎缩退化,治疗子宫内膜异位症的疗效确切[7]。本研究观察了腹腔镜手术联合GnRH-a治疗子宫内膜异位症的临床效果,结果显示,观察组治疗总有效率明显高于对照组,治疗后子宫内膜厚度及血清E2、LH、FSH水平明显低于对照组。可见与单纯腹腔镜手术治疗子宫内膜异位症相比,联合GnRH-a治疗子宫内膜异位症具有明显优势。子宫内膜异位症很少发生于月经初潮前;手术或生理因素引起绝经后,通常可抑制异位内膜的病变;若未服用外源性雌激素,绝经后很少新发生子宫内膜异位症,这些证据均支持子宫内膜异位症属于雌激素依赖性疾病。腹腔镜手术可切除异位的内膜病灶和分解盆腔粘连,但无法根除微小病灶,因此容易复发;在腹腔镜手术的同时,给予GnRH-a辅助治疗,可以使腹腔镜手术难以切除的微小病灶萎缩退化,因此治疗效果满意。GnRH-a辅助治疗子宫内膜异位症能降低患者E2、LH、FSH等性激素的水平,在缓解患者症状的同时,能增加输卵管的顺应性,减少周期性出血,防止子宫内膜组织播散,改善子宫环境,因此GnRH-a辅助治疗能加快异位内膜的退化进程,且能避免复发[8-10]。
综上所述,采用GnRH-a与腹腔镜手术联合的方法治疗子宫内膜异位症可明显提高疗效,降低患者子宫内膜厚度,调节患者激素水平,从而有利于促进患者恢复、改善患者预后。
