侧柏叶HPLC 指纹图谱建立及4 种成分测定
2019-01-25宗珊珊苏本正石典花戴衍朋孙立立张学顺
宗珊珊, 苏本正, 石典花,∗, 戴衍朋, 孙立立, 张学顺
(1. 山东中医药大学, 山东 济南250355; 2. 山东省中医药研究院, 山东 济南250014; 3. 山东中医药大学附属医院, 山东 济南250011)
侧柏叶来源于柏科植物侧柏Platycladus orientalis (L.) Franco 的枝梢及叶, 多在夏、 秋两季采收、 阴干, 其气清香、 味苦涩, 归肺、 肝、 脾经, 具有凉血止血、 化痰止咳、 生发乌发的功效,主要用于吐血、 衄血、 咯血、 便血、 崩漏下血、 肺热咳嗽、 血热脱发、 须发早白[1], 化学成分主要有挥发油类[2-4]、 黄酮类[5-8]、 鞣质类[9-10]等, 主要为黄酮类[11], 其中总黄酮具有抑制α-糖苷酶、 抗RBC 氧化损伤、 激活毛母细胞、 促进血液循环、养发、 生发作用; 杨梅苷具有收缩血管、 降血糖、抗氧化、 保肝、 利胆、 抗炎、 抗突变、 抗肿瘤[12]、镇痛作用[13]; 槲皮苷具有止咳平喘、 抗炎、 抗过敏、 解痉、 强心、 降血压、 扩张冠脉、 降血脂、 抗心律失常、 抗血小板聚集、 抗氧化、 抗肿瘤作用[14]; 穗花双黄酮具有抗炎、 抗氧化、 抗微生物、抗肿瘤和神经保护作用, 可减轻脑损伤, 提高神经可塑性, 改善神经退行性疾病[15]。
目前, 《中国药典》 及文献报道侧柏叶含有量测定的指标成分大多为槲皮苷[16], 为进一步有效控制其质量, 本实验在前期研究的基础上建立了异槲皮苷、 槲皮苷、 穗花双黄酮的TLC 鉴别、 HPLC指纹图谱及含有量测定的方法, 为进一步有效提升该药材质量标准[17]提供参考。
1 仪器与试药
1.1 仪器 Mettler XS205DU 电子天平(十万分之一, 瑞士Mettler-Tolodo 公司); 超声处理机(济宁市中区鲁超仪器厂); 紫外仪(上海精科实业有限公司); 水浴锅(上海医疗器械五厂); 鼓风干燥箱(上海精宏实验设备有限公司); 硅胶G 板(青岛海洋化工厂); UitiMate3000 高效液相色谱仪(配置UV 检测器)、 Waters 2695 高效液相色谱仪(配置Waters 2996 DAD 检测器) (美国Waters公司)。
1.2 试药 杨梅苷、 异槲皮苷、 槲皮苷、 穗花双黄酮对照品均购于成都普瑞法科技开发有限公司( 批 号 PRF8031443、 PRF8030703、 16022001、PRF7122043)。 10 批侧柏叶为课题组于不同时间、地点采集后晾干净制, 分别为济南燕子山(1 号、5 号)、 济南南部山区(2 号、 4 号)、 济南佛慧山(3 号)、 临沂东山(6 号)、 临沂洪山(7 号)、 临沂西北山(8) 号、 临沂费县(9 号) 和济南章丘(10 号), 经山东省中医药研究院林惠彬研究员鉴定为正品。 甲醇、 磷酸、 乙腈均为色谱纯; 水为纯净水。
2 方法与结果
2.1 TLC 鉴别 取侧柏叶粉末1 g, 加70% 甲醇20 mL 超声30 min, 过滤, 滤液蒸干, 加甲醇2 mL溶解, 作为供试品溶液。 取异槲皮苷、 槲皮苷、 穗花双黄酮对照品适量, 加甲醇制成质量浓度分别为0.1、 1、 0.1 mg/mL 的混合对照品溶液。 按照薄层色谱法(通则0502), 吸取供试品、 对照品溶液各3 μL, 分别点于同一硅胶G 薄层板上, 以乙酸乙酯-甲醇-水 (100 ∶17 ∶13) 为展开剂, 展至约3 cm, 取出, 晾干, 再以甲苯(水饱和) -甲酸乙酯-甲酸(4.5 ∶4.5 ∶1) 为展开剂, 展开, 取出,晾干, 喷以1%三氯化铝试液, 100 ℃加热5 min,置紫外光灯(365 nm) 下检视, 结果见图1, 表明10 批侧柏叶在与穗花双黄酮、 槲皮苷、 异槲皮苷对照品色谱的相应位置上均显相同颜色的荧光斑点。
2.2 侧柏叶HPLC 指纹图谱
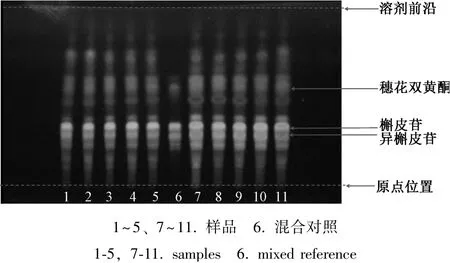
图1 10 批样品TLC 图谱(365 nm)Fig.1 TLC chromatogram of ten batches of samples(365 nm)
2.2.1 色谱条件 Waters Symmetry C18色谱柱(250 mm×4.6 mm, 5 μm); 乙腈(A) -0.1%磷酸(B) 为流动相, 梯度洗脱(0~30 min, 10% ~20%A; 30~50 min, 20% ~40%A; 50 ~90 min, 40% ~70%A; 90~110 min, 70% ~100%A); 柱温30 ℃;体积流量1 mL/min; 检测波长355 nm; 进样量5 μL。
2.2.2 溶液制备
2.2.2.1 供试品溶液 取侧柏叶粉末1 g, 精密称定, 置具塞锥形瓶中, 加甲醇25 mL, 称定质量,超声处理30 min, 放冷, 甲醇补足减失的质量, 摇匀, 过滤, 取续滤液, 过0.45 μm 微孔滤膜,即得。
2.2.2.2 对照品溶液 精密称取杨梅苷、 槲皮苷、异槲皮苷、 穗花双黄酮对照品适量, 加甲醇制成质量浓度分别为97.4、 10.03、 120、 13.34 μg/mL 的对照品溶液。
2.2.3 方法学验证
2.2.3.1 精密度试验 取供试品溶液(3 号), 在“2.2.1” 项色谱条件下连续进样6 次, 测得各色谱峰相对保留时间RSD<0.1%, 相对峰面积RSD<5%, 表明仪器精密度良好。
2.2.3.2 稳定性试验 取供试品溶液(3 号), 在“2.2.1” 项色谱条件下于0、 2、 4、 8、 12、 24 h进样, 测得各色谱峰相对保留时间RSD<0.13%,相对峰面积RSD<5%, 表明供试品溶液在24 h 内稳定性良好。
2.2.3.3 重复性试验 取3 号样品6 份, 按“2.2.2.1” 项 下 方 法 制 备 供 试 品 溶 液, 在“2.2.1” 项色谱条件下进样, 测得各色谱峰相对保留时间RSD<0.1%, 相对峰面积RSD<5%, 表明该方法重复性良好。
2.2.4 指纹图谱建立
2.2.4.1 色谱峰归属 按“2.2.2.1” 项下方法制备10 批供试品溶液, 在“2.2.1” 项色谱条件下进样, 记录峰面积, 将指纹图谱导入“中药色谱指纹图谱相似度评价系统2.0 版” 进行分析,结果见图2, 标定了18 个共有峰, 见图3。 与对照品色谱图(图4) 保留时间比较, 确定第3、 4、6、 12 号色谱峰分别为杨梅苷、 异槲皮苷、 槲皮苷、 穗花双黄酮。 图3 中, 6 号槲皮苷峰前后无杂质峰干扰, 分离度较高, 峰形较好, 峰面积相对稳定, 故将其确定为参照峰, 各特征峰相对保留时间应在规定值的±5%之内。s
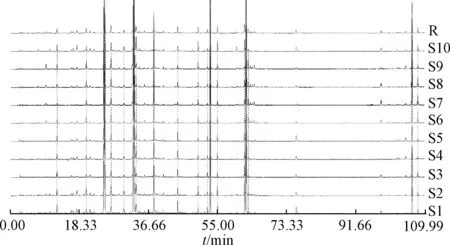
图2 10 批样品HPLC 指纹图谱Fig.2 HPLC fingerprints of ten batches of sample
2.2.4.2 相似度 将10 批样品指纹图谱数据导入相似度评价软件, 生成对照图谱, 经多点校正、 色谱峰匹配计算相似度, 结果见表1。 由表可知, 10批样品指纹图谱相似度均在0.98 以上, 表明不同时间、 地点采集的侧柏叶的质量差异不大。
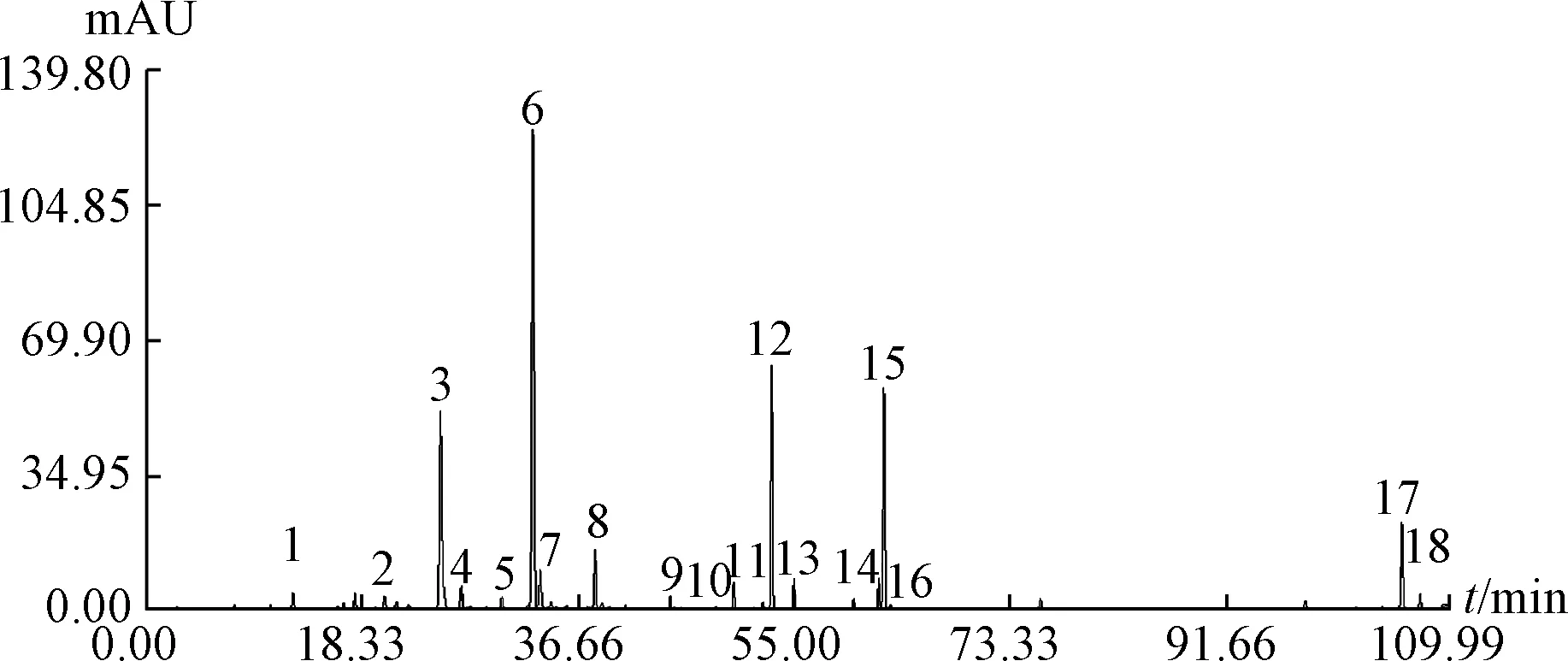
图3 10 批样品共有峰Fig.3 Common peaks of ten batches of samples

图4 对照品色谱峰Fig.4 Chromatographic peaks of reference substances

表1 10 批样品相似度Tab.1 Similarities of ten batches of samples
2.3 侧柏叶含有量测定
2.3.1 色谱条件 Phenomenex Gemini 色谱柱(250 mm×4.60 mm, 5 μm); 乙腈(A) -0.1%磷酸(B) 为流动相, 梯度洗脱(0~20 min, 17%A;20~60 min, 17% ~50%A); 柱温35 ℃; 体积流量1 mL/min; 检测波长355 nm; 进样量10 μL。
2.3.2 溶液制备
2.3.2.1 供试品溶液 取侧柏叶粉末1 g, 精密称定, 置具塞锥形瓶中, 加甲醇25 mL, 称定质量,超声处理30 min, 放冷, 甲醇补足减失的质量, 摇匀, 过滤, 取续滤液, 0.45 μm 微孔滤膜过滤,即得。
2.3.2.2 对照品溶液 精密称取杨梅苷、 槲皮苷、异槲皮苷、 穗花双黄酮对照品适量, 加甲醇制成质量浓度分别为0.974、 0.100、 1.20、 0.133 mg/mL的对照品溶液。
2.3.3 方法学考察
2.3.3.1 系统适应性试验 按照高效液相色谱法(2015 版 《中 国 药 典》 四 部 通 则0512), 在“2.3.1” 项色谱条件下精密吸取对照品、 供试品溶液各10 μL 进样。结果, 对照品溶液与供试品溶液在相同保留时间有相应峰形, 峰形对称, 无拖尾现象, 见图5~6。
2.3.3.2 线性关系考察 精密吸取对照品溶液1 mL, 置10 mL 量瓶中, 甲醇溶解并定容至刻度,摇匀, 精密吸取0、 2、 4、 6、 8、 10、 15 μL, 在“2.3.1” 项色谱条件下进样, 以进样量为横坐标(X), 峰面积为纵坐标(Y) 进行回归, 得杨梅苷、 异槲皮苷、 槲皮苷、 穗花双黄酮回归方程分别为Y =33.394X +0.060 4(R2=0.999 7)、 Y =0.027 4X+0.053 6(R2=0.995 3)、 Y =0.029 8X-0.055 1 (R2=0.999 8)、 Y =4.622 9X +0.188 3(R2=0.999 9), 分别在0 ~1.461 0、 0 ~150.45、0~1 800、 0~50.1 ng 范围内线性关系良好。

图5 对照品HPLC 色谱图Fig.5 HPLC chromatograms of reference substances

图6 侧柏叶HPLC 色谱图Fig.6 HPLC chromatograms of Platycladi Cacumen
2.3.3.3 精密度试验 精密吸取供试品溶液(3号样品), 在“2.3.1” 项色谱条件下连续进样6次, 每次10 μL, 测得杨梅苷、 异槲皮苷、 槲皮苷、 穗花双黄酮峰面积RSD 分别为0.16%、0.14%、 0.09%、 0.07%, 表明仪器精密度良好。
2.3.3.4 稳定性试验 精密吸取3 号样品供试品溶液, 在“2.3.1” 项色谱条件下于0、 2、 4、 6、8、 10、 12、 24 h 进样, 测得杨梅苷、 异槲皮苷、槲皮苷、 穗花双黄酮峰面积RSD 分别为0.48%、0.56%、 0.59%、 0.62%, 表明溶液在24 h 内稳定性良好。
2.3.3.5 重复性试验 按“2.3.2.1” 项下方法平行制备供试品溶液5 份 (3 号样品), 在“2.3.1” 项色谱条件下进样, 测得杨梅苷、 异槲皮苷、 槲皮苷、 穗花双黄酮含有量RSD 分别为1.92%、 1.54%、 1.61%、 1.84%, 表明该方法重复性良好。
2.3.3.6 加样回收率试验 取含有量已知的3 号样品0.5 g, 精密称定5 份, 置于具塞锥形瓶中,分别加入1 mL 适宜浓度的上述4 种对照品溶液,再加入甲醇21 mL, 称定质量, 超声30 min, 放冷, 甲醇补足减失的质量, 过滤, 滤液过0.45 μm微孔滤膜, 得供试品溶液, 在“2.3.1” 项色谱条件下进样, 测得杨梅苷、 异槲皮苷、 槲皮苷、 穗花双黄酮的平均加样回收率分别为101.77%、107.73%、 101.75%、 105.95%, RSD 分 别 为2.93%、 1.50%、 2.74%、 1.35%。
2.3.3.7 样品含有量测定 取10 批样品, 按“2.3.2.1” 项 下 方 法 制 备 供 试 品 溶 液, 在“2.3.1” 项色谱条件下进样, 计算含有量, 结果见表2。
3 讨论与结论
本实验在TLC 鉴别中通过展开系统的优选,最终确定采用二次展开, 此时槲皮苷、 异槲皮苷、穗花双黄酮3 种成分均分离完全、 斑点清晰, 故可将其作为侧柏叶药材或饮片TLC 鉴别的指标性成分。
然后, 考察了甲醇-水、 乙腈-水、 甲醇-磷酸、乙腈-磷酸等系统, 结果表明乙腈-磷酸系统中杂质峰干扰较少, 分离度较高, 峰形较好, 峰面积较稳定, 故选用其进行梯度洗脱。 再建立了侧柏叶HPLC 特征指纹图谱, 并进行方法学考察, 在18个共有特征峰中辨识出槲皮苷、 异槲皮苷、 杨梅苷、 穗花双黄酮, 其中槲皮苷峰无杂质峰干扰, 分离度高, 峰形良好, 峰面积稳定, 故确定其为参照峰。

表2 各成分含有量测定结果(mg/g, n=2)Tab.2 Results of content determination of various constituents (mg/g, n=2)
含有量测定结果表明, 10 批样品中4 种黄酮类成分存在一定差异, 这可能与产地、 采收时间及生长年限有关。 结合2015 年版《中国药典》 侧柏叶项下槲皮苷含有量限度, 初步将其中4 种黄酮类成分的含有量限度设定为平均值下浮50% (杨梅苷不得少于0.10%, 异槲皮苷不得少于0.01%,槲皮苷不得少于0.20%, 穗花双黄酮不得少于0.03%)。
综上所述, 本实验建立的侧柏叶TLC 鉴别、HPLC 指纹图谱及杨梅苷、 异槲皮苷、 槲皮苷、穗花双黄酮含有量测定方法均简便可行, 可用于控制该药材质量, 进而保障其临床疗效。 今后,将继续研究在指纹图谱中或建立一测多评法测定上述成分含有量, 以期在提高标准的同时节省成本和资源。
